猪轮状病毒DN30209株VP4全长蛋白表达及多抗制备和鉴定
任晓峰,窦秀静,郝雅环,孙刘妹,魏小宁
(东北农业大学动物医学学院,哈尔滨 150030)
猪轮状病毒DN30209株VP4全长蛋白表达及多抗制备和鉴定
任晓峰,窦秀静,郝雅环,孙刘妹,魏小宁
(东北农业大学动物医学学院,哈尔滨 150030)
为开展猪轮状病毒(PRV)及其VP4蛋白相关特性研究,参照GenBank所收录的猪轮状病毒JL94、OSU等株序列设计一对特异性引物,从实验室分离鉴定的猪轮状病毒DN30209株扩增约2 330 bp VP4全长基因,并成功构建重组质粒VP4-pMD18-T。重组质粒经测序、序列比对及分析。结果表明,DN30209株VP4全基因长2 331 bp,与参考株JL94的核苷酸同源性为99.7%,氨基酸同源性为99.5%。将VP4基因连接到pGEX-6P-1原核表达载体中,构建并筛选出阳性原核表达载体重组质粒VP4-pGEX-6P-1。阳性重组质粒转化Rosetta宿主菌感受态细胞中,经IPTG诱导,获得以包涵体形式表达的重组蛋白,融合蛋白大小约为112 ku,与预期大小相符。回收、纯化并复性该蛋白,将其作为免疫原免疫大白兔,制备兔抗PRV VP4全长蛋白多克隆抗体,间接ELISA测定多抗效价到1∶105,间接免疫荧光(IFA)和免疫印迹(Western blot)检测表明该多抗均可与PRV具有很好的抗原抗体反应性,为猪轮状病毒研究提供有效实验材料。
猪轮状病毒;克隆;原核表达;抗体制备
猪轮状病毒(Porcine rota virus,PRV)属于呼肠孤病毒科,轮状病毒属,是幼年仔猪发生腹泻的主要病原之一。轮状病毒无囊膜,其病毒颗粒结构包括三层蛋白,最内层包括VP2、VP1和VP3,构成病毒核心,VP6到VP2产生第二层,最外层主要由两种蛋白构成,包括VP4和VP7[1]。VP4是病毒生命周期中最重要的蛋白,包括病毒-受体结合以及病毒繁殖。VP4蛋白通过蛋白水解酶水解,可裂解为VP8和VP5,故该蛋白又称蛋白酶-敏感蛋白(Protease-sensitive protein),这一过程对病毒进入细胞尤为重要[2]。
PRV粒子表面有三种重要的抗原,即群抗原VP6、中和抗原VP7以及血凝素抗原VP4。其中,VP4抗原具有血凝作用,是诱导机体产生中和抗体的主要抗原[3-4]。由于其表面蛋白VP7与VP4的高度可变性和均可独立诱导产生中和抗体的特点,分别建立依据蛋白VP7和VP4的两个独立的血清型分类系统,即由VP7决定的“G”型和由VP4决定的“P”型[5]。VP4由RV基因片段4编码,由776个氨基酸组成,分子质量88 ku,占病毒蛋白总量的1.5%,属外衣壳蛋白。扫描电镜观察发现,VP4以二聚体形式存在[6]。
VP4蛋白是重要的生物学功能性蛋白,①其能介导该病毒与易感细胞系的吸附过程,赋予病毒致病性。VP4经胰蛋白酶作用的裂解位点在aa241或aa247处,分别裂解为两条长度不等的肽段VP8和VP5。其中,VP8具有吸附宿主细胞的作用;VP5主要与病毒穿入宿主细胞有关[7];②促进空斑形成,在胰酶作用下,其能促进体外培养细胞形成空斑,说明VP4与病毒毒力密切相关。根据VP4抗原性不同,可将轮状病毒分为不同的血清型(P型),至今已知有21个不同的P血清型[8];③VP4还有中和抗原作用,自然感染后,可刺激机体产生中和抗体[9]。
目前,对猪轮状病毒VP4研究较多,但对猪轮状病毒VP4蛋白全长的表达仍未见报道,而VP4蛋白全长多抗是试验研究重要材料之一。本试验利用大肠杆菌表达系统成功表达VP4的全长蛋白,并制备兔源的多克隆抗体,通过免疫印迹分析,该多抗能与PRV产生良好抗原抗体反应,有效的识别病毒VP4天然蛋白,通过间接免疫荧光分析,该蛋白表达在细胞膜上。该多克隆抗体可为PRV研究奠定基础。
1 材料与方法
1.1 材料
1.1.1 病毒和细胞
猪轮状病毒(PRV)DN30209株由东北农业大学分子病原学与公共卫生实验室分离并保存;恒河猴胚胎肾细胞(MA104)由东北农业大学分子病原学与公共卫生实验室保存。
1.1.2 菌株与载体
大肠杆菌菌株JM109、Rossetta由东北农业大学分子病原学与公共卫生实验室保存;pMD18-T购自于大连TaKaRa公司;原核表达载体pGEX-6P-1由东北农业大学分子病原学与公共卫生实验室保存。
1.1.3 主要试剂
RNA提取试剂、反转录酶(购自上海飞捷生物技术有限公司);PCR试剂盒、DNA纯化胶回收试剂盒;T4DNA连接酶及其缓冲液、dNTPs、LA Taq DNA聚合酶、BamH I和Sal I、LA Tag DNA聚合酶、T4DNA连接酶(均购自TaKaRa公司);PCR Marker DL5000(购自上海鼎国生物公司);小量质粒DNA提取试剂盒(购自于索莱宝公司);HRP标记羊抗兔IgG抗体(购自武汉博士德公司);DMEM细胞培养液(购自GIBCO公司);DNA标准分子质量trans plus II(购自北京全氏金公司);蛋白质Marker(中)(购自MBI公司)。
1.1.4 实验动物
体重约为2~2.5 kg·只-1的雌性新西兰大白兔,购自哈尔滨市某实验动物中心。
1.2 方法
1.2.1 病毒的培养
将实验室保存的PRV病毒与30 μg·mL-1胰蛋白酶按1∶1混合,37℃孵育1 h,取6孔板长至80%的MA104细胞,弃去细胞培养液,1×PBS洗3次,按原培养液的10%量加入胰酶处理过的病毒液,37℃吸附1h,每隔15 min轻摇1次,加入维持液(不含血清的DMEM),并加入胰酶使终浓度为3 μg·mL-1,37℃5%CO2培养,逐日观察CPE。24 h后出现明显的CPE,待细胞脱落80%~90%收毒,反复冻融3次,整个试验过程设置细胞对照。
1.2.2 RT-PCR扩增VP4基因
根据GenBank中JL94和OSU等毒株,利用Oligo设计一对引物,上游VP4-1:GGATCCGGCTA TAAAATGGCTTC(BamH I),下游VP4-2:GTCGAC TGACTCTAGACACTGCTTA(Sal I)由博士生物工程技术有限公司合成,预计扩增目的片段2 331 bp。取经反复冻融3次的PRV细胞培养物200 μL,按照提取RNA试剂盒提取RNA,通过cDNA合成试剂盒,进行反转,采用20 μL反应体系:M-MuLV 1 μL;5×RT-PCR Buffer 4 μL;dNTP(10 mmol·L-1)1 μL;RNA 5 μL;下游引物VP4-2 1 μL;Rnase Inhibitor 0.5 μL;DEPC水7.5 μL;反应程序:30℃10 min;42℃60 min;95℃5 min。以该cDNA为模板,经PCR扩增该目的片段,采用50 μL PCR反应程序:10×LA Taq buffer 5 μL;LA Taq 0.3 μL;dNTP(2.5 mmol·L-1)4 μL;cDNA 4 μL;VP4-1 1 μL;VP4-2 1 μL;ddH2O 34.7 μL;94℃预变性5 min;94℃变性30 s;52.8℃退火30 s;72℃延伸3 min;35个循环后,72℃再延伸10 min。PCR产物经过琼脂糖凝胶电泳鉴定。
1.2.3 重组质粒VP4-pMD18-T质粒的构建
将纯化的VP4 PCR产物与pMD18-T按照说明书进行连接,转化,挑菌,摇菌,经PCR及双酶切鉴定得到阳性重组质粒,将质粒送测序公司测序并命名为VP4-pMD18-T。
1.2.4 VP4-pGEX-6P-1重组质粒的构建
将VP4-pMD18-T与pGEX-6P-1分别用BamH I,Sal I双酶切,酶切产物经胶回收试剂盒回收纯化,按照1∶7的浓度比通过T4DNA连接酶连接,转化,挑菌,摇菌,经PCR和双酶切鉴定得到阳性重组质粒并命名为VP4-pGEX-6P-1。
1.2.5 重组VP4-pGEX-6P-1蛋白表达
将VP4-pGEX-6P-1质粒转化E.coli Rosetta感受态细胞中,挑取单菌落接种于含Amp+的LB培养基中,37℃振荡培养至OD600约为0.6~0.8,加入IPTG至终浓度1 mmol·L-1,37℃条件诱导表达,同时收集小时样,共6 h。将所收集的菌液4℃、12 000 r·min-1离心5 min收集沉淀,再用30 μL PBS悬起后加入等量2×SDS凝胶上样缓冲液,沸水煮10 min,进行SDS-PAGE电泳分析。
1.2.6 VP4蛋白纯化及复性
将诱导表达的菌液超声裂解处理,SDS-PAGE蛋白电泳,将以包涵体形式表达的目的蛋白带切胶纯化,置于EP管中,加入适量的PBS,反复冻融3次,10 000 r·min-1离心10 min,收集上清,鉴定切胶结果。
将蛋白液置于处理过的透析袋中,置于复性液中1 h,换复性液放置2 h,1×TE buffer中4 h或过夜,20%PEG8000浓缩,测定蛋白浓度[10]。
1.2.7 重组蛋白免疫大白兔
将复性后的蛋白液作免疫原,首免:复性后的蛋白液(约2 mg)[11]与等体积的完全弗氏佐剂乳化充分,家兔背部皮下多点注射。10 d后二免,不完全弗氏佐剂与等体积的蛋白乳化,经背部皮下多点注射。7 d后三免,三免后3 d,耳缘静脉取血,测抗体效价[12-14]。效价达到一定值后,耳缘静脉直接注射约1 mg蛋白液,6 d后颈动脉取血,将血液置于37℃温箱2 h,转移至4℃过夜,4℃10 000 r·min-1离心20 min,收集血清,分装保存。
1.2.8 抗体效价检测及生物活性检测
1.2.8.1 间接ELISA检测兔抗VP4-pGEX-6P-1蛋白血清效价
将纯化的VP4蛋白为抗原包被酶标板,1 μg·孔-1,同时设2个副孔。5%脱脂乳4℃封闭过夜,PBST洗3次,每次5 min,将待测血清以10倍比稀释,同时将阴性血清作为阴性对照组以同样方法稀释,37℃孵育1 h,PBST洗3次后加入HRP标记的羊抗兔IgG(1∶5 000)37℃孵育1 h,PBST洗3次,经底物OPD显色后,2 mmol·L-1H2SO4终止反应,酶标仪测定OD490 nm处数值。
1.2.8.2 Western blot检测多抗的生物活性
刮取PRV感染的细胞及未感染的对照组细胞,用细胞裂解液裂解20 min,注射器反复吹打20次,4℃10 000 r·min-1离心10 min,吸取上清,加入等量的 2×上样 buffer,沸水煮 10 min,SDS-PAGE进行凝胶电泳,转移至NC膜,用含5%脱脂乳的PBST,4℃封闭过夜,以制备的抗VP4多抗血清为一抗(1∶1 000稀释),以HRP标记的羊抗兔IgG为二抗(1∶3 000稀释),DAB显色。
1.2.8.3 间接免疫荧光
传MA104细胞于24孔板待长至80%,100 TCID50接种PRV,同时设细胞对照组,感染24 h后,预冷PBS洗3次,加入350 μL预冷的多聚甲醛室温固定30 min,弃液加入350 μL预冷的0.1 mol·L-1甘氨酸,室温5 min,PBS洗3次,兔抗VP4蛋白多抗作为一抗1∶200稀释,37℃孵育45 min,PBS洗3次,FITC标记山羊抗兔IgG1∶200稀释37℃避光孵育30min。PBS洗3次,荧光倒置显微镜下观察结果。
2 结果与分析
2.1 VP4全长基因的扩增及VP4-pMD18-T重组质粒酶切鉴定
RT-PCR方法扩增的PRV VP4全长基因产物,经1%琼脂糖凝胶电泳后,凝胶中出现清晰的目的条带,大约为2 330 bp(如图1),与预期的片段大小2 331 bp相符。对VP4-pMD18-T质粒使用限制性内切酶BamH I、Sal I进行双酶切后,获得两段约为2 692和2 331 bp的片段,鉴定结果(如图1),与预测相符。

图1 PCR扩增及重组质粒VP4-pMD18-T和VP4-pGEX-6P-1酶切结果Fig.1 Results of PCR amplifying VP4 gene and double digestion of VP4-pMD18-T and VP4-pGEX-6P-1 plasmid
2.2 VP4全基因测序比对
为保证目的片段的准确性,将VP4-pMD18-T测序结果表明,克隆的VP4全基因片段大小为2 331 bp,含有完整的ORF2331 bp,编码777个氨基酸。由图2a可知,分离株DN30209与JL94、K71的核苷酸同源性分别为99.7%、99.4%、但与其他分离株的核苷酸同源性均不高于71%。由图2b可知,分离株DN30209与JL94、K71的氨基酸同源性分别为99.5%、99.0%、但与其他分离株的核苷酸同源性均不高于82%。由图3可知,通过该分离株和其他20个VP4基因型轮状病毒毒株VP4编码区核苷酸构建的系统遗传进化树分析发现,分离株DN30209与VP4型毒株JL94、K71处在一个分支。
2.3 重组质粒VP4-pGEX-6P-1的鉴定
以含重组质粒的菌落为模板进行VP4片断扩增,扩增产物于1%琼脂糖凝胶(含EB)中进行电泳,得到大小约2 331 bp特异性条带,与预计长度相符。VP4-pGEX-6P-1质粒使用限制性内切酶BamH I、Sal I进行双酶切后,获得两段约为4 984和2 331 bp的片段,鉴定结果(如图1),与预测大小相符。

图2 分离株DN30209和部分猪轮状病毒毒株VP4基因编码区氨基酸序列同源性分析Fig.2 Homology analysis based on VP4 gene amino acid sequence of porcine rotavirus isolated DN30209 strain

图3 DN30209 VP4基因进化树分析结果Fig.3 A phylogenetic tree was constructed based on these PRV VP4 nucleotide sequences
2.4 重组质粒的诱导表达及蛋白纯化
2.4.1 VP4-pGEX-6P-1蛋白表达的SDS-PAGE电泳分析
VP4-pGEX-6P-1与空载体pGEX-6P-1转化Rosetta,加入IPTG进行诱导表达后,经10% SDS-PAGE鉴定(如图4),在SDS-PAGE电泳凝胶中出现112 ku(融合蛋白)大小的条带。标签大小约为26 ku,由此推导出表达的与预期的85.6 ku结果相符。超声裂解表明蛋白主要以包涵体的形式存在(如图4)。

图4 重组菌pGEX-6P-1-VP4诱导表达及纯化的SDS-PAGE分析鉴定结果Fig.4 Identification results of induced and purified proteins VP4-pGEX-6P-1 via SDS-PAGE analysis
2.4.2 融合蛋白回收纯化的鉴定
切胶纯化融合VP4目的蛋白,经SDS-PAGE胶鉴定,位置大小正确,条带单一,结果如图4所示。
2.5 多克隆抗体效价检测
以纯化的VP4融合蛋白作为抗原包被ELISA反应板,分别与采集的多克隆抗体为一抗,同时以未免疫的兔血清为阴性对照,1∶5 000稀释的辣根过氧化物酶(HRP)标记山羊抗兔IgG为二抗,效价以实验组的OD490(P)/阴性血清对照组的OD490(N)>2作为判定阳性的标准,检测多抗血清的效价为1∶105,结果见图5。

图5 抗PRV VP4全长蛋白抗体效价分析Fig.5 Antibody titer of antibody against PRV VP4 complete protein
2.6 Western blot分析
病毒及细胞对照蛋白样品经SDS-PAGE电泳后,转移到NC膜上进行Western blot检测,结果显示,与病毒反应NC膜上出现86 ku条带,与蛋白反应NC膜上有一条约112 ku的条带(见图6),目的大小与预期相符。
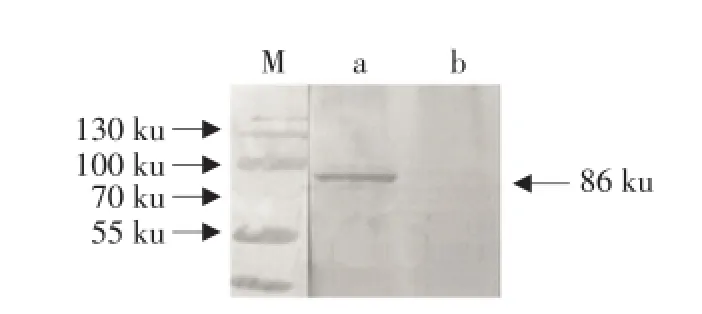
图6 VP4多抗与猪轮状病毒Western blot结果Fig.6 Western blot analysis result VP4 and poreine votavirus
Western blot结果显示,此抗血清能够特异性识别PRV VP4蛋白,而与细胞对照组无反应。
2.7 间接免疫荧光
间接免疫荧光结果证实,用兔抗VP4多抗血清检测感染PRV的MA104细胞可见有特异性的绿荧光信号,而正常细胞对照则没有检测到绿荧光,证明此多抗血清能够用于PRV的特异性检测(见图7)。
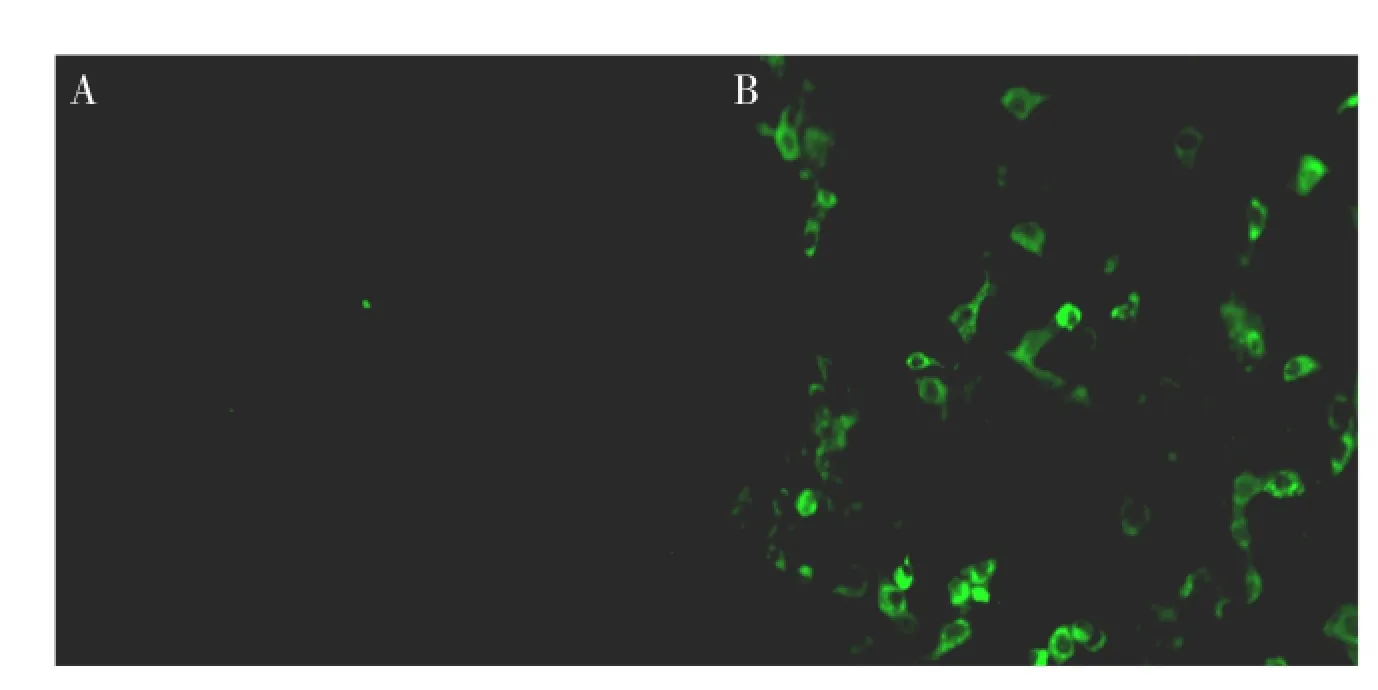
图7 PRV感染MA104细胞的免疫荧光检测抗体特异性Fig.7 Immunofluorescence analysis of PRV infected MA104 cell
3 讨论与结论
猪轮状病毒感染普遍流行,主要造成仔猪腹泻,影响猪生长发育,且用于人的轮状病毒疫苗大部分毒株来自动物源。因此,控制动物轮状病毒的感染,对保证畜牧业的健康发展具有重要意义,对于公共卫生安全也具有重要意义[15-17]。
田小艳研究报道轮状病毒VP4基因能够抑制病毒在MA 104细胞上生长,但是VP4基因对胰酶敏感,通过胰酶可使VP4基因特异性裂解为VP8 和VP5,使病毒具有感染性,易在细胞上生长[18]。VP4是猪轮状病毒最重要的结构蛋白之一,但其全长蛋白表达至今仍未见报道,本研究从东北农业大学分子病原学与公共卫生实验室分离的中国株猪轮状病毒DN30209株中克隆VP4基因全长,测序后,经过系统遗传进化树及核苷酸、氨基酸序列同源性分析发现:DN30209株的VP4基因核苷酸序列与JL94、K71处于同一分支,其中与JL94株的同源性最高,达到99.7%,次之,与K71同源性为99.4%,但与其他分离株的核苷酸同源性均不高于71%;另外,其与JL94、K71的氨基酸序列同源性分别为99.5%、99.0%、但与其他分离株的核苷酸同源性均不高于82%。这些发现可为我国猪轮状病毒感染的流行病学调查和免疫预防提供重要理论依据。
本试验构建PRV VP4全长的VP4-pMD18-T重组质粒及VP4-PGEX-6P-1原核表达载体重组质粒,在最适条件下,经IPTG诱导,在大肠杆菌内成功表达VP4全长蛋白,对表达的产物进行分离纯化,体外及动物实验证实,表达产物具有良好的抗原性和免疫原型。制备的多克隆抗体经ELISA、Western blot、IFA实验证实其具有较好生物活性。因此,VP4蛋白表达可为今后研究基因工程苗和诊断方法等提供理想材料。RV不同毒株基因组序列之间存在较大差异,是由于轮状病毒基因之间存在明显“漂移”和“转变”现象,导致其血清型的多型性。当两个不同血清型的毒株感染同一宿主细胞时,基因片段之间相互作用,在转录复制过程中发生交换,交叉或者重排,可引起病毒的血清型变异[19]。由于国际畜产品贸易的发展,导致PRV新的血清型出现几率明显增加。因此,及时检测PRV流行状况,尤其是PRV流行株血清型变化情况,可为预防PRV提供有效技术支撑,对疫苗研究和使用提供理论依据。
[1]EEstes M K.Rotaviruses and their replication[J].J Virol,2001, 1747-1785.
[2]Crawford S E,Mukherjee S K,Estes M K.Trypsin cleavage stabilizes the rotavirus VP4 spike[J].J Virol,2001,75∶6052-6061.
[3]Gorziglia M,Larralde G,Kapikian A Z,et al.Antigenic relationships among human rotaviruses as determined by outer capsid protein VP4[J].Proc Natl Acad Sci USA,1990,87(18)∶7155-7159.
[4]Johansen K,Svensson L,Neutralization of rotavirus and recognition of immunologically important epitopes on VP4 and VP7 by human IgA[J].Arch Virol,1997,142(7)∶1491-1498.
[5]Hoshino Y,Hoshino Y,Kapikian A Z,et al.Classification of rotavirus VP4 and VP7 serotypes[J].Arch Virol Suppl,1996,12∶99-111.
[6]Sereno M M et al,1994)Sereno M M,Gorziglia M I.The outer capsid protein VP4 of murine rotavirus Eb represents a new P type [J].Virol,1994,199∶500-504.
[7]Hesse R A,Couture L P,Ellsworth S R.Production and characterization of VP4/VP7 reassortant swine rotaviruses derived from Gottfried and OSU parental strains[J].Am J Vet Res 1993,54(10)∶ 1623-1629.
[8]Angel J,Tang B,Feng N,et al.Studies of the role for NSP4 in the pathogenesis of homologous murine rotavirus diarrhea[J].Infect Dis,1998,177(2)∶455-458.
[9]Johnson M A,Misra R M,Lardelli M.Synthesis in Escherichia coli of the major glycoprotein of human rotavirus∶Analysis of the antigenic regions[J].Gene,1989,84(1)∶73-81.
[10]党双锁,王宏仓,贾晓黎,等.幽门螺杆菌VacA基因重组表达包涵体复性及ELISA方法建立[J].世界华人消化杂志,2005,13 (20)∶2501.
[11]钱刚,冯力,刘胜旺,等.猪传染性胃肠炎病毒纤突蛋白基因修饰及原核表达研究[J].东北农业大学学报,2005,36(5)∶611-614.
[12]杨巍,李广兴,孟凡丹,等.猪流行性腹泻病毒N基因克隆及原核表达[J].东北农业大学学报,2011,42(6)∶81-85.
[13]洪琴,任晓峰,李广兴.鸡痘DNA疫苗Pvax-env构建及其体内表达[J].东北农业大学学报,2011,42(6)∶105-108.
[14]石娜,李广兴,任晓峰,等.猪IL-15与PRRS病毒GP5基因核酸疫苗免疫效力[J].东北农业大学学报,2010,41(1)∶97-102.
[15]刘丽利,黄永坤,魏群德.轮状病毒感染的研究进展[J].医学综述,2004,10(12)∶759-762.
[16]倪艳秀,林继煌,何孔旺,等.A组轮状病毒研究动态[J].中国兽医学报,1998,14(1)∶60-64.
[17]时洪艳,冯力,陈建飞,等.猪轮装病毒重组VP7蛋白抗原间接ELISA诊断方的建立[J].中国预防兽医学报,2008,30(3)∶233-237.
[18]田小艳,孙华,邓雨修,等.猪轮状病毒分离与鉴定[J].畜牧与兽医,2009,41(10)∶85-87.
[19]Ward R L.Evidence for notural reassortanes of human Potaviruses belong to different genegroups[J].J Virol,1990,64∶3219.
Expression VP4 complete protein and polyclonal antibodies preparation or detection of porcine rotavirus DN30209 strain/
REN Xiaofeng,DOU Xiujing,HAO Yahuan,SUN Liumei,WEI Xiaoning(School of Veterinary Medicine,Northeast Agricultural University,Harbin 150030,China)
To study porcine rotavirus(PRV)VP4 protein levels related experiments,we refered to GenBank PRV JL94,OSU strains sequences,designed a pair of specific primers,the complete length of VP4 gene about 2 330 bp was cloned from the separation strain of DN30209 of our lab.Expanding product was constructed into a recombinant plasmid VP4-pMD18-T successfully.By sequencing,the sequence alignment and analysis,the results showed that the VP4 gene complete length of DN30209 was 2 331 bp,compared with JL94 strains,nucleotide homology was 99.7%,amino acid homology was 99.5%.The VP4 gene was connected with prokaryotic expression vector pGEX-6P-1,constructed andscreened the positive prokaryotic expression vector recombinant plasmid,marked as VP4-pGEX-6P-1. Following,positive recombinant plasmid was transformed into Rosetta competent cell,by IPTG induction,we have got the expression of recombinant proteins in the form of inclusion body,the fusion protein size is about 113 ku,consistent with the expected size.The protein Retrieved and purified,was used as immunogen to the white rabbit,and then,rabbit anti-VP4 protein polyclonal antibody was preparated,and detected biological activity.The results showed that:the titer of polyclonal antibody was approximately 1∶105,moreover,the polyclonal antibody,which has a good antigen-antibody reactivity with PRV,are available for IFA and WB,so,the PRV VP4 polyclonal antibody is an effective experimental material for porcine rotavirus research.
PRV;clone;prokaryotic expression;antibody preparation
S858
A
1005-9369(2014)12-0010-08
时间2014-12-29 8∶58∶54 [URL]http://www.cnki.net/kcms/detail/23.1391.S.20141229.0858.002.html
任晓峰,窦秀静,郝雅环,等.猪轮状病毒DN30209株VP4全长蛋白表达及多抗制备和鉴定[J].东北农业大学学报,2014,45 (12):10-17.
Ren Xiaofeng,Dou Xiujing,Hao Yahuan,et al.Expression VP4 complete protein and polyclonal antibodies preparation or detection of porcine rotavirus DN30209 strain[J].Journal of Northeast Agricultural University,2014,45(12):10-17.(in Chinese with English abstract)
2014-03-11
国家自然科学基金项目(31300758;31340003);“十二五”国家科技支撑项目(2013BAD12B04);哈尔滨科学技术局项目(RC2012XK002003);中国教育部重点项目(212038)
任晓峰(1974-2014),男,教授,博士,博士生导师,研究方向为预防兽医学与分子病毒学。E-mail∶renxf@neau.edu.cn

