菊芋提取液的皮状丝孢酵母发酵产油脂试验研究
汪伦记 纠 敏 吉艳青 尤晓颜
(河南科技大学食品与生物工程学院1, 洛阳 471023)(洛阳市第四职业高中2, 洛阳 471000)
生物柴油(Biodiesel)是指以植物油脂、动物油脂和废餐饮油等为原料,通过酯交换工艺制成的甲酯或乙酯燃料。作为可替代石化柴油的清洁生物燃料,生物柴油的生产成本和使用性能都与现用石化柴油基本相当,且具有良好的环境特性和可生物降解性,具有广阔的发展前景[1-2]。在生物柴油的生产中,原料成本占生产成本的75%以上,是制约生物柴油工业化生产的主要因素。美国主要采用豆油,欧洲采用菜籽油,印度尼西亚和日本分别采用棕榈油和废油生产生物柴油[3]。我国人口众多,耕地资源匮乏,若直接利用菜籽油或豆油等食用油脂生产生物柴油,由于原料和经济原因,不具备经济性。
微生物油脂发酵技术是生物柴油生产的一个研究发展方向。微生物油脂的脂肪酸组成与植物油相近,以C16和C18系脂肪酸为主[4]。微生物发酵产油具有发酵周期短,可连续生产等优点;而且产油微生物菌种资源丰富,能利用和转化各种农林废弃木质纤维素原料,对中国这样一个农业占较大比重的国家具有特殊意义。
目前,对培养产油微生物碳源的研究主要集中在葡萄糖基原料、淀粉质原料和纤维素原料。但采用这3种原料作为生物柴油生产的碳源,原料成本仍然是制约生物柴油产业化的关键因素。因此,一种果糖基新型能源植物——菊芋,正日益受到关注。菊芋是一种多年生的草本植物,其块茎富含菊糖,占其干重的68%~83%。菊糖是由D-呋喃果糖经β-2,1-糖苷键聚合而成的一种果聚糖,呈直链结构,末端含有一个葡萄糖基[5]。与淀粉和纤维素相比,菊糖更易被水解成果糖和葡萄糖[6],而且,菊芋具有适应性强,耐贫瘠,耐寒,耐旱等特点,特别适合在沙漠、滩涂、盐碱荒地等非农业耕地种植,且产量高,价格低廉。基于以上这些优点,菊芋已成为生产燃料乙醇、乳酸、琥珀酸、丁醇等生物质能源、食品和化工原料可供选择的廉价碳源之一[7-11]。目前对以菊芋为原料生产生物柴油报道不多,因此本试验对皮状丝孢酵母发酵菊糖提取液生产油脂进行了研究,为以菊芋为原料制备生物柴油奠定基础。
1 材料与方法
1.1 试验材料
菊芋粉:鲜菊芋块茎购自洛阳,经切片、晒干、粉碎(100 目),4 ℃冷藏备用。蛋白胨、酵母膏、蔗糖、3,5-二硝基水杨酸、酒石酸钾钠、氢氧化钠、琼脂粉、氯仿、甲醇等试剂均为分析纯:国药集团化学试剂有限公司。
1.2 菌种
皮状丝孢酵母(Trichosporoncutaneum):广东省微生物菌种保藏中心。
1.3 菌种培养
1.3.1 培养基
斜面培养基(g/L):新鲜黄豆芽100,蔗糖50,琼脂30。配制后121 ℃灭菌20 min备用。种子培养基(g/L):新鲜黄豆芽100,蔗糖50。配制后121 ℃灭菌20 min备用。
1.3.2 菌种培养
斜面培养:挑取1~2 环皮状丝孢酵母接种于斜面培养基,置入30 ℃恒温培养箱中培养 72 h,培养结束后,斜面放入4 ℃保藏备用。
种子培养:挑取斜面上菌种 2~3 环接种于液体种子培养基中,放入恒温摇床中,30 ℃振荡培养72 h,使其处于对数生长中后期。
1.4 菊糖提取试验
称取定量的菊芋粉溶于蒸馏水中,经一定的温度和时间处理后,4 000 r/min离心10 min除去沉淀,取上清液,测定总糖和还原糖含量,计算菊糖得率。除特别指明外,初始菊芋粉浓度为60 g/L,提取温度为70 ℃,提取时间80 min。
1.5 皮状丝孢酵母菌发酵菊糖提取液产油脂试验
先对制备好的菊糖提取液进行酶解。酶解条件:菊糖外切酶添加量为20 U/g菊糖,55 ℃保温8 h。酶解后酶解液115 ℃灭菌30 min备用。
将培养好的皮状丝孢酵母接入菊糖提取液中,除特别提出外,初始接种量为8%,初始pH值为5.0,初始培养温度为30 ℃,150 r/min,恒温培养72 h。培养结束后,培养液4 000 r/min离心15 min,弃上清,取沉淀进行油脂提取。
1.6 生物量的测定
发酵结束后,取一定量的发酵液于离心管中,4 000 r/min离心15 min,弃上清液,得到湿菌体,将湿菌体于105 ℃干燥箱中烘至恒重,菌体的生物量以g(干菌)/L发酵液表示[12]。
1.7 油脂提取
酸热提取法[13]。出油率根据下面的公式计算。

1.8 菊糖与发酵液中总糖和残糖含量的测定
菊糖含量测定:采用总糖含量减去还原糖含量的方法。
总糖和还原糖测定:DNS比色法。总糖测定以还原糖计,定量待测样品于0.05 mol/L HCl 中,沸水浴中回流水解1 h,用0.05 mol/L NaOH 调成中性[14]。
1.9 菊糖酶酶活测定
菊糖外切酶酶活测定[15]:0.5 mL酶液(若必要,适当稀释)加入到4.5 mL 2%的蔗糖溶液(0.2 mol/L pH 4.6醋酸缓冲液配制),55 ℃反应10 min,沸水灭活,DNS法测还原糖含量。酶活力定义为:以蔗糖为底物,每分钟水解1 μmol蔗糖所需的酶量为一个酶活力单位。
1.10 菊芋粉组分分析
总氮含量:凯氏定氮法(GB/T 5009.5—2003)[16];粗纤维含量:《植物类食品中的粗纤维测定》(GB/T 5009.10—2003)[17];矿物质元素含量:原子吸收光谱法;Mg2+、Fe3+、Mn2+测定:GB/T 5009.90— 2003[18];K+、Na+测定:GB/T 5009.91—2003[19];Ca2+测定:GB/T 5009.92—2003[20];磷的测定:GB/T 5009.87—2003[21];灰分:灼烧法[22]。
水分含量测定:取定量样品放入105 ℃恒温干燥箱中干燥至恒重,干燥前和干燥后质量之差即为水量的质量。
1.11 脂肪酸成分的测定
气相色谱法[12]。
2 结果与分析
2.1 菊芋粉的成分分析
菊芋粉中主要成分为菊糖,占其干重的73.36%,还原糖为3.12%,这两部分总量大于76%,除此之外,还含有一定量的粗纤维、氮素和无机盐成分(表1)。

表1 菊芋粉的组成成分
2.2 菊芋粉中菊糖浸提条件的优化
菊芋是一种碳含量很高的能源植物,可以用作皮状丝孢酵母菌发酵产油脂的原料。但直接采用菊芋做原料进行微生物发酵产油脂,则在离心收获菌体时,粗纤维也一起沉淀下来,给后续的油脂提取带来麻烦。因此,考察了浸提时间、温度和菊芋粉浓度对菊糖提取率的影响。
2.2.1 浸提时间对菊糖提取率的影响
随着浸提时间的延长,菊糖的提取率也逐渐增大,当浸提时间为80 min时,提取率达到了95%以上,但随着浸提时间继续延长,提取率提高不显著(表2)。因此,综合考虑提取率和经济性的因素,选择浸提时间为80 min。

表2 提取时间对菊糖提取率的影响
2.2.2 浸提温度对菊糖提取率的影响
随着温度的升高,菊糖的提取率也逐渐增大,当浸提温度达到85 ℃时,提取率达到了95%以上,随着温度继续升高,提取率提高不显著(表3)。因此,综合考虑提取率和能耗的因素,选择浸提温度为85 ℃。

表3 温度对菊糖提取率的影响
2.2.3 菊芋粉浓度对菊糖提取率的影响
由表4可知,菊芋粉浓度越低,菊糖的提取率越高,但菊芋粉浓度较低时,提取液中可发酵糖含量较低,影响皮状丝孢酵母的生物量和油脂产量;浓度太高时,提取液可发酵糖含量提高,但提取率下降,而且过高的可发酵糖含量也影响皮状丝孢酵母的生物量和油脂产量,因此,选择菊芋粉浓度为70 g/L为最适提取浓度。在此浓度下,菊糖的提取率达95%以上。

表4 菊芋粉浓度对菊糖提取率的影响
2.3 皮状丝孢酵母菌发酵菊糖提取液产油脂的试验
2.3.1 pH对皮状丝孢酵母菌发酵菊糖提取液产油脂的影响
pH值是微生物生长和代谢活动的一项重要的指标,对菌体的生长和油脂的积累的影响非常大。因此,选择pH值4、4.5、5、5.5、6、6.5进行试验,结果见图1。当初始pH值为5.5时,皮状丝孢酵母的生物量、出油率和油脂得率达到最大,分别为14.04 g/L、35.17%和5.11 g/L。
2.3.2 接种量对皮状丝孢酵母菌发酵菊糖提取液产油脂的影响
接种量对菌体油脂的积累也有重要影响。当接种量过少时,培养基中丰富的营养使菌体大量繁殖,从而减少了油脂的积累,使出油率过低;当接种量过多时,培养基中的营养成分将成为菌体生长的限制因素,对微生物群体生长和油脂积累产生不利的影响。因此,选择2%、4%、6%、8%、10%和12%6种接种量进行试验。由图2可知,当接种量为10%时,生物量、出油率和油脂得率达到最大,分别为14.11 g/L、35.19%和5.04 g/L。随着接种量的增加,生物量和出油率呈现下降的趋势。
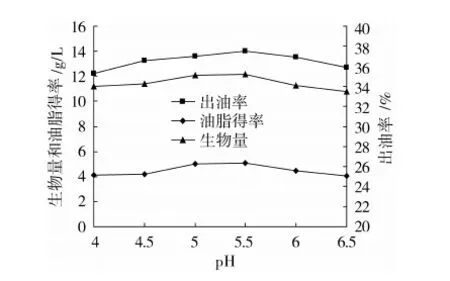
图1 不同初始pH对皮状丝孢酵母发酵菊糖 提取液产油脂的影响

图2 接种量对皮状丝孢酵母发酵菊糖 提取液产油脂的影响
2.3.3 温度对皮状丝孢酵母菌发酵菊糖提取液产油脂的影响
温度对油脂的脂肪酸成分有直接的影响,脂肪酸的相对含量会随发酵温度的高低的变化而发生相应的变化。因此,考察了不同温度对皮状丝孢酵母菌发酵菊糖提取液产油脂的影响,结果见图3。28 ℃时,出油率最高,达35.41%,但当温度为30 ℃时,生物量最高,达14.08 g/L,而且培养温度为30 ℃时,出油率也较高,为35.12%,综合生物量和出油率两方面因素,选择30 ℃作为皮状丝孢酵母菌发酵的最适温度。
2.3.4 氮素对皮状丝孢酵母菌发酵菊糖提取液产油脂的影响
氮素对酵母的生长、繁殖和油脂积累有重要的影响。氮素能加快细胞的生长,促进细胞的增殖。因此,培养前期为获得大量菌体,要求培养基碳氮比低,而培养后期为了积累更多油脂,要求培养基的碳氮比高。
菊芋中的氮素多以蛋白和氨基酸的形式存在,不含无机氮,且总氮质量分数只有5.69%。因此,考察了补加无机氮和有机氮对皮状丝孢酵母菌发酵菊糖提取液产油脂的影响。在产脂培养基中分别添加无机氮源硝酸铵、硝酸钾、NH4Cl、(NH4)2SO4和尿素;有机氮源牛肉膏、蛋白胨作为补充氮源,添加量为2 g/L,进行皮状丝孢酵母菌发酵菊糖提取液产油脂试验。试验结果见图4。

图3 温度对皮状丝孢酵母发酵菊糖提取液产油脂的影响

图4 氮源对皮状丝孢酵母发酵菊糖提取液产油脂的影响
由图4可知,补充添加有机氮源和无机氮源对皮状丝孢酵母生长有一定的促进作用,但生物量增加不显著;补充添加有机氮源能较显著提高生物量,但出油率偏低。究其原因是由于丰富的有机氮源促进细胞的大量增殖,而导致油脂积累少。这表明,菊芋中含有氮素能满足酵母的生长需求,补充添加氮素不能显著提高油脂得率。
2.4 皮状丝孢酵母分批发酵菊糖提取液产油脂放大试验
在前期试验的基础上,对皮状丝孢酵母发酵菊糖提取物产油脂分批放大进行研究。5 L发酵罐装液量为2.7 L,发酵液总糖含量为54 g/L,初始pH值5.5,接种量10%,培养温度30 ℃,定期取样测其总糖含量、生物量和油脂得率,结果见图5。在5 L发酵罐中,皮状丝孢酵母分批发酵菊糖提取液产油脂能达到较高的生物量和油脂得率,72 h,发酵结束后,生物量和油脂得率分别达到13.93 g/L和4.89 g/L,出油率为34.73%。

图5 5L发酵罐皮状丝孢酵母发酵菊糖提取液产油脂
2.5 皮状丝孢酵母的脂肪酸组分分析
皮状丝孢酵母菌油脂脂肪酸组分分析结果见表5。皮状丝孢酵母所产生的脂肪酸主要是C16和C18系列脂肪酸,含6种成分。其中以油酸为主,其次为棕榈酸和亚油酸,棕榈油酸、硬脂酸和亚麻酸含量较低。其中80.2%以上是C16∶0、C18∶1 和C18∶2,尤其是C18∶1(43.0%)。皮状丝孢酵母菌的脂肪酸组分分析结果表明,其油酸、棕榈酸和亚油酸占总脂肪酸组成上和植物油脂非常接近。因此,皮状丝孢酵母发酵菊糖生产的油脂可作制备生物柴油的替代原料。

表5 皮状丝孢酵母脂肪酸组分及含量
3 结论
对菊芋粉的成分分析表明:菊芋中的碳主要以菊糖的形式存在,质量分数高达73.36%,还原糖和粗纤维的含量非常低,只有3.12%和5.55%,除此之外,还含有少量的氮和微量的钾、钠、磷、钙、镁、铁和锰等无机盐。与淀粉质原料相比,菊糖更易于被降解成单糖,因此,菊芋作为果糖基的能源植物,日益受到广泛关注。
菊糖的最优浸提条件为:菊芋粉质量浓度为70 g/L、提取温度为85 ℃、提取时间为80 min。在此优化条件下,菊糖提取率可达95%以上。
皮状丝孢酵母发酵菊糖的最佳培养条件为:初始pH值5.5、接种量10%、培养温度30 ℃。在此优化条件下,5 L发酵罐分批扩大培养,其生物量、出油率和油脂得率分别达到13.93 g/L、34.73%和4.89 g/L。补充添加氮源对生物量、出油率和油脂得率的提高不显著。
采用气相色谱法对皮状丝孢酵母油脂的脂肪酸成分进行分析,结果显示其脂肪酸成分主要是C16和C18系列脂肪酸,其中80.2%以上是C16∶0、C18∶1和C18∶2,尤其是C18∶1(43%),其油酸、棕榈酸和亚油酸占总脂肪酸组成上和植物油脂非常接近。因此,皮状丝孢酵母发酵生产的油脂可作制备生物柴油的替代原料。
[1]吴伟光, 仇焕广, 徐志刚. 生物柴油发展现状、影响与展望[J]. 农业工程学报, 2009, 25(3):298-302
[2]刘祥华, 刘灿明, 高晓, 等. 有机溶剂系统中固定化脂肪酶催化废油脂制备生物柴油[J]. 中国粮油学报, 2009, 24(9):66-70
[3]杨实权. 生物柴油基因工程菌的构建及酿酒酵母产油脂条件研究[D]. 北京:北京化工大学, 2010
[4]陶发琴, 王明鹏, 王卫星, 等. 响应面法优化酵母油脂的提取工艺[J]. 中国粮油学报, 2013, 28(4):51-57
[5]Bacon J S D, Edelman J. The carbohydrates of the Jerusalem artichoke and other compositae [J]. Biochemical Journal,1951, 48(1):114-126
[6]Zherebtsov N A, Shelamova S A, Abramova I N. Biosynthesis of inulinases byBacillusbacteria [J]. Applied Biochemnology and Microbiology, 2002, 38(6):544-548
[7]Onsoy T, Thanonkeo P, Thanonkeo S, et al. Ethanol production from Jerusalem artichoke byZymomonasmobilisin batch fermentation[J]. Kmitl Science and Technology Journal, 2007, 7(S1):55-60
[8]孙丽慧, 王旭东, 戴建英.Klebsiellapneumoniae发酵菊芋生产 2,3-丁二醇的初步研究[J]. 过程工程学报, 2009, 9(1):161-164
[9]Sun L H, Wang X D, Dai J Y, et al. Microbial production of 2,3-butanediol from Jerusalem artichoke tubers byKlebsiellapneumoniae[J]. Applied Microbiology and Biotechnology, 2009, 82(5):847-852
[10]任玮, 董晋军, 郑璞, 等. 酶水解菊芋糖浆发酵生产琥珀酸的初步研究[J]. 工业微生物, 2008, 38(3): 1-5
[11]Ge X Y, Qian H, Zhang W G. Improvement of L-lactic acid production from Jerusalem artichoke tubers by mixed culture ofAspergillusnigerandLactobacillussp[J]. Bioresource Technology, 2009, 100(5):1872-1874
[12]林金涛, 沈宏伟, 张泽会, 等. 圆红冬孢酵母两阶段培养法生产微生物油脂[J]. 生物工程学报, 2010, 26(7): 997-1002
[13]李植峰, 张玲, 沈晓京, 等. 四种真菌油脂提取方法的比较研究[J]. 微生物学通报, 2001, 28(6):72-75
[14]Margaritis A, Bajpai P. Continuous Ethanol production from Jerusalm artichoke Tubers II: Use of immobilized cells ofKluyveromycesmarxianus. Biotechnology and Bioengineering, 1982, 24(7): 1483-1493
[15]Mazutti M, Bender J P, Treichel H, et al. Optimization of inulinase production by solid-state fermentation using sugarcane bagasse as substrate [J]. Enzyme and Microbial Technology, 2006, 39(1): 56-59
[16]GB/T 5009.5—2003,食品中蛋白质的测定[S]
[17]GB/T 5009.10—2003,植物类食品中粗纤维的测定[S]
[18]GB/T 5009.90—2003,食品中镁、铁、锰的测定[S]
[19]GB/T 5009.91—2003,食品中钾、钠的测定[S]
[20]GB/T 5009.91—2003,食品中钙的测定[S]
[21]GB/T 5009.87—2003,食品中磷的测定[S]
[22]GB/T 5009.4—2003,食品中灰分的测定[S]

