甘肃不同地区绵羊TLR9 基因多态性分析
吕伟丽 张小丽 马小军,2 张国华
(1.甘肃农业大学动物医学院,兰州 730070;2.甘肃省草食动物生物技术重点实验室,兰州 730070)
绵羊的呼吸道疾病主要是由羊肺炎支原体、巴氏杆菌、绿脓杆菌及C 群肺炎链球菌等病原微生物引起的呼吸道传染病,主要以咳嗽、气喘及肺炎为特征,羊患病后生长不良,掉膘,病情严重且得不到及时治疗时会引起羊只死亡。绵羊呼吸道疾病在每年冬春发病,发病率和死亡率均较高,严重影响养羊业的发展[1-3]。随着分子遗传技术的发展,探讨疾病控制的分子机制成为可能。免疫分子的Toll样受体家族(Toll-like receptor,TLRs)的多态性或差异与动物对病原的抵抗力和易感性有着显著的相关[4]。TLR 是单个的跨膜非催化性蛋白质,可以识别来源于微生物的具有保守结构的分子[5]。当微生物突破机体的物理屏障,如皮肤、黏膜等时,TLR 可以识别它们并激活机体产生免疫细胞应答[6]。TLR9 是TLRs 中的一员,可能是天然免疫识别微生物机制中对革兰氏阴性菌表达的内毒素-脂多糖应答的受体[5,7]。TLR9 基因与呼吸道疾病抗性相关。本研究对绵羊该基因的遗传多态性进行分析,结合表型观测资料,初步确定易感等位基因和抗性较强的等位基因。研究表明Toll 样受体(TLRs)是识别病原体和激活机体固有免疫的重要组成部分,与增加人对各种疾病的易感性有较大的关系,如艾滋病[3]、麻风病[8],或者是动物如牛的副结核[1,2],猪的沙门氏菌病[9]。脊椎动物的免疫系统中的甲基化的CpG 二核苷酸序列,其主要功能是识别侵入机体的细菌等[5],这种识别PAMP 分子模式的受体称为Toll 样受体9[10]。在小鼠的抗原抗原呈递细胞(APC)中合成含CpG 寡脱氧核苷酸(核苷酸),并模仿细菌的CpG 的核苷酸和诱导生产的细胞因子[10],如B 细胞和树突状细胞(DC)[11]。据报道,绵羊和黄牛TLR 是蜂窝模式的CpG ODN 诱导,与人类有许多相似之处[12]。然而,这之间有种间差异也有种内差异,牛和羊因CpG 寡核苷酸的类型的不同而导致免疫反应不同,但对其原因缺乏深入了解[13]。有研究表明,面对体外环境(空气灰层较多)和体内环境(细菌入侵)的变化,TLR 配体可能会受到Toll 样受体基因单核苷酸多态性的影响,作出适应性反应,从而导致细菌感染或炎症性疾病的易感性的改变[6]。目前在国内外还未见有关中国绵羊TLR9 基因的研究报道。本研究针对中国绵羊群体,收集表型正常和患有呼吸道疾病的个体基因组DNA样品,开展TLR9 基因的遗传多态性分析。利用已有的绵羊呼吸道病表型观测和对应的基因组DNA 样品为基础,采用有效的SNPs 检测方法PCR-SSCP,检测绵羊TLR9 基因的遗传多态性,通过序列测定确定变异类型,根据表型初步判定易感呼吸道疾病的等位基因。
1 材料与方法
1.1 材料
本研究在甘肃省山丹县某规模化养殖场采集107 份表型正常的小尾寒羊血液样品;甘肃省永昌县某规模化羊场采集表型正常小尾寒羊血液样品216 份,患呼吸道疾病的绵羊血液样品36 份;甘肃省陇西县某规模化羊场采集表型正常小尾寒羊血液样品104 份,患呼吸道疾病的绵羊血液样品22 份(表1)。每只羊均颈静脉采血10 mL,柠檬酸葡萄糖(ACD)抗凝,-20℃冻存备用。
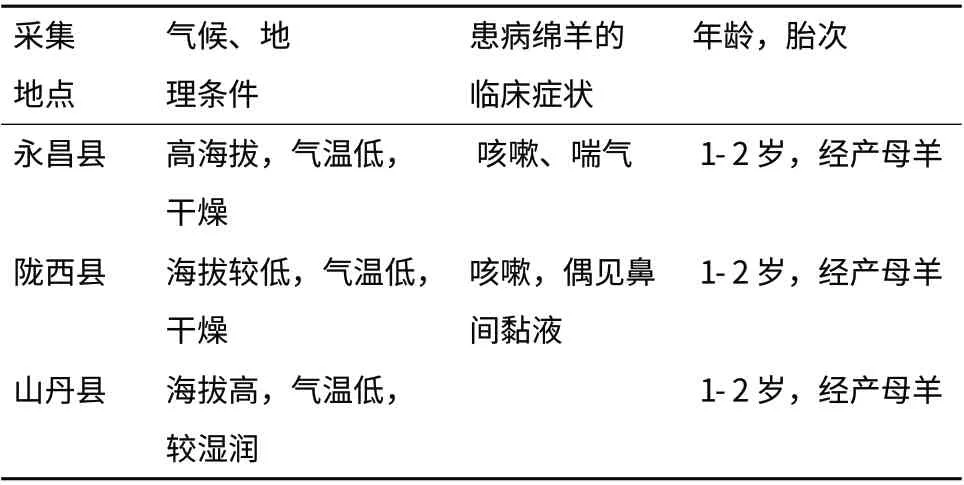
表1 绵羊样品采集记录
1.2 方法
1.2.1 基因组DNA 提取 采用常规的酚/氯仿提取法,从血样中提取DNA 并溶解于TE 缓冲液,在1%琼脂糖凝胶,200 V 电泳检测后,放于-20℃冰箱保存备用。
1.2.2 引物设计及PCR 扩增 采用Primer 5.0 引物设计软件,根据GenBank 发表的绵羊TLR9 基因核苷酸全序列(AY859727)设计其核苷酸序列引物(上游引物:5'-TTCGTGGACCTGTCGGAC-3',下游引物5'-CTGGCTGTTGTAGCTGAG-3'),扩增目的片段约为414 bp,引物由上海生工生物有限公司合成。
PCR 扩增采用20 μL 的体系,各成分用量:上下游引物个0.4 μL,模板DNA 0.8 μL,灭菌ddH2O 6.4 μL,DNA-TAQ 预混酶12 μL。PCR 反应条件:预变性95℃ 1 min;变性95℃ 45 s,退火60℃ 30 s,延伸72℃ 54 s,35 个循环;最后延伸72℃ 10 min。4℃保存,PCR 产物用1%的琼脂糖凝胶电泳检测。
1.2.3 PCR 产物的SSCP 检测 取2.5 μL PCR 产物,7.5 μL 变性剂(98%去离子甲酰胺、0.03%二甲苯青、0.025%溴酚蓝、0.5 mol/L 混合而成),经105℃变性5 min,然后放置于冰上10 min,在12%非变性聚丙烯酰胺凝胶(acr∶bis=37.5∶1),4℃、240 V,电泳24 h,结束后银染法显色。
1.2.4 TLR9 基因测序 SSCP 分析之后,选取不同基因型个体PCR 扩增产物送至上海生工生物基因科技股份有限公司测序。
1.2.5 数据统计分析 用DNAMAN、Dnasp4.0[14]进行核苷酸变异位点、氨基酸变异位点的分析,系统发育树的构建;Megalign[15]、Clustal[7]对所测的绵羊TLR9 基因序列进行同源序列比对分析。
2 结果
2.1 PCR扩增
对采集的绵羊TLR9 基因进行扩增,得到414 bp 的扩增产物,经1%琼脂糖凝胶电泳检测,目的条带清晰且无杂物(图1),可以进行下一步的SSCP分析。
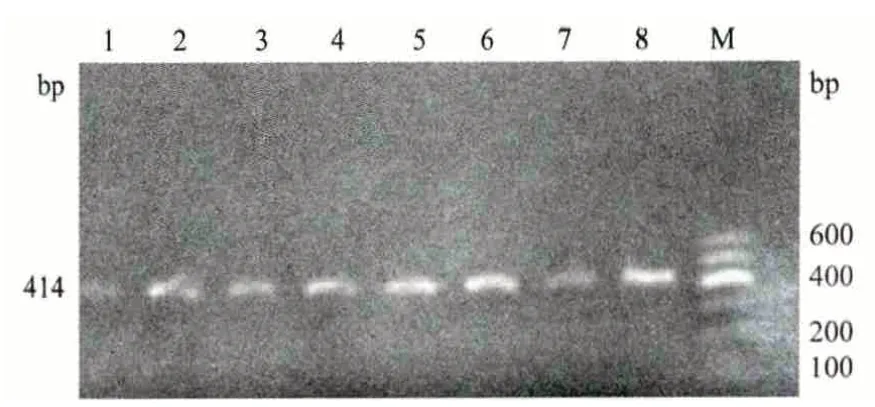
图1 TLR9 基因扩增产物电泳图
2.2 PCR-SSCP检测结果
PCR 扩增产物经SSCP 分析,所检测的485 只绵羊中共发现4 个等位基因,分别指定为TLR9 的*A、*B、*C、*D。各等位基因的电泳带从1 条到5条不等,结果见图2。
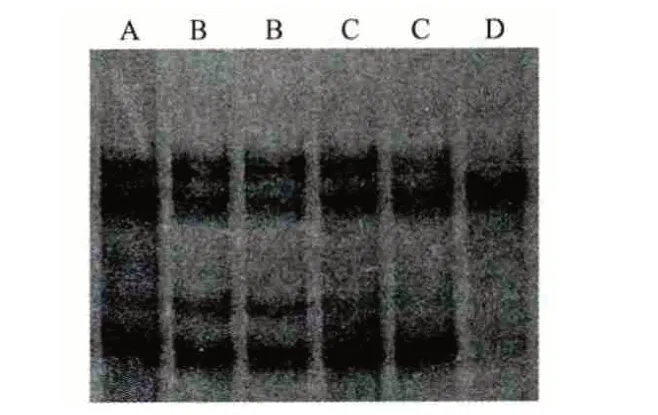
图2 TLR9 基因SSCP 电泳图谱
2.3 绵羊TLR9基因多态位点、等位基因频率与氨基酸差异分析
本研究共确定4 个不同的序列(图3)。在序列分析中,发现了7 个核苷酸多态位点,占分析位点总数的1.69%。其中转换4 个,占核苷酸多态位点的57.14%,包括C/T 转换1 个,G/A 转换2 个,G/T转换一个;颠换3 个,占多态位点总数42.86%。
用绵羊TLR9 部分基因序列推导出氨基酸序列(图4),共有4 个氨基酸位点发生突变,其中单一氨基酸突变位点2 个。B 等位基因的72 bp 处C/T 和A、D 等位基因201 bp 处G/C,G/A 突变,没有引起氨基酸的变化。
2.4 绵羊TLR9基因座位等位基因频率
根据PCR-SSCP 的检测结果,485 只绵羊TLR9基因存在的等位基因频率分布情况(表2)。其中等位基因B 的频率最高,达到51.13%,其次为等位基因 A。在观测的485 只试验绵羊中,表型正常的个体 427 只(健康未患呼吸道疾病),表型异常的58只(患有呼吸道疾病)。进一步分析发现,患呼吸道疾病羊只中等位基因 D 的频率最高(表3)。
2.5 绵羊TLR9基因同源树的构建
为了分析绵羊TLR9 基因的等位基因与其它相应等位基因间的遗传关系,利用DNAMAN 软件对TLR9 基因的序列进行同源树的构建(图5)。所用序列包括本研究获得的4 个单倍型序列,从GenBank下载以下序列参与系统发育树的构建:EF656460,JN377802,HQ717158,HQ717159,HQ717160,JN377803,HQ434578,EF656459,EF656458,NM001011555,AM231305,AM981307,GU451250,AY859727。图5 显示,绵羊TLR9 基因在国内外各个品种之间的同源性非常高,遗传关系很近。
3 讨论
3.1 绵羊TLR9基因多态性
研究表明,由于产生多态性的机制主要是基因突变和转换,所以TLR9 基因多态性可能就是在长期的进化过程中等位基因的积累、融合与分化形成的。适应是形成TLR9 多态性的动因[6],其多态性表现出明显的适应意义,如抗病力增强,对环境的适应性增强等,这样就会出现有利的选择,群体中的基因频率就会发生改变,有利的基因在群体中逐渐的积累;不利的基因会逐渐的消失。免疫系统的功能是决定家畜适应外界环境能力的因素[16],由于家畜所处的环境(地理环境和气候环境)的差别较大,为了更好适应所处的环境,机体的免疫系统会表现出丰富的多态性[17],编码TLR9 最主要功能区的基因也会表现出丰富的多态性。本研究在绵羊TLR9 基因中发现等位基因4 个,多态位点7 个,占序列总长度的1.67%,具有高度的多态性,这与绵羊所处的环境(甘肃省气候干燥,空气中灰尘中)所具有的适应性强,抗病性强的特点一致。
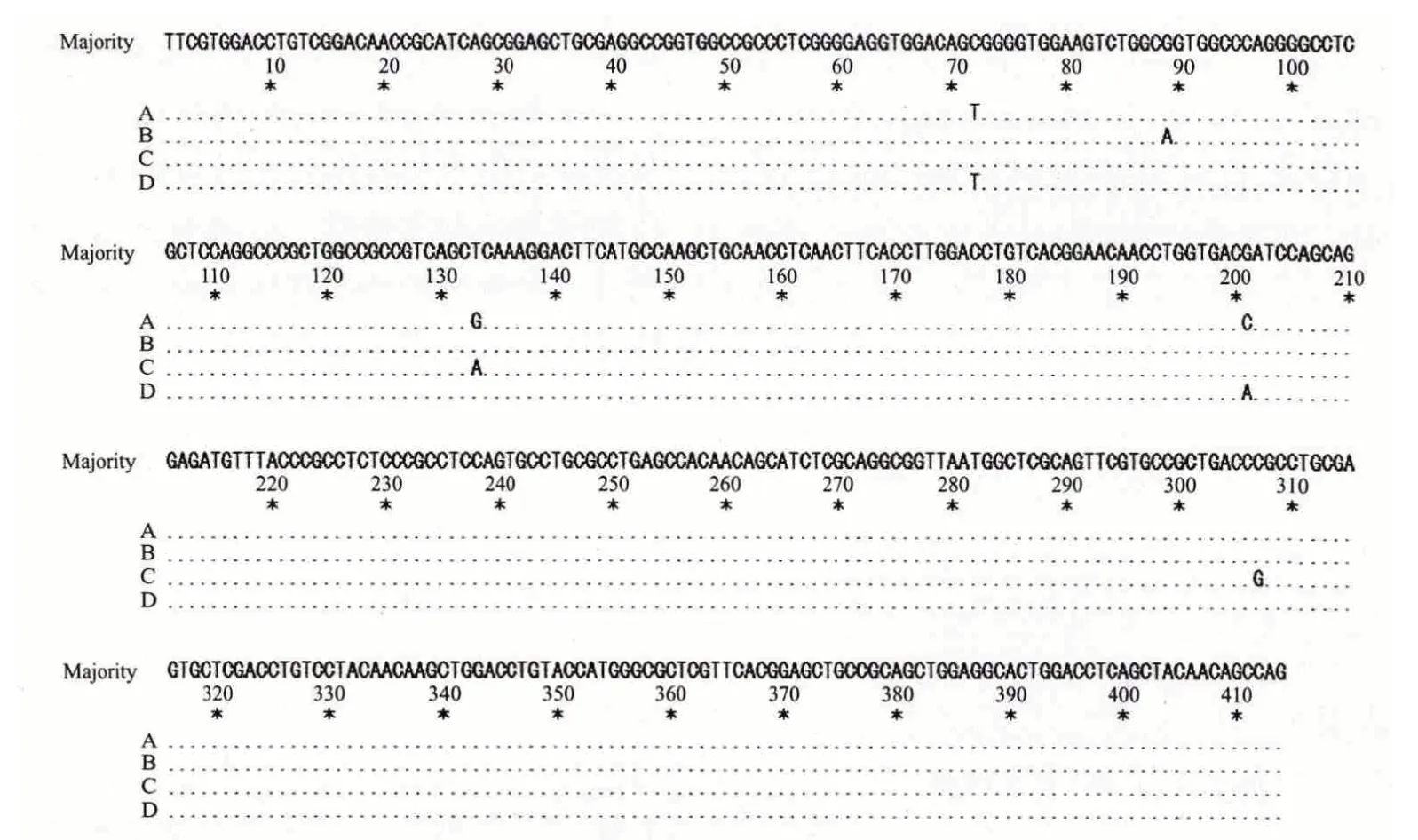
图3 TLR9 等位基因核苷酸序列比对结果

图4 TLR9 等位基因氨基酸序列对比结果

表2 绵羊TLR9 等位基因频率
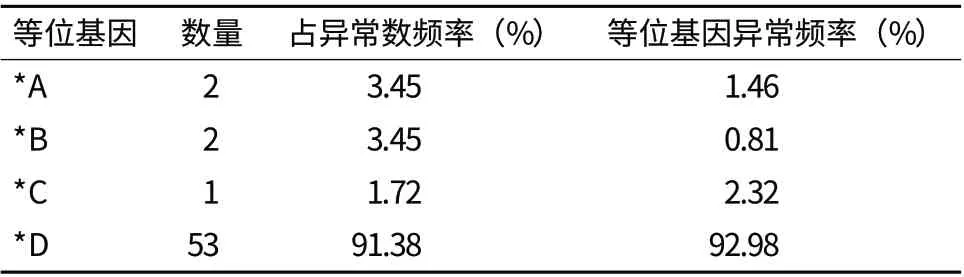
表3 患呼吸道绵羊TLR9 等位基因频率

图5 TLR9 基因核苷酸序列的同源树
动物TLRs 与疾病的易感性和抗性有关[6]。TLR9 基因多态性和遗传性的功能是防止机体受到疾病的感染。免疫学研究揭示,可以采用免疫遗传标记开展选种工作,以提高畜禽的抗病力[18,19]。在动物的抗病育种中,许多研究表明TLRs 基因可能是一组重要的候选基因,能用于抗病分子的育种实践之中。本研究选择患呼吸道病的绵羊中,D 等位基因的频率最高;未患呼吸道疾病(表型正常)的绵羊中,A、B 等位基因的频率最高,可以初步推断A、B 等位基因具有较强的抗呼吸道疾病的遗传潜力。
3.2 TLR9基因聚类分析
TLR9 基因的同源树图表明,在绵羊的进化过程中,TLR9 基因最早可能来源于它们分歧之前的共同祖先原始序列,这可能是它们对相同病原微生物发生特定免疫反应的有效证据,具有相似性。
4 结论
研究获得4 个TLR9 基因的等位基因,在该区域中发现了7 个SNPs,主要是由点突变形成的,说明绵羊TLR9 基因具有较丰富的多态性。
发现患有呼吸道病个体中等位基因D 的频率最高,在4 个等位基因中都有出现。TLR9 基因多态性与绵羊呼吸道疾病有一定的相关性。
[1] 郭晗, 储岳峰, 赵萍, 等. 青海省绵羊肺炎支原体的血清学调查[J]. 安徽农业科学, 2009, 37(33):16391-16409.
[2] 何存利, 鲍嘉铭, 郑丽侠. 绵羊肺炎霉形体病原分离及血清学调查[J]. 宁夏农林科技, 2005, 3:12-13.
[3] 邓光明, 赵煊, 梁桂香, 等. 类山羊传染性胸膜肺炎诊断和防治的研究—病原诊断[J]. 中国兽医科技, 1991(6):5-8.
[4] Trinchieri G, Sher A. Cooperation of Toll-like receptor signals in innate immune defense[J]. Nat Rev Immunol, 2007, 7(3):179-190.
[5] Krieg AM, CpG motifs in bacterial DNA and their immuneeffects[J]. Annu Rev Immunol, 2002, 20:709-760.
[6] Schroder NW, Schumann, R. Single nucleotide polymorphisms of Toll-like receptors and susceptibility to infectious disease[J]. Lancet Infect Dis, 2005, 5:156-164.
[7] Lazarus R, Vercelli D, Palmer LJ, et al. Single nucleotide polymorphisms in innate immunity genes:abundant variation and potential role in complex human clisease[J]. 1mmunol Rev, 2002, 190(1):9-25.
[8] 方畴鑫, 李志杰, 邓光明. 甘肃陇东地区羊肺炎病的流行病学调查[J]. 中国兽医杂志, 1998, 24(3):1-19.
[9] 屈勇刚, 刻根强, 陈宏伟, 等. 绵羊肺炎支原体PCR 检测方法的建立[J]. 石河子大学学报, 2005, 23(6):687-688.
[10] Takeuchi HH, Kawai O, Kaisho T, et al. A Toll-like receptor recognizes bacterial DNA[J]. Nature, 2000, 408:740-745.
[11] Hornung V, Rothenfusser S, Britsch S, et al. Quantitative expressionof toll-like receptor 1-10 mRNA in cellular subsets of humanperipheral blood mononuclear cells and sensitivity to CpG oligodeoxynucleotides[J]. J Immunol, 2002, 168:4531-4537.
[12] Griebel PJ, Brownlie R, Manuja A, et al. Bovine toll-like receptor 9:a comparative analysis of molecular structure, function and expression[J]. Vet Immunol Immunopathol, 2005, 108:11-16.
[13] Mena A, Nichani AK, Popowych Y, et al. Bovineand ovine blood mononuclear leukocytes differ markedly in innate immune responses induced by Class A and Class B CpG-oligodeoxynucleotide[J]. Oligonucleotides, 2003, 13:245-259.
[14] Rozas J, Sánchez-DelBarrio JC, Messeguer X, Rozas R. DnaSP, DNA polymorphism analyses by the coalescent and other methods[J]. Bioinformatics, 2003, 19:2496-2497.
[15] Thompson JD, Gibson TJ, Plewniak F, et al. The CLUSTAL_X windows interface:flexible strategies for multiple sequence alignment aided by quality analysis tools[J]. Nucleic Acids Research, 1997, 25:4876-4882.
[16] 刘云芳, 剡根强, 王新峰. 多浪羊MHC-DRB3 基因座的PCRRFLP 多态性分析[J].遗传, 2004, 26(1):59-62.
[17] 成述儒, 罗玉柱, 等. 藏绵羊DQA1 基因多态性分析[J]. 中国农业科学, 2011, 44(10):2146-2153.
[18] Konnai S, Takeshima SN, Tajima S, et al. The influence of ovine MHC class II DRB1 alleles onimmune response in bovine leukemia virus infection[J]. Microbiol Immunol, 2003, 47(3):223-232.
[19] 晏光荣, 马海明. 分子标记在动物抗病育种中的研究进展[J]. 国外畜牧科技, 2001, 28(6):32-34.

