大肠杆菌外源蛋白表达载体稳定性的研究进展
江伟华 刘益丽 江明锋
(青藏高原研究院 动物遗传育种国家民委-教育部重点实验室,成都 610041)
质粒稳定性是影响基因工程菌外源蛋白表达的重要因素,同时外源蛋白的表达又影响质粒的稳定性。随着DNA 重组技术的发展,该技术在科研工作和应用生产中占据着越来越重要的位置。目前,关于质粒稳定性及其改良的论述仍比较少见,且不够全面。自20 世纪70 年代以来,大肠杆菌一直是基因工程中应用最为广泛的表达系统。大肠杆菌遗传背景清楚,转化和转导效率高,成本低廉,生长繁殖快,结构简单,培养操作简便,可以大规模地快速生产目的蛋白,加之其表达外源基因产物的水平远高于其他基因表达系统,表达的目的蛋白量甚至能超过细菌总蛋白量的30%,因而大肠杆菌是目前应用最广泛的蛋白质表达系统。
在大肠杆菌中,通常应用质粒载体进行外源基因表达,质粒稳定性对于质粒基因产物的高表达水平是必需的。在实际应用中,重组质粒在大肠杆菌中的不稳定性,成为限制外源蛋白在大肠杆菌中高效表达的瓶颈之一。包含外源基因的质粒载体导入大肠杆菌中常常会带来一系列的生理负担,影响质粒的稳定性。重组表达质粒的不稳定性主要包括结构不稳定性、分配不稳定性以及异构体不稳定性3种情况。通常,质粒的不稳定性或者是由质粒自身变化造成的结构不稳定性引起,或者是由分配不稳定性引起。研究表明,质粒的不稳定性由许多因素决定,如质粒的装载、质粒的拷贝数、复制模式、底物类型、培养基组分、宿主背景、培养条件和培养温度等(表1)。
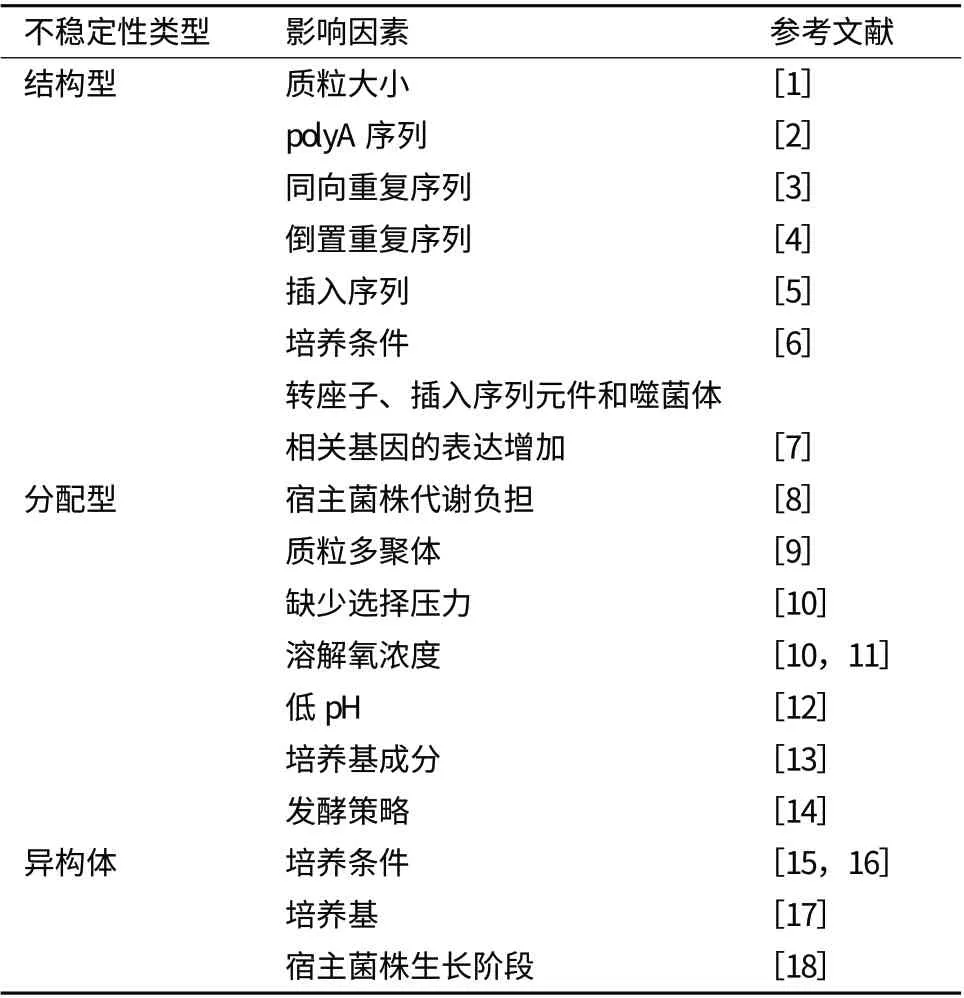
表1 质粒稳定性的影响因素
1 结构不稳定性
1.1 大肠杆菌质粒不稳定性的产生
质粒的不稳定性主要指的是其结构不稳定性,而结构不稳定性通常被看作是质粒本身非常规重组的结果。其机制可分为两类:模板选择的差错、断裂重接中的差错。质粒的不稳定性一般来源于其自身变化所造成的结构不稳定性,如质粒DNA 的点突变、缺失突变、插入突变或重排。
质粒的结构不稳定性通常发生在重组大肠杆菌的发酵过程中,这种由质粒结构变化引起结构不稳定性发生的频率很低。因此,在生产中通常不考虑这种类型的不稳定性。另外,具有重复基序的质粒DNA 分子很容易产生结构不稳定性,这可能由缺失、插入[19]、重复、倒位和易位[20]等突变引起。还有一些因素也对其结构不稳定性有影响,如(1)质粒大小、polyA 序列、同向重复序列[3]、倒置重复序列和插入序列等也会影响质粒的结构稳定性。(2)环境压力等相关因素,如抗生素浓度、培养基组分、温度变化和氧含量的波动也会增加发生点突变的概率,或者促进整合基因间的或重复序列间[4]的重组。(3)由于大肠杆菌是可移动的、重组的DNA,如转座子、插入序列元件和噬菌体相关基因的表达增加,也会引起质粒DNA 的结构不稳定性,增加携带质粒细胞的代谢负担(即在大肠杆菌中表达重组质粒DNA 时由质粒的维持和复制以及培养条件造成的一些生物限制)。在这种情况下,质粒的结构不稳定性,可看作是因携带质粒的细胞中可移动的DNA 序列引起的突变,以及其他的遗传变异体造成的结果。
1.2 大肠杆菌质粒不稳定性的消除
目前,消除质粒在重组宿主内的结构不稳定性的方法主要有如下两种:(1)从宿主基因组中除去大肠杆菌重组的、可移动的DNA 序列及其隐藏的毒力基因;(2)染色体整合法。2012 年,Sabido等[21]将来自源于豆根瘤菌的编码酪氨酸合酶的melA 基因连接到新型表达载体pLoxGentrc 上,构建成重组载体pLoxGentrcmelA(图1),然后转化入E. coli W3110 菌株中,成功构建产黑色素的W3110/pLoxGentrcmelA 菌株,随后以包含与lacZ 基因有45 b 同源的片段为引物,PCR 扩增质粒pLoxGentrcmelA上包含PtrcmelA、T1 和T2 rrnB 末端序列及aacC1基因的区域,将扩增产物用电穿孔法导入产λ-Red酶的E. coli W3110 菌株中,构建成melA 基因插入到lacZ 基因座的W3110PtrcmelA 菌株。和W3110/pLoxGentrcmelA 菌株相比,W3110PtrcmelA 菌株具有更高的遗传稳定性和黑色素表达量,其所使用的表达载体pLoxGentrc 具有更高的生长力,并且在无选择压力的情况下遗传稳定性更高,因而在外源蛋白表达菌株的构建中将会是一种比较理想的载体。
2 分配不稳定性
2.1 分配不稳定性的产生
分配不稳定性是指整个质粒从细胞中丢失。在细胞分裂过程中,如果子细胞中的质粒随机分配,质粒拷贝数就会发生波动,从而导致分配不稳定性。
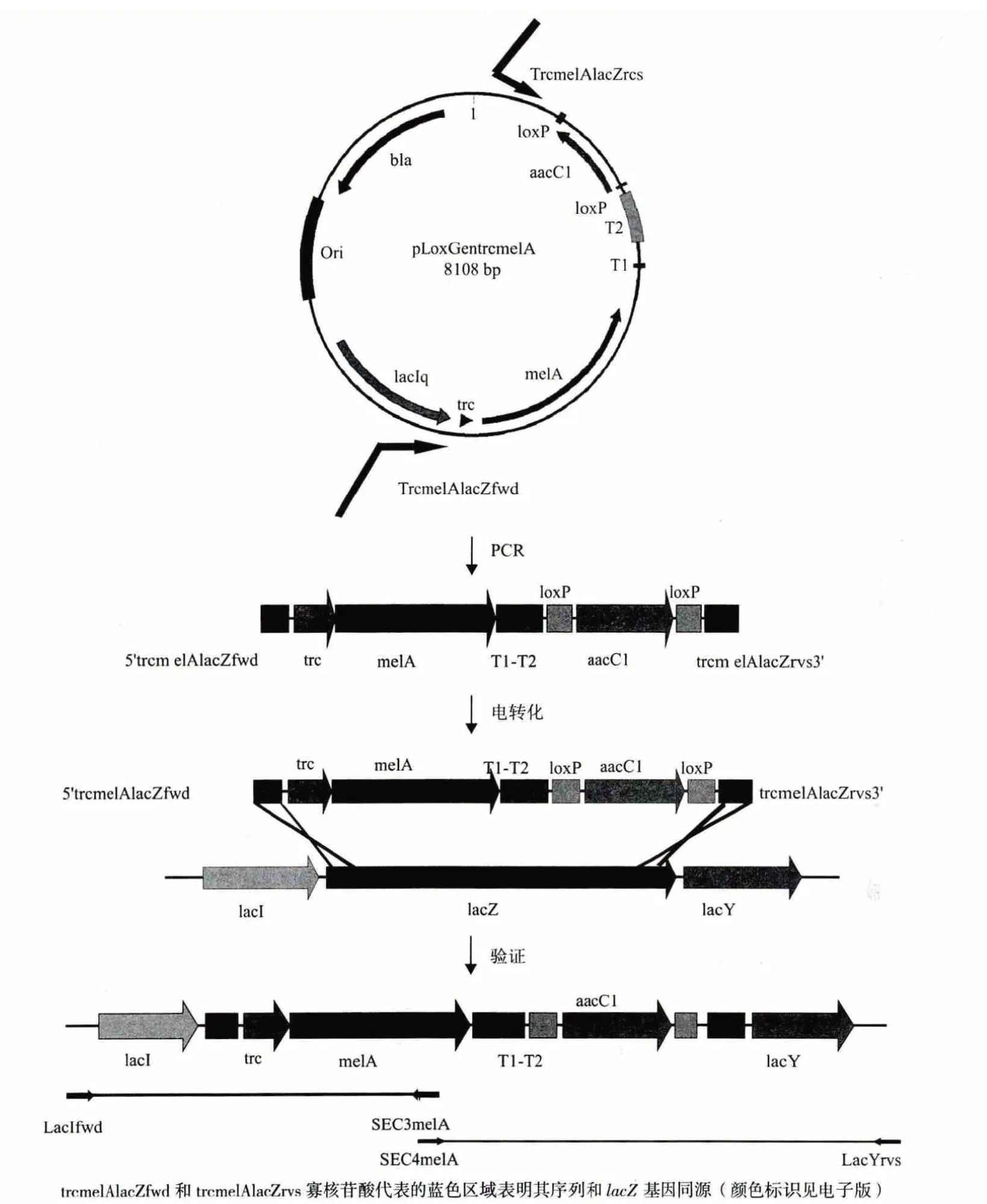
图1 pLoxGentrcmelA 质粒图谱和将melA 基因整合入E.coli 染色体lacZ 基因座的策略
产生分配不稳定性的因素主要包括以下几个方面:(1)在发酵过程中,质粒分配不稳定性和基因工程菌的代谢负担相关。首先,在原核细胞中,转录和复制是两个竞争的过程。这意味着,转录的增加会阻断细胞分裂时的质粒分离,并超出了质粒DNA 的修复能力。其次,由于需要维持质粒并进行复制,宿主细胞会承担额外的负担,与不携带质粒的细胞相比,其生长缓慢,这也是导致质粒分配不稳定性的原因之一。(2)一个熟知的引起质粒不稳定性的原因是质粒多聚体的积累,这会导致可分离的质粒数目减少,使质粒丢失的可能性增加。虽然同源重组不会经常引起多聚体出现,但是它们会因过度复制而迅速积累,而且也会使那些仅含多聚体的细胞经常变成无质粒细胞。(3)质粒DNA 的稳定性也受培养条件,如溶解氧浓度和pH 值的影响。在生长培养基中,由于维持质粒的稳定需要足够的溶解氧,溶解氧浓度水平的降低(低于阈值),会给质粒修复带来不利的影响[10,11]。此外,低pH 培养基会对细菌细胞造成压力,导致高密度培养中质粒的丢失。培养基的组成也可能会影响质粒的分配型稳定性;但是,有研究显示,复合氮源如酵母提取物和胰蛋白胨的联合使用不会降低质粒的稳定性[6]。有研究表明,这些复合氮源的使用能够提高质粒的稳定性。由此可见,质粒DNA 生产的发酵策略[8]对质粒的稳定性有至关重要的作用。(4)其他的因素,如抗生素抗性基因和质粒拷贝数,也会影响质粒的分配型稳定性。在质粒含有抗生素抗性基因同时存在选择性压力的情况下,具有卡那霉素抗性的质粒比具有氨苄青霉素抗性质粒的菌株更稳定。部分研究者认为,利用高拷贝质粒会导致宿主菌株的代谢负担增加,因细胞产量降低而导致质粒DNA 的产量降低。
2.2 分配不稳定性的消除
质粒不稳定性在长期操作中,尤其是连续培养时存在较严重的问题。针对质粒的不稳定性问题,解决的方法有抗生素选择法,稀释速率的动态循环法,两阶段连续培养法及λ 噬菌体的使用等。其中,人们希望λ 噬菌体系统能够提供一种在溶原状态下高度稳定的克隆基因,而在溶原化状态下该克隆基因产物能高效表达。2012 年,Jeong 等[23]基于Q—突变体构建了3 种不同组合的λ 噬菌体载体λSNU1,λSNU2 和λSNU3,比较结果显示,λSNU1 具有更高的蛋白表达量和遗传稳定性,在三者中为最好,这种噬菌突变体λSNU1 可用来提供一种高稳定性和高生产力的克隆载体,尤其适用于长期持续的基因工程操作过程。
为了改善重组质粒的稳定性,已有研究者在探索一些相应的策略[10,24-28]。选择性压力的存在及其类型,对保持或提高质粒分配型稳定性有重要的作用[29,30]。但是,由于抗生素抗性蛋白的生产导致的压力,以及抗生素在生长培养基内降解,通过增加生长培养基的选择压力,并不能改善质粒的分配型稳定性[10]。其他研究也证实,生长在选择性环境下并没有像预期那样增加质粒的稳定性。然而,也有研究表明,经诱导后,带质粒细胞在选择压力下比在非选择性压力下能维持更高的稳定性。由于研究结果不一致,以及在特定情况下抗生素使用受到限制,目前,研究者已通过使用营养缺陷型的菌株,开发出了具有类似的或者更高的质粒稳定性的非抗生素系统[24],如阻遏滴定系统,必需生长基因表达的变换系统[25],以及使用其他杀菌剂进行选择的系统[26]。2008 年,Philip 等[27]构建的pPSY 克隆载体来源于IncW 质粒R388,能够为稳定克隆表型提供一种快速简易的方法,插入的外源基因能够保持稳定而无需抗生素选择,可用于在大肠杆菌中稳定表达外源基因。2008 年,张刚等[31]将质粒平均分配基因parDE 引入重组质粒pDK7-fdh(携带甲酸脱氢酶基因fdh)中,得到基因重组菌F6,最后结果表明,引入parD 基因的基因重组菌质粒稳定性和甲酸脱氢酶活性均高于未引入parDE 基因的基因重组菌。2012 年,Nikel 等[28]构建了一套用于将外源基因转化入革兰氏阴性菌染色体中的载体,并在大肠杆菌内重建糖转运和磷酸化的表达系统,这两种表达系统由植入基因携带的信息在没有任何选择压力的情况下能稳定遗传。此外,为了降低高拷贝质粒所带来的代谢负担,可以在重组DNA 技术中替换使用低拷贝质粒。与高拷贝的质粒相比,在大肠杆菌中,这些低拷贝质粒更加稳定[32],如pMB1 来源的质粒,但可能会由于质粒DNA 的量较低,而导致其产量也较低。
3 异构不稳定性
3.1 异构不稳定性的产生
在大肠杆菌中产生的质粒DNA 存在线性、开环和超螺旋几种异构体,因此,异构稳定性也是一个相关的特征,在应用质粒DNA 的生产过程中也要加以考虑。
超螺旋(supercoiled,SC)型质粒,即特定的共价闭合环状(Covalently closed circular,CCC)质粒,与开环(Open circular,OC)或线性(Linear,L)质粒相比,能够在体外和体内产生更高水平的基因表达[33,34],因而质粒的拓扑结构显得尤为重要。此外,将线性的亚型质粒整合入宿主基因组中存在一个更大的风险,即会产生有害的影响。因此,在应用于基因治疗的质粒生物药剂学研究中,使用主要含有超螺旋型的质粒DNA 是非常可取的。
在大肠杆菌中,超螺旋化的程度由DNA 拓扑异构酶和DNA 旋转酶控制。已知,DNA 通过其超螺旋的改变,以应对pH 值、渗透压、营养供应和饥饿以及缺氧等不同的环境条件。而且,在整个大肠杆菌发酵过程中,质粒DNA 拓扑结构都在发生变化,在对数生长期的大多数时间内(多达10 h),超螺旋异构体的百分比保持恒定[18],进入平稳期后,为应对细菌对DNA 超螺旋的控制,质粒超螺旋亚型的百分比减小。此外,在发酵过程结束时得到的质粒超螺旋DNA 的百分比,受生长培养基和细菌菌株[35]不同的影响。
3.2 异构体稳定性的影响因素
研究表明,质粒的异构体稳定性由许多因素决定,如质粒负载、质粒的拷贝数、复制模式、底物类型、培养基组分、宿主背景、培养条件和培养温度等。含有外源基因的质粒载体转化到大肠杆菌,总是会带来一系列的生理负担,影响到质粒的稳定。当在大肠杆菌中表达制备的质粒DNA 时,由质粒的维持和复制以及培养条件造成的一些生物限制,负责限制最终的生物量和产物产量。这被称为“代谢负担”,它也可能对质粒的稳定性和质量造成不利影响,因为细胞的机制不再能够维持活跃的质粒合成代谢,并且由质粒维持引起的应激反应也会增加质粒的不稳定性。从某种意义来说,质粒的不稳定性正是宿主细胞为克服或者消除这种代谢负担而进行的自我保护。
3.3 影响异构体稳定性的“代谢负担”的消除
在应用大肠杆菌表达异源蛋白的过程中,质粒的稳定性是影响发酵产量的重要因素,丢失质粒空细胞的出现会使目标蛋白产量下降。一般情况下,质粒增加了细胞的代谢负担,与含质粒的细胞相比,丢失质粒的空细胞通常具有较高的生长速率,若空细胞出现在发酵初期,将会成为优势群体。外源基因诱导表达后,由于代谢负担的增加,质粒稳定性迅速降低。诱导型大肠杆菌表达系统的特点是,诱导后菌体进入生产阶段,此时质粒稳定性已不再是影响生产的主要问题。由此可推断,在使用大肠杆菌进行诱导表达时,只要在发酵初期保持细胞不丢失质粒,使其稳定进入成长期,就可以避免所表达蛋白产量的下降。2012 年,Martí 等[36]提出了一种葡萄糖和IPTG 双重限制策略,用于大肠杆菌的补料分批培养,以避免在诱导期发生新陈代谢失调。在保持葡萄糖生长限制的同时,降低IPTG 的浓度,乙酸的积累降低。IPTG 的浓度为0.03 mmol/g DCW 时,在诱导期没有检测到乙酸的积累,而在对照位置通常能检测到。虽然采用这种双重限制策略会使蛋白表达率略有下降,但是,由于诱导期的延长,达到了更高水平的蛋白质产量,从而提高了生物过程的单容积生产力。这个策略的另一个优点是,由于使用的IPTG 更少,降低了培养基成本,同时也避免了乙酸积累对宿主细胞造成的代谢负担。
与诱导型表达系统相比,在组成型表达系统中,由于外源蛋白的持续表达,导致细胞代谢负担加重,质粒稳定性的控制更加困难。通过优化发酵策略,如升高或降低培养温度、增大碳氮比可降低质粒稳定性;基本培养基可提高质粒稳定性;不同的补料方式也影响到质粒的稳定性。2008 年,苟斌全等[22]通过对不同碳源、残糖浓度的分析,优化了组成型大肠杆菌DH5α/pKKFPGA 补料发酵策略,增强了质粒稳定性,极大地提高了粪产碱杆菌青霉素酰化酶(AfPGA)的酶活单位。
4 小结
获得高效表达外源基因的基因工程菌或细胞是基因工程的最终目的。经过全面检测的基因工程菌或细胞是实现重组基因工程产品生产的前提和基础,使基因工程菌能够保持相同的遗传和生物学特征,在特定的培养环境和条件下持续稳定表达携带的外源目的基因。检定重组菌株遗传稳定性是为了确认经过初步筛选的菌株符合预期设计要求,携带有稳定的目的基因,能够持续表达有功能活性的目的产物,满足科研和生产的持续需求。重组菌的稳定性受遗传及环境因素的影响,其中重组质粒的稳定性是重组菌株传代稳定性的基础,对于生产及科研具有重要意义。
影响质粒稳定性的因素是多方面的,各因素之间有很大的相关性,只改进其中一个方面往往不能取得明显的效果,有时还存在一定的机遇性。但是,认识各因素的产生和作用机理,可以为提出改进方法提供理论依据。质粒的稳定性与质粒的存在及其活动给宿主细胞带来的生理负担是限制重组基因工程产品生产效果的主要矛盾,可以根据不同的科研和生产目的,在改良质粒稳定性和提高重组基因表达产物产量之间做出相应取舍,从而有针对性地构建和改良外源基因表达系统,优化基因工程菌的发酵策略,以实现最佳的科研和生产效益。
[1] Ertl PF, Thomsen LL. Technical issues in construction of nucleic acid vaccines[J]. Methods, 2003, 31:199-206.
[2] Ribeiro SC, Monteiro GA, Prazeres DM. The impact of polyadenylation signals on plasmid nuclease-resistance and transgene expression[J]. J Gene Med, 2007, 9:392-402.
[3] Hadj Kacem B, Gargouri J, Gargouri A. In vitro direct repeatsmediated deletion during PCR amplification[J]. Mol Biotechnol, 2008, 40:39-45.
[4] Bi X, Liu LF. DNA rearrangement mediated by inverted repeats[J]. Proc Natl Acad Sci USA, 1996, 93:819-823.
[5] Valesova R, Stepanek V, Vecerek B, Kyslik P. IS2-mediated rearrangement of the promoter sequence suppresses metabolic burden of the recombinant plasmid[J]. Folia Microbiol(Praha), 2005, 50:275-282.
[6] Oliveira PH, Prazeres DM, Monteiro GA. Deletion formation mutations in plasmid expression vectors are unfavored by runaway amplification conditions and differentially selected under kanamycin stress[J]. J Biotechnol, 2009, 143:231-238.
[7] Haddadin FT, Harcum SW. Transcriptome profiles for high-celldensity recombinant and wild-type Escherichia coli[J]. Biotechnol Bioeng, 2005, 90:127-153.
[8] Xu J, Li W, Wu J, et al. Stability of plasmid and expression of a recombinant gonadotropin-releasing hormone(GnRH)vaccine in Escherichia coli[J]. Appl Microbiol Biotechnol, 2006, 73:780-788.
[9] Summers DK, Sherratt DJ. Multimerization of high copy number plasmids causes instability:CoIE1 encodes a determinant essential for plasmid monomerization and stability[J]. Cell, 1984, 36:1097-1103.
[10] Goyal D, Sahni G, Sahoo DK. Enhanced production of recombinant streptokinase in Escherichia coli using fed-batch culture[J]. Bioresour Technol, 2009, 100:4468-4541.
[11] Krishna Rao DV, Ramu CT, Rao JV, et al. Impact of dissolved oxygen concentration on some key parameters and production of rhG-CSF in batch fermentation[J]. J Ind Microbiol Biotechnol, 2008, 35:991-1000.
[12] Chen HC, Hwang CF, Mou DG. High-density Escherichia coli cultivation process for hyperexpression of recombinant porcine growth hormone[J]. Enzyme Microb Technol, 1992, 14:321-326.
[13] O'Kennedy RD, Patching JW. Effects of medium composition and nutrient limitation on loss of the recombinant plasmid pLG669-z and beta-galactosidase expression by Saccharomyces cerevisiae[J]. J Ind Microbiol Biotechnol, 1997, 18:319-325.
[14] O'Kennedy RD, Ward JM, Keshavarz-Moore E. Effects of fermentation strategy on the characteristics of plasmid DNA production[J]. Biotechnol Appl Biochem, 2003, 37:83-90.
[15] Adamcik J, Viglasky V, Valle F, et al. Effect of bacteria growth temperature on the distribution of supercoiled DNA and its thermal stability[J]. Electrophoresis, 2002, 23:3300-3309.
[16] Higgins CF, Dorman CJ, Stirling DA, et al. A physiological role for DNA supercoiling in the osmotic regulation of gene expression in S. typhimurium and E. coli[J]. Cell, 1988, 52:569-584.
[17] O'Kennedy RD, Baldwin C, Keshavarz-Moore E. Effects of growth medium selection on plasmid DNA production and initial processing steps[J]. J Biotechnol, 2000, 76:175-183.
[18] Freitas SS, Azzoni AR, Santos JA, et al. On the stability of plasmid DNA vectors during cell culture and purification[J]. Mol Biotechnol, 2007, 36:151-158.
[19] Pristas P, Ivan J, Javorsky P. Structural instability of small rolling circle replication plasmids from Selenomonas ruminantium[J]. Plasmid, 2010, 64:74-81.
[20] Oliveira PH, Prather KJ, Prazeres DM, Monteiro GA. Structural instability of plasmid biopharmaceuticals :challenges and implications[J]. Trends Biotechnol, 2009, 27:503-513.
[21] Sabido A, Martínez LM, de Anda R, et al. A novel plasmid vector designed for chromosomal gene integration and expression:Use for developing a genetically stable Escherichia coli melanin production strain [J]. Plasmid, 2012, 69:16-23.
[22] 苟斌全, 张嗣良, 储炬, 等. 增强组成型重组大肠杆菌质粒稳定性的发酵策略[J]. 化学与生物工程, 2008, 25(10):23-26.
[23] Jeong SO, Shin SC, Jong-Kee Y, et al. Construction of various bacteriophage λ mutants for stable and efficient production of recombinant protein in Escherichia coli[J]. Process Biochemistry, 2007, 42 :486-490.
[24] Vidal L, Pinsach J, Striedner G, et al. Development of an antibioticfree plasmid selection system based on glycine auxotrophy for recombinant protein overproduction in Escherichia coli[J]. J Biotechnol, 2008, 134:127-162.
[25] Mairhofer J, Pfaffenzeller I, Merz D, Grabherr R. A novel antibiotic free plasmid selection system:advances in safe and efficient DNA therapy[J]. Biotechnol J, 2008, 3:83-91.
[26] Goh S, Good L. Plasmid selection in Escherichia coli using an endogenous essential gene marker[J]. BMC Biotechnol, 2008, 8:61-69.
[27] Philip DS, Sarovich DS, Pemberton JM. pPSY:A vector for the stable cloning and expression of streptomycete single gene phenotypes in Escherichia coli[J] . Plasmid, 2008, 60 :53-58.
[28] Nikel PI, de Lorenzo V. Implantation of unmarked regulatory and metabolic modules in Gram-negative bacteria with specialised minitransposon delivery vectors[J]. J Biotechnol, 2013, 163 :143-154.
[29] 陆文渊, 成浩, 王丽鸳, 周健. 茶氨酸生物合成基因工程菌的质粒稳定性研究[J]. 茶叶科学, 2008, 28(2):147-151.
[30] 王宏华, 凌红丽, 侯竹美, 等. 鸡γ-干扰素基因重组质粒在工程菌株中的稳定性研究[J]. 微生物学通报, 2008, 35(7):1055-1058.
[31] 张刚, 杨光, 裴海生, 等. 质粒平均分配基因parDE 甲酸脱氢酶NADH 再生系统稳定性的影响[J]. 过程工程学报, 2008, 8(2):345-349.
[32] Filomena S, João AQ, Fernanda CD. Evaluating metabolic stress and plasmid stability in plasmid DNA production by Escherichia coli[J]. Biotechnol Adv, 2012, 30 :691-708.
[33] Sousa F, Prazeres DM, Queiroz JA. Improvement of transfection efficiency by using supercoiled plasmid DNA purified with arginine affinity chromatography[J]. J Gene Med, 2009, 11:79-88.
[34] Thumann G, Stocker M, Maltusch C, et al. High efficiency non-viral transfection of retinal and iris pigment epithelial cells with pigment epithelium-derived factor[J]. Gene Ther, 2010, 17:181-189.
[35] Yau SY, Keshavarz-Moore E, Ward J. Host strain influences on supercoiled plasmid DNA production in Escherichia coli:implications for efficient design of large-scale processes[J]. Biotechnol Bioeng, 2008, 101:529-572.
[36] Martí L, Enric S, Antoni C, et al. IPTG limitation avoids metabolic burden and acetic acid accumulation in induced fed-batch cultures of Escherichia coli M15 under glucose limiting conditions[J]. Biochem Eng J, 2013, 70:78-83.

