以碳酸钾为高效非均相催化剂合成2-氨基-3-氰基-4,5,6,7-四氢苯并[b]噻吩
谭小红,杨 平,宋新建
(1.湖北民族学院科技学院,湖北 恩施445000;2.湖北民族学院化学与环境工程学院,湖北 恩施445000)
2-氨基噻吩衍生物是一类重要的有机中间体,广泛用于农药、医药和染料等领域。例如,以取代2-氨基噻吩作为中间体可以合成出各种具有杀虫[1]、除草[2]、抗氧化[3]以及抗癌[4]等广泛生物活性的噻吩并嘧啶类化合物[5-6]。因此,研究简便高效的方法合成2-氨基噻吩衍生物已引起人们的广泛关注。目前研究最集中同时也被公认为最经典的方法是通过Gewald反应合成2-氨基噻吩衍生物,其中最常见的是三组分Gewald反应[7-8],即:以有机碱(如吗啡啉、哌啶、二乙胺或三乙胺等)作催化剂,由含α-氢的醛或酮、活泼的氰基化合物(如氰基乙酸乙酯、氰基乙酰胺或α-氰基酮类化合物等)与单质硫于室温条件下发生反应,生成2-氨基噻吩衍生物(反应如图1所示)。
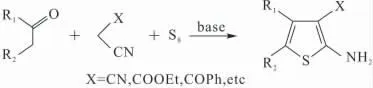
图1 三组分Gewald反应Fig.1 Gewald′s three-component reaction
为了拓展Gewald反应的适用范围,研究者尝试采用各种方法对其进行改进。如Sridhar等[9]和Huang等[10]将微波合成技术应用到Gewald反应中,大幅提高了Gewald反应的速率,大大缩短反应时间;Castanedo等[11]将固相合成技术引入Gewald反应中以提高合成效率;也有研究者[12-22]通过改变碱催化剂以改善反应效果。非均相固体碱催化剂相对于均相有机碱而言,具有产物易分离、过程易控制、催化剂热稳定性好且易回收再生等优点[9,18]。因此,作者以碳酸钾为非均相固体碱催化剂,通过三组分Gewald反应采用一锅法简易高效合成2-氨基-3-氰基-4,5,6,7-四氢苯并[b]噻吩(反应如图2所示),并考察了催化剂用量、反应时间、溶剂类型对目标产物收率的影响,优化了反应条件。

图2 目标化合物的合成反应Fig.2 The synthetic reaction of target compound
1 实验
1.1 试剂与仪器
所用试剂均为分析纯或化学纯。
Varian XL-400型超导核磁共振仪(TMS为内标,DMSO-d6为溶剂);NEXUS 470型傅立叶红外光谱仪(KBr压片);Thermo DSQⅡ型质谱仪;X4型显微熔点测定仪(温度计未经校正)。
1.2 方法
在装有回流冷凝管的圆底烧瓶中加入9.80g(0.10mol)环己酮、6.61g(0.10mol)丙二腈、3.50g升华硫和30mL溶剂,再加入一定量的碳酸钾,在78℃下反应一段时间后,TLC监测反应完成;过滤除去碳酸钾,减压蒸除溶剂,粗产品先水洗再用乙醇重结晶,得淡黄色晶体即目标化合物。熔点:146℃(文献[22]值147℃);1HNMR(400MHz,DMSO-d6),δ:1.69(s,4H,CH2at 5and 6),2.31(s,2H,CH2at 4),2.39(s,2H,CH2at 7),6.93(s,2H,NH2);13CNMR(100MHz,DMSO-d6),δ:21.84,22.99,23.50,24.04,83.17,116.23,116.79,131.09,163.77;IR(KBr),ν,cm-1:3446、3328、1618(N-H),2195(C≡N);EI-MS,m/z,%:178(74.6,M+),150(100)。
2 结果与讨论
2.1 产物结构表征
实验发现,产物的IR图谱中,在3446cm-1、3328 cm-1附近出现2个N-H伸缩振动吸收谱带,且在1618cm-1处出现较强的N-H剪式振动吸收峰,这是伯胺的另一特征吸收,而在2195cm-1处出现C≡N强尖峰;1HNMR图谱中,2个氨基活泼质子的δ值在6.93左右,重水交换消失,环己烯基上4个亚甲基质子的化学位移在1.69~2.39之间;13CNMR图谱(图3)中出现9条谱线,化学位移与理论值相符合;MS图谱中存在分子离子峰。上述分析结果印证了产物结构与目标化合物相符,推测其分子结构如图4所示。
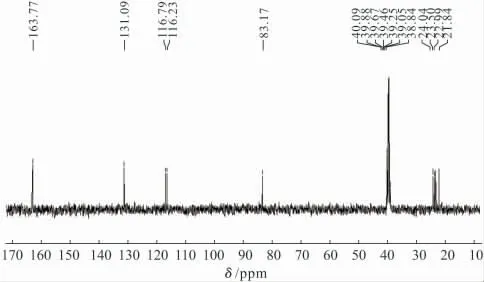
图3 产物的13CNMR图谱Fig.3 The 13CNMR spectrum of the product
2.2 反应条件的优化
2.2.1 催化剂用量对反应的影响
以乙醇为反应溶剂,回流条件下反应3.0h,考察催化剂用量(摩尔分数,下同)对产物收率的影响,结果见图5。

图4 产物的分子结构Fig.4 Molecular structure of the product
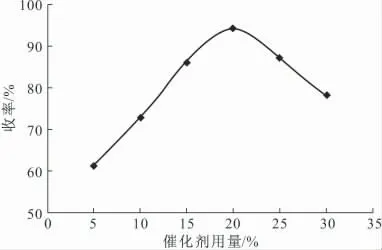
图5 催化剂用量对产物收率的影响Fig.5 The effect of catalyst dosage on the yield of target compound
从图5可以看出,催化剂用量对产物收率的影响比较明显,当催化剂用量为20%时,产物收率达到最大值。因此,确定最佳催化剂用量为20%。
2.2.2 反应时间对反应的影响
以乙醇为反应溶剂,催化剂用量为20%,在回流条件下进行反应,考察反应时间对产物收率的影响,结果见图6。

图6 反应时间对产物收率的影响Fig.6 The effect of reaction time on the yield of target compound
从图6可以看出,随着反应时间的延长,产物收率逐渐上升;当反应时间超过3.0h以后,升幅趋缓。因此,确定最佳反应时间为3.0h。
2.2.3 溶剂类型对反应的影响
催化剂用量为20%,在78℃下反应3h,考察溶剂类型对产物收率的影响,结果见表1。
从表1可以看出,所考察的4种溶剂中乙醇的产物收率最高。因此,确定乙醇作为反应溶剂。
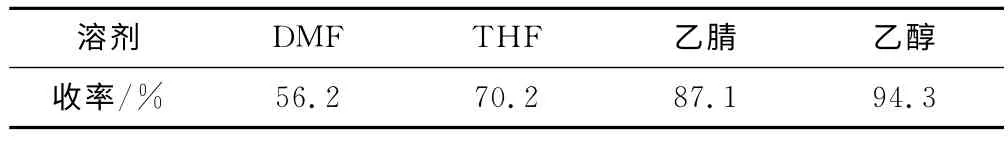
表1 溶剂类型对产物收率的影响Tab.1 The effect of solvent type on the yield of target compound
2.3 合成方法比较
为了对本合成方法进行评价,将其与部分文献所载方法予以比较,结果列于表2。

表2 不同合成方法的比较Tab.2 Comparison of different synthetic methods
从表2可看出:与本研究相比,尽管方法2的收率最高,但其反应时间长、所用催化剂价格高,分离操作也很繁琐;采用微波合成技术虽可提高Gewald反应的合成效率,大大缩短反应时间,但微波反应器价格昂贵,且通常仅适用于实验室小规模合成。本研究提出的合成方法选用的非均相固体碱催化剂碳酸钾是一种价廉高效、无毒无害的绿色催化剂,符合绿色化学的发展方向,且反应时间短、分离纯化操作简单、产物收率高、易于实现工业化生产,可为利用Gewald反应合成其它2-氨基噻吩衍生物提供良好借鉴。
3 结论
提出了一种以碳酸钾为非均相固体碱催化剂的通过三组分Gewald反应一锅法简易高效合成2-氨基-3-氰基-4,5,6,7-四氢苯并[b]噻吩的新方法。考察了催化剂用量、反应时间以及溶剂类型对反应的影响,确定最佳反应条件如下:催化剂用量为20%(摩尔分数),反应时间为3.0h,溶剂为乙醇。该方法具有催化剂价廉高效、分离纯化简单、反应时间短以及产物收率高等优点。
[1]ALY A S,El-GAZZAR A B A,HUSSEIN H A R.The synthesis of some new derivatives derived from 1,2,3,4-tetrahydrocyclohepteno[4,5]thieno[2,3-d]pyrimidine[J].Phosphorus Sulfur Silicon Relat Elem,2007,182(1):35-56.
[2]REN Q Y,TAN X S,HE H W.Efficient synthesis of fused pyrimidine derivatives with biological activity via Aza-Wittig reaction[J].Curr Org Syn,2011,8(5):752-763.
[3]KOTAIAH Y,HARIKRISHNA N,NAGARAJU K,et al.Synthesis and antioxidant activity of 1,3,4-oxadiazole tagged thieno[2,3-d]pyrimidine derivatives[J].Eur J Med Chem,2012,58:340-345.
[4]DENG Y J,ZHOU X L,DESMOULIN S K,et al.Synthesis and biological activity of a novel series of 6-substituted thieno[2,3-d]pyrimidine antifolate inhibitors of purine biosynthesis with selectivity for high affinity folate receptors over the reduced folate carrier and proton-coupled folate transporter for cellular entry[J].J Med Chem,2009,52(9):2940-2951.
[5]SONG X J,DUAN Z C,SHAO Y,et al.Facile synthesis of novel fluorinated thieno[2,3-d]pyrimidine derivatives containing 1,3,4-thiadiazole[J].Chin Chem Lett,2012,23(5):549-552.
[6]MIWA K,HITAKA T,IMADA T,et al.Discovery of 1-{4[1-(2,6-difluorobenzyl)-5-[(dimethylamino)methyl]-3-(6-methoxypyridazin-3-yl)-2,4-dioxo-1,2,3,4-tetrahydrothieno[2,3-d]pyrimi-din-6-yl]phenyl]-3-methoxyurea(TAK-385)as a potent,orally active,non-peptide antagonist of the human gonadotropin-releasing hormone receptor[J].J Med Chem,2011,54(14):4998-5012.
[7]GEWALD K,SCHINKE E,B TTCHER H.Heterocyclen aus CHaciden nitrilen.ⅤⅢ:2-Amino-thiophene aus methylenaktiven nitrilen,carbonylverbindungen und schwefel[J].Chem Ber,1966,99:94-100.
[8]张豹子,刘洋,王凌.Gewald反应及其在药物合成中的应用[J].中国抗生素杂志,2012,37(8):579-586.
[9]SRIDHAR M,RAO R M,BABA N H K,et al.Microwave-accelerated Gewald reaction:Synthesis of 2-aminothiophenes[J].Tetrahedron Lett,2007,48(18):3171-3172.
[10]HUANG W,LI J,TANG J,et al.Microwave-assisted synthesis of 2-amino-thiophene-3-carboxylic derivatives under solvent-free conditions[J].Synth Commun,2005,35(10):1351-1357.
[11]CASTANEDO G M,SUTHERLIN D P.Synthesis of tetrasubstituted thiophenes on solid-support using the Gewald reaction[J].Tetrahedron Lett,2001,42(41):7181-7184.
[12]HESSE S,PERSPICACE E,KIRSCH G.Microwave-assisted synthesis of 2-aminothiophene-3-carboxylic acid derivatives,3 Hthieno[2,3-d]pyrimidin-4-one and 4-chlorothieno[2,3-d]pyrimidine[J].Tetrahedron Lett,2007,48(30):5261-5264.
[13]FEROCI M,CHIAROTTO I,ROSSI L,et al.Activation of elemental sulfur by electrogenerated cyanomethyl anion:Synthesis of substituted 2-aminothiophenes by the Gewald reaction[J].Adv Synth Catal,2008,350(17):2740-2746.
[14]HUANG X G,LIU J,REN J M,et al.A facile and practical onepot synthesis of multisubstituted 2-aminothiophenes via imidazole-catalyzed Gewald reaction[J].Tetrahedron,2011,67(34):6202-6205.
[15]WANG T,HUANG X G,LIU J,et al.An efficient one-pot syn-thesis of substituted 2-aminothiophenes via three-component Gewald reaction catalyzed by L-proline[J].Synlett,2010,(9):1351-1354.
[16]RAJAGOPAL R,JYOTHI T M,DANIEL T,et al.Calcined Mg-Al hydrotalcite as a heterogeneous base catalyst for Gewald aminothiophene synthesis[J].Synth Commun,2001,31(20):3113-3117.
[17]REZAEI-SERESHT E,TAYEBEE R,YASEMI M.KG-60-Piperazine as a new heterogeneous catalyst for Gewald three-component reaction[J].Synth Commun,2013,43(13):1859-1864.
[18]MOEINPOUR F,OMIDINIA R,DOROSTKAR-AHMADI N,et al.Cesium carbonate as a heterogeneous base catalyst for synthesis of 2-aminothiophenes via Gewald reaction[J].Bull Korean Chem Soc,2011,32(6):2091-2092.
[19]HU Y,CHEN Z C,LE Z G,et al.Organic reactions in ionic liquids:Gewald synthesis of 2-aminothiophenes catalyzed by ethylenediammonium diacetate[J].Synth Commun,2004,34(20):3801-3806.
[20]SOPBUE F E,DOEPP D,HENKEL G.Reactions of some anellated 2-aminothiophenes with electron poor acetylenes[J].Tetrahedron,2006,62(29):7121-7131.
[21]TAYEBEE R,JAVADI F,ARGI G.Easy single-step preparation of ZnO nano-particles by sedimentation method and studying their catalytic performance in the synthesis of 2-aminothiophenes via Gewald reaction[J].J Mol Catal A-Chem,2013,368-369:16-23.
[22]MOEINPOUR F,DOROSTKAR N,VAFAEI M.Mg/La Mixed oxide as an efficient heterogeneous basic catalyst for synthesis of 2-aminothiophenes under microwave irradiation[J].Synth Commun,2012,42(16):2367-2374.

