番茄抗黄化曲叶病毒基因Ty-3的AFLP标记
姜景彬,刘晓东,许向阳,陈秀玲,李景富
(东北农业大学园艺学院,哈尔滨 150030)
番茄抗黄化曲叶病毒基因Ty-3的AFLP标记
姜景彬,刘晓东,许向阳,陈秀玲,李景富*
(东北农业大学园艺学院,哈尔滨 150030)
以感病材料10981为父本(P1),抗病材料10032为母本(P2),通过自交、杂交和回交,获得P1、P2两个亲本和F1、F2、BC1及BC2群体,接种鉴定各世代发病情况。选用288对Eco RⅠ/MseⅠ引物组合对P1、P2两个亲本,F1和F2代群体进行AFLP分析。卡方测验结果表明,抗源材料10032对黄化曲叶病毒的抗性表现为单基因显性遗传。经AFLP引物筛选及遗传连锁分析,获得与抗病基因Ty-3紧密连锁的标记E40/M49,遗传距离为3.4 cM。该研究可为番茄抗TYLCV分子标记辅助选择和抗TYLCV育种奠定基础。
番茄黄化曲叶病毒;Ty-3;AFLP;遗传距离
番茄黄化曲叶病毒(TYLCV)属于双生病毒科(Geminiviridae)菜豆金色花叶病毒属(Begomovirus),是一类通过烟粉虱(Bemlsiatobaci)传播,含孪生颗粒形态单链环状DNA的植物病毒[1-2]。1964年Cohen和Harpaz首次发现番茄黄化曲叶病毒[3]。目前,番茄黄化曲叶病毒已扩展到非洲、中东、东南亚、地中海、中美洲、澳大利亚、日本、印度、墨西哥、加勒比海,以及美国的佛罗里达州、加州等地区[4-8]。我国浙江、上海、广西、云南、江苏、河南、广东、福建、山东、海南和台湾等地区也相继发生番茄黄化曲叶病毒危害,使番茄生产遭受严重损失。
分子标记的多样化给番茄抗病基因定位带来不同研究手段,AFLP、RAPD等分子标记在番茄抗黄化曲叶病毒病抗性基因的研究上取得进展,LA2779和LA1932材料中发现G8基因,序列不同,分别命名为Ty-3和Ty3-a,但Ty-3基因的遗传规律和连锁机制尚不明确。本文利用含有Ty-3抗病基因的抗病材料10032和感病材料10981,构建6个世代群体,通过田间抗病性鉴定和AFLP分子标记方法,确定抗病基因Ty-3的遗传规律和连锁机制,可为抗番茄黄化曲叶病分子育种奠定基础。
1 材料与方法
1.1 材料
抗病亲本10032和感病亲本10981,由东北农业大学番茄研究所提供。对两个亲本进行有性杂交获得F1,F1自交获得F2,F1分别与P1和P2回交分别获得BC1和BC2。
1.2 番茄黄化曲叶病毒病抗病性鉴定
病毒采自浙江杭州和海宁地区的番茄植株,毒源通过烟粉虱传毒繁殖保存于防虫温室。采集温室中经烟粉虱接种的番茄叶片,-20℃保存备用。采用烟粉虱侵染接种法,P1、P2、F1、F2、BC1、BC2的抗病性鉴定在营养钵中进行,设置3次重复。P1、P2和F1每个重复种植30株;F2为分离群体,则每个重复种植90株,BC1和BC2每个重复种植30株,重复内各组合随机排列。接种后不定期调查番茄秧苗发病情况,并于接种后20 d,感病亲本已充分发病时逐株调查各株的发病情况,计算发病株率和病情指数;按照申书兴方法进行发病严重度分级[9]:0级-无症状;1级-明脉、叶片轻黄化;3级-叶片黄化、边缘上卷;5级-叶片重黄化、皱缩、少数叶片畸形;7级-叶片重黄化、畸形缩小,植株明显矮化;9级-叶片严重畸形缩小,植株严重矮化,甚至枯死。根据通用的番茄病毒病群体分级标准[10]将各世代番茄秧苗分为:免疫-I,不表现症状,病情指数为0;高抗-HR,0<病情指数≤2;抗病-R,2<病情指数≤15;中抗-MR,15<病情指数≤30;感病-S,30<病情指数≤100;并将I、HR、R以及MR归为抗病,将S归为感病,然后进行抗病性遗传适合性测验,确定抗病亲本的抗病性遗传规律。
1.3 AFLP标记
1.3.1 DNA的提取及BSA分池
采用改良的CTAB法提取DNA,在F2群体中随机选取10株高抗单株和10株高感单株的DNA混合成抗病池(R1)和感病池(S2)。
1.3.2 酶切与连接
25 μL体系,其中10×Buffer 2.5 μL、DNA 1 μL、ATP(10 mmol·L-1)0.5 μL、Eco RⅠadapter(5 pmol·μL-1)0.5 μL、MseⅠadapter(50 pmol·μL-1)0.5 μL、Eco RⅠ(10 U·μL-1)0.25 μL、MseⅠ(10 U·μL-1)0.25 μL、T4DNA Ligase(5 U·μL-1)0.3 μL;混匀,37℃酶切与连接12 h或过夜。
1.3.3 酶切连接产物预扩增
预扩增体系为20 μL,其中酶切连接产物DNA 4.0 μL;10×Buffer 2.0 μL;MgCl21.2 μL;dNTP(2.5 mmol·L-1)1.6 μL;E00(50 ng·μL-1)0.6 μL;M00(50 ng·μL-1)0.6 μL;Taq DNA polymerase(5 U·μL-1)0.2 μL;PCR程序为94℃3 min;94℃30 s;56℃30 s;72℃1 min;72℃10 min;24个循环,4℃保存。取4 μL预扩产物在0.8%琼脂糖中检测预扩增结果。
1.3.4 预扩产物选择性扩增
选扩体系为20 μL,其中10×Buffer 2.0 μL;DNA(预扩增产物稀释30×)5.0 μL;MgCl2(25 mmol·L-1)1.2 μL;dNTP(2.5 mmol·L-1)1.6 μL;Exx(50 ng·μL-1)1.0 μL;Mxx(50 ng·μL-1)1.0 μL;Taq DNA polymerase(5 U·μL-1)0.2 μL;PCR程序为94℃变性3 min;94℃变性30 s;65℃退火30 s;72℃延伸1 min;共12个循环,每个循环退火温度降低0.7℃;之后94℃变性30 s;56℃退火30 s;72℃延伸1 min;共26个循环,每个循环退火时间加1 s;72℃10 min,4℃保存。取5 μL选扩产物在0.8%琼脂糖中检测预扩增结果。
1.3.5 扩增产物变性处理
在选择性扩增产物中加入30%~40%的Loading Buffer,PCR仪中95℃变性5 min,然后立即置于冰水混合物中。
1.3.6 聚丙烯酰胺凝胶电泳
选扩产物在聚丙烯酰胺凝胶中电泳分离,电泳液为1×TBE溶液,恒定功率80 W,预电泳30 min。取5 μL变性产物进行点样,65 W恒定功率1.5 h,电泳后进行银染。
2 结果与分析
2.1 田间各世代抗病情况
为了研究Ty-3基因的遗传规律,待感病亲本充分发病后开始调查,调查结果如表1所示。结果表明感病亲本P1全部发病;抗病亲本P2中89株未发病,1株发病为1级;F1代87株未发病,1株发病为1级,1株发病为5级;F2代中204株发病在1级及1级以下,62株发病在5级以上;BC1中发病程度在3级及3级以下的有47株,5级及5级以上的有43株;BC2中发病程度均在1级及1级以下。从而得出,回交世代呈1∶1,F2群体呈3∶1分离比例。对表中数据进行经卡方检验,结果表明人工接种鉴定,实得卡方值分别为0.363和0.1均小于X20.05= 3.841,符合单基因显性遗传特性。
2.2 AFLP引物筛选
为了研究番茄黄化曲叶病毒病基因Ty-3的连锁机制,本试验采用288对Eco RⅠ/MseⅠ引物组合对亲本及由F2代建立的抗感池进行AFLP标记筛选(见图1),寻找与目的基因紧密连锁的引物组合,最终筛选出11对多态性好、差异明显且稳定性高的引物,分别是E35/M61、E36/M36、E36/ M47、E36/M48、E36/M50、E51/M37、E38/M61、E40/M47、E40/M49、E41/M49、E41/M59。
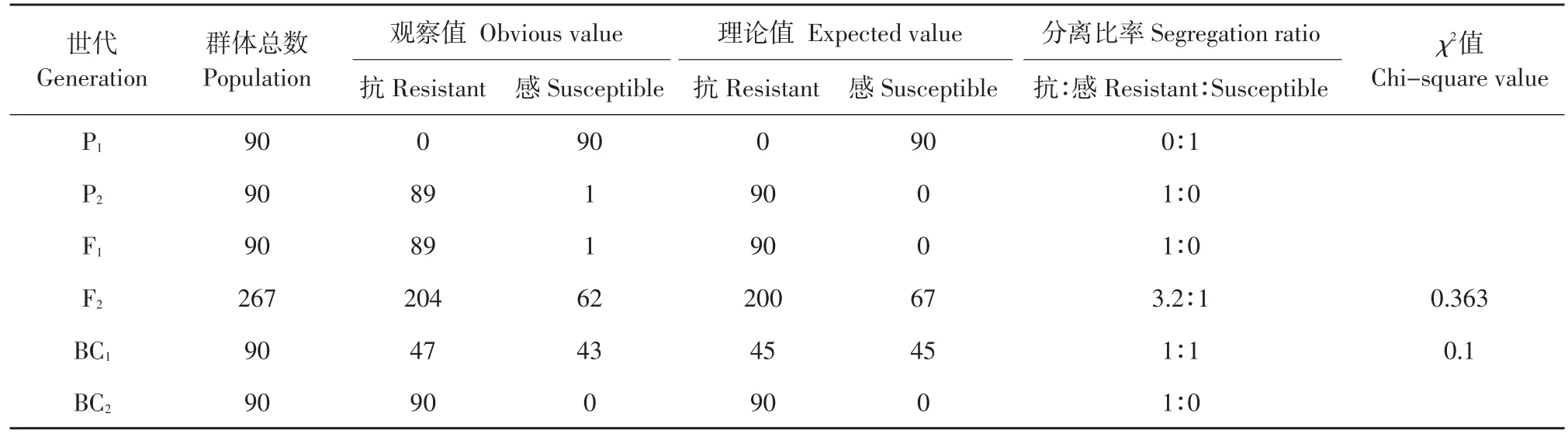
表1 苗期人工接种条件下番茄黄化曲叶病毒病抗性遗传的适合性测验Table 1 Chi-square test for resistant trait inheritance to TYLCV after inoculation

图1 10981×10032群体筛选出的部分AFLP特异引物Fig.1 Screened AFLP primers on 10981×10032 population
2.3 F2代单株PCR扩增
以10032×10981群体的267个F2单株DNA的预扩增产物为模板,再将已筛选出的11对引物进行选择性扩增,然后用聚丙烯酰胺凝胶电泳检测,并记录谱带。
结果见图2。
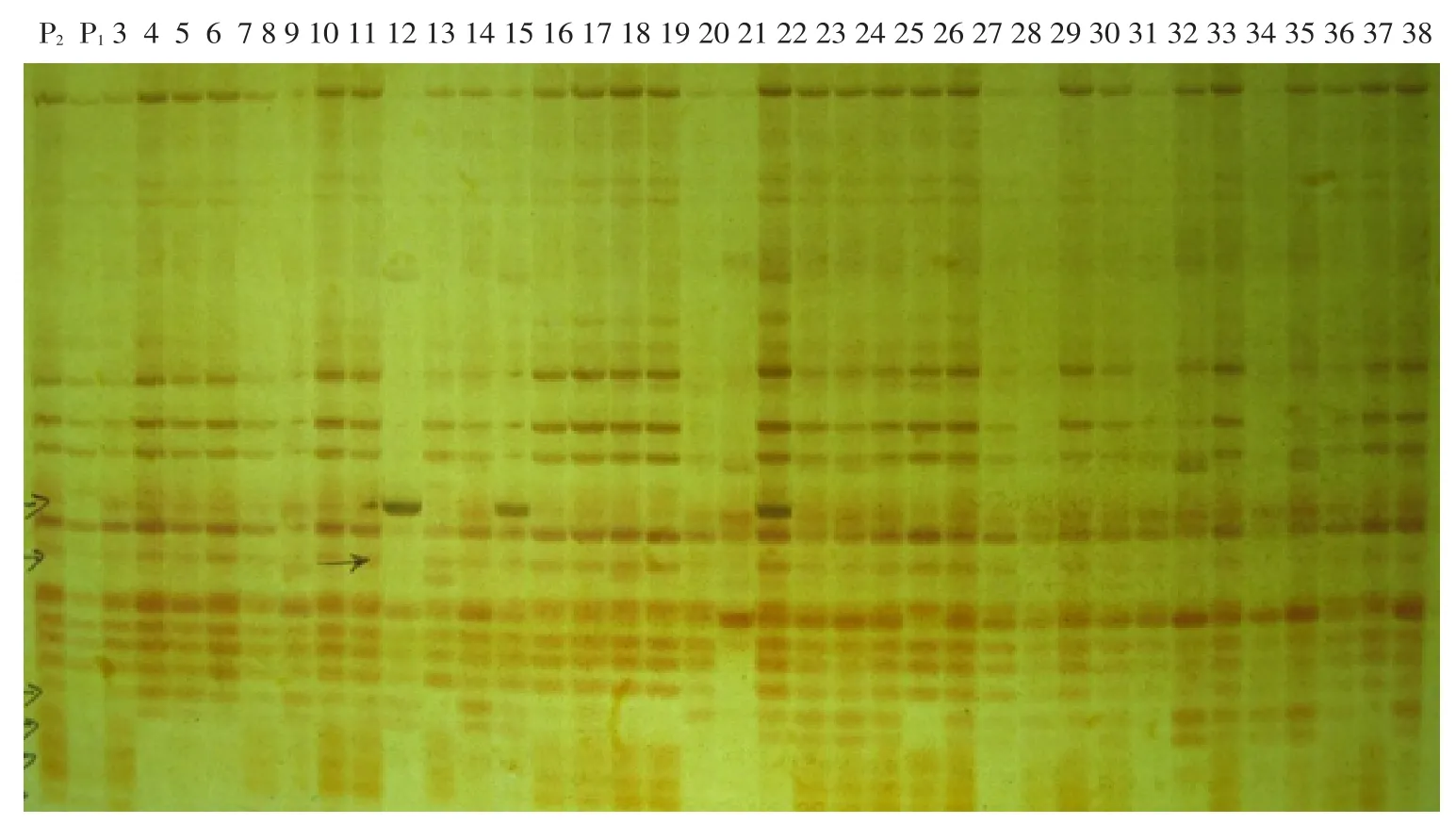
图2 引物E40/M49在部分F2单株中的扩增结果Fig.2 Amplified products on AFLP primer of E40/M49 on partial F2population
2.4 连锁分析及遗传距离的确定
利用MAPMAKE 3.0软件对分离群体单株的抗病性表现和分子标记的分离数据进行连锁分析,得出遗传距离(cM)。结果表明,E40/M49、E41/ M49、E36/M48与抗病基因Ty-3的连锁遗传距离分别为3.4、11.6、18.3 cM。
3 讨论
本试验研究结果表明,通过AFLP标记,找出与目的基因紧密连锁的E40/M49,遗传距离为3.4 cM。通过研究六个世代的田间抗病情况,得出本试验材料中含有的抗番茄黄化曲叶病毒病Ty-3基因是单基因显性遗传。目前关于番茄对黄化曲叶病毒抗性遗传规律的报道结论各异,主要是抗源材料来源不同,导致其对TYLCV抗性遗传规律不同,或只是由于TYLCV菌株的差异和病毒的重组变异而导致其致病机理发生变化,相应表现出不相同的抗病机制[11],因此有的呈一对单基因显性或部分显性,有的呈一对隐性基因控制,有的受多基因控制的数量性状等。Piloswsky和Cohen报道,醋栗番茄(L.pimpinellifolium)LA121、LA1478、LA1582对TYLCV的抗性是由一对不完全显性基因控制,秘鲁番茄(L.peruvianum)PI126935对TYLCV抗性为多对(5对)隐性基因控制[12]。而Hassan等认为醋栗番茄(L.pimpinellifolium)LA121和LA373的抗病性是由部分隐性基因所控制的数量性,多毛番茄(L.hirsutum)LA386对TYLCV的抗性是由一对显性基因控制,契斯曼尼番茄(L.cheesmanii)LA1401对TYLCV抗性是由一对隐性基因控制[13]。而Vidavsky和Czosnek认为多毛番茄(L.hirsutum)LA386对TYLCV的抗病由2~3对隐性基因控制,耐病为一对显性基因控制[14]。而Lapidot等报道,秘鲁番茄PI126926、LA441抗病性由一对部分显性基因控制[15]。Zamir等报道,智利番茄(L.chilense)LA1969、LA1932对TYLCV抗性是由一对显性基因(Ty-1)所控制[16]。
本试验材料10032(P2)含有的抗黄化曲叶病毒Ty-3基因是单基因显性遗传,与亚蔬中心报道一致。本试验可为番茄抗黄化曲叶病毒育种奠定基础,将不同抗性基因聚合到同一品种可产生更加稳定持久的抗性。
[1]MMorilla G,Janssen D,García Andrés S,et al.Pepper(Capsicum annuum)is a dead-end host for tomato yellow leaf curl virus[J]. Phytopathology,2005,95(9):1089-1097.
[2]Picó B,Díez M J,Nuez F.Viral diseases causing the greatest economic losses to the tomato crop.II.The tomato yellow leaf curl virus-a review[J].Scientia Horticulturae,1996,67:151-196.
[3]Cohen S,Harpaz I.Periodic,rather than continual acquisition of a new tomato virus by its vector,the tobacco whitefly(Bemisia tabaci Gennadius)[J].Entomologia Experimentaliset Applicata, 1964(7):155-166.
[4]Czosnek H,Laterrot H.A worldwide survey of tomato yellow leaf curl viruses[J].Archives of Virology,1997,142:1391-1406.
[5]Moriones E,Navas-Castillo J.Tomato yellow leaf curl virus,an emerging virus complex causing epidemics worldwide[J].Virus Research,2000,71:123-134.
[6]Accotto GP,Bragaloni M,Luison D,et al.First report of tomato yellow leaf curl virus(TYLCV)in Italy[J].Plant Pathology,2003, 52:799.
[7]Polston J E,Rosebrock T R,Sherwood T,et al.Appearance of tomato yellow leaf curl virus in North Carolina[J].Plant Disease, 2002,86(1):73.
[8]Ueda S,Takeuchi S,Okabayashi M,et al.Evidence of new tomato yellow leaf curl virus in Japan and its detection using PCR[J]. Journal of General Plant Pathology,2005,71:319-325.
[9]申书兴.园艺植物育种学实验指导[M].北京:中国农业大学出版社,2002.
[10]西南农业大学.蔬菜研究法[M].第2版.郑州:河南科学技术出版社,1989.
[11]Garcia-Andrds S,Accotto G P,Navas-Castillo J,et al.Founder effect,planthost,andrecombinationshapetheemergent population of begomoviruses that cause the tomato yellow leaf curl disease in the Mediterranean basin[J].Virology,2007,359:302-312.
[12]Pilowsky M,Cohen S.Inheritance of resistance to tomato yellow leaf curl virus in tomatoes[J].Phytopathology,1974,64:632-635.
[13]Hassan A A,Mazyad H M,Moustafa S E,et al.Inheritance ofresistance to tomato yellow leaf curl virus derived from Lycopersicon cheesmanii and Lycopersiconhirsutum[J].Hort Science, 1984,19:574-575.
[14]Vidavsky F,Czosnek H.Tomato breeding lines resistant and tolerant totomato yellow leaf curl virusissued from Lycopersiconhirsutum[J].Phytopathology,1998,88:910-914.
[15]Lapidot M,Goldray O,Ben-Joseph R,et al.Breeding tomatoes for resistance to tomato yellow leaf curl begomovirus[J].Bulletin OEPP/EPPO,2000,30:317-321.
[16]Zamird,Michelson I,Zakay Y,et a1.Mapping and introgression of a tomato yellow leaf curl virus tolerance gene,Ty-1[J].Theor Appl Genet,1994,88:141-146.
Identification of AFLP markers linked to TYLCV resistance geneTy-3 in tomato
JIANG Jingbin,LIU Xiaodong,XU Xiangyang,CHEN Xiuling,LI Jingfu
(School of Horticulture,Northeast Agricultural University,Harbin 150030,China)
Abstract:Through hybridization,self crossing and back cross of the resistant parent P2and susceptible parent P1,P1,F1(P1×P2),F2,BC1,and BC2were obtained.Plant disease incidence of all obtained generations was surveyed after artificial inoculation.AFLP analysis was conducted with 288EcoR I/MseI primer combinations on two parents P1,P2,F1and F2generations of resistant and susceptible gene pool.The results showed that the generation of resistant and susceptible plants showed regular distribution.The Chi-square test results showed that yellow leaf curl virus resistance gene was one dominant gene in the resistant material P2.Genetic linkage analysis of the specific bands of AFLP markers and target gene was carried on in the F2segregating population.The results showed that the specific bands E40/M49 was tightly linked to tomato yellow leaf curl virus resistant gene,and the genetic distance was 3.4 cM.This study would expedite the selection of tomato germplasm and could be used in TYLCV resistant breeding practice.
tomato yellow leaf curl virus(TYLCV);Ty-3;AFLP;genetic distance
S436.412
A
1005-9369(2014)01-0103-05
2012-03-28
“十二五”国家支撑计划项目(2012BAD02B02-7)
姜景彬(1978-),男,农艺师,硕士,研究方向为蔬菜遗传育种。E-mail:jjb1248@126.com
*通讯作者:李景富,教授,博士生导师,研究方向为蔬菜遗传育种与生物技术。E-mail:Ljf-2005@126.com
时间2014-1-10 6:23:44[URL]http://www.cnki.net/kcms/detail/23.1391.S.20140110.0623.001.html
姜景彬,刘晓东,许向阳,等.番茄抗黄化曲叶病毒基因Ty-3的AFLP标记[J].东北农业大学学报,2014,45(1):103-107.
Jiang Jingbin,Liu Xiaodong,Xu Xiangyang,et al.Identification of AFLP markers linked to TYLCV resistance geneTy-3 in tomato[J].Journal of Northeast Agricultural University,2014,45(1):103-107.(in Chinese with English abstract)

