红花注射液对局灶性缺血性模型大鼠皮质内iNOS、COX-2表达的影响①
李静,刘旭东,陈文明,杨小艳,罗勇,②
(1.遵义医学院第三附属医院神经内科,贵州 遵义 563000 E-mail:lijing509@163.com;2.遵义医学院第一附属医院内科实验室,贵州 遵义 563000;3.贵州航天医院神经内科,贵州 遵义 563003)
红花作为一种传统的活血化瘀的代表性药物,本草纲目记载有“活血、润燥、止痛、散肿、通经”功效[1]。其提取物红花注射液,目前被人们所广泛认可并主要用于治疗冠心病、心绞痛、脉管炎等多种血液循环障碍疾病的治疗[2]。但是关于红花注射液通过抑制炎症反应,从而实现其保护作用的报道少见。本课题组研究,红花注射液通过抑制局灶性脑卒中炎症蛋白的表达。通过红花注射液不同浓度对局灶性缺血性大鼠模型治疗作用,观察皮质iNOS、COX-2的表达,从蛋白水平分析其作用机制,为红花注射液在治疗缺血性脑卒中的应用提供实验依据。
1 材料与仪器
1.1 实验动物 SD 大鼠,36只,雄性,体重(260±20)g,购自第三军医大学大坪医院实验动物中心,清洁级,合格证号:SCXK(渝)2007-0005。
1.2 药物 红花注射液(雅安三九药业有限公司生产),尼莫地平注射液(济南利民制药有限责任公司生产);iNOS(Lo:t 1106)和COX-2(Lo:t C0206)免疫组化试剂盒(北京中山生物技术有限公司);磷酸盐缓冲液、枸橼酸盐缓冲液(北京中杉金桥生物技术有限公司);SABC免疫组化染色试剂盒、DAB(武汉博士德生物工程有限公司),大脑中动脉阻塞(MCAO)栓线(北京沙东生物公司),Leica光学显微镜及照相系统(德国Leica Microsystems Ltd)。中性树胶(上海标本模型厂)。
2 方法
2.1 模型制备 根据改进的Zea Longa[3]方法,用10%的水合氯醛腹腔注射麻醉,固定,颈正中切口,分离右侧颈总动脉,右颈内动脉、颈外动脉,分别放置手术线备用。结扎颈总动脉和颈外动脉,距颈总动脉分叉处约4 mm 处剪一小口,将MCAO栓线圆头端栓线插入颈内动脉,以颈内动脉和颈外动脉分叉处为标记,推进18~20 mm,感到阻力即到达了较细的大脑前动脉内,阻断了大脑中动脉的所有血供来源。结扎颈内动脉,缝合(将栓线预留少许于体外)。栓塞2h后,固定大鼠,将栓线抽拉出至颈内、外动脉分叉处。正常组和对照组不做任何处理,参照文献进行神经功能评分[2],评分大于2分,入选。
2.2 动物分组与给药 将36只健康的Wistar大鼠随机分成6组:①正常给药组;②模型对照组;③低剂量红花组;④中剂量红花组;⑤高剂量红花组;⑥阳性药(尼莫地平)组。每组6只。分组结束后开始给药,每天3次;给药2周后。制模24h后开始采用改良的Bedersons评分方法进行神经功能缺陷评分,评分大于2分入组。正常对照组6只,各实验组每组6只。正常对照组不予处理;红花注射液不同浓度组(0.8 ml·kg-1·d-1、1.6ml·kg-1·d-1、3.2ml·kg-1·d-1)与模型组于模型成功后,24h后开始连续灌胃给药,每天1次,连续3d;正常对照组及模型组给予生理盐水。
2.3 大鼠大脑皮质神经元iNOS、COX-2表达的检测 3d后将大鼠迅速处死取脑,固定,选取注射部位,修块,再固定,乙醇梯度脱水,二甲苯透明,石蜡包埋,切片,采用免疫组化(PV 二步法)检测大鼠大脑皮质神经元iNOS、COX-2的表达,其中滴加一抗(iNOS为兔抗大鼠,COX-2 为山羊抗大鼠),一抗的稀释比例(iNOS、COX-2为1∶100),阴性对照用PBS 代替一抗。光镜下观察大鼠大脑皮质神经元2项免疫指标的变化。每组大鼠脑组织切片5张,每张切片皮质层分别随机选取2个区域,观察400倍显微镜下计算此区域内的免疫组化染色的阳性细胞,计算阳性目标总面积与统计场总面积比值。
2.4 统计学方法 取平均值进行统计,数据分析采用SPSS 13.0软件分析,数据采用(±s)表示,组间数据进行t检验。P<0.05为差异有统计学意义。
3 结果
3.1 红花注射液对局灶性脑缺血大鼠大脑皮质iNOS蛋白表达的影响 正常对照组脑组织中iNOS蛋白未见表达,模型组iNOS蛋白明显表达;与模型组比较,红花注射液各剂量组和尼莫地平注射液组阳性细胞数目明显减少(P <0.01),红花注射液各组与尼莫地平注射液组相比差异无统计学意义(P>0.05),见表1。
表1 各组大鼠大脑皮质内iNOS的表达 (±s,n =6)

表1 各组大鼠大脑皮质内iNOS的表达 (±s,n =6)
注:与模型组比较,a:t=5.999,P <0.001,b:t=6.989,P<0.001,c:t=5.949,P <0.001,d:t=7.656,P <0.001
组别 剂量(ml·kg-1·d-1)阳性细胞数(个)正常对照组1.6 0模型组0 103.0±8.01红花注射液低剂量组0.8 74.6±6.92a红花注射液中剂量组1.6 70.5±6.63b红花注射液高剂量组3.2 69.8±9.57c尼莫地平注射液组2.0 69.6±5.67d
3.2 红花注射液对局灶性脑缺血大鼠大脑皮质COX-2蛋白表达的影响 正常对照组脑组织中COX-2蛋白见少量表达;与正常对照组比较,模型组COX-2 蛋白阳性细胞数明显增加;与模型组比较,红花注射液各剂量组和尼莫地平注射液组阳性细胞数目减少(P <0.01),红花注射液各组与尼莫地平注射液组相比差异无统计学意义(P >0.05),见表2。
表2 各组大鼠大脑皮质内COX-2的表达 (±s,n =6)
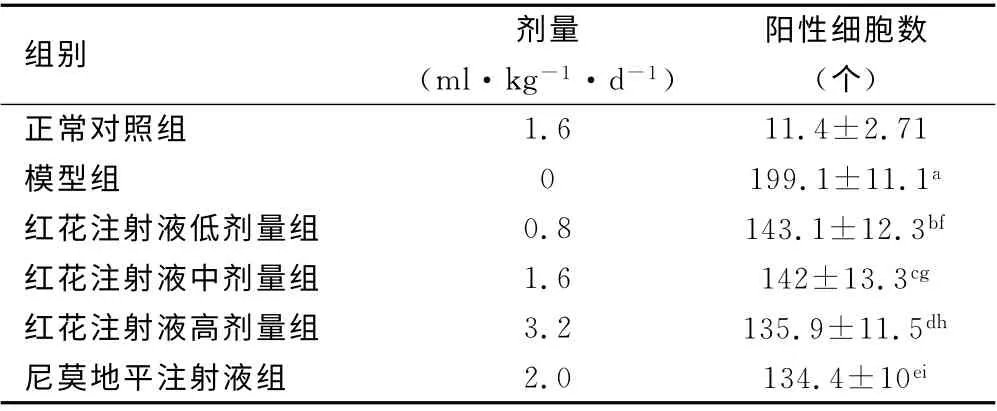
表2 各组大鼠大脑皮质内COX-2的表达 (±s,n =6)
注:与 正 常 对照组比 较,a:t =36.733,P <0.001,b:t=23.382,P <0.001,c:t =21.515,P <0.001,d:t =23.563,P <0.001,e:t=26.546;与模型组比较,f:t=7.558,P<0.001,g:t=7.370,P <0.001,h:t=8.842,P <0.001,i:t=9.684,P <0.001
组别 剂量(ml·kg-1·d-1)阳性细胞数(个)正常对照组1.6 11.4±2.71模型组0199.1±11.1a红花注射液低剂量组0.8 143.1±12.3bf红花注射液中剂量组1.6 142±13.3cg红花注射液高剂量组3.2 135.9±11.5dh尼莫地平注射液组2.0 134.4±10ei
4 讨论
脑缺血后,涉及到自由基的损伤、细胞内Ca2+超载、炎性细胞及细胞因子的浸润、凋亡基因激活、兴奋性氨基酸的神经毒性作用等多个方面。iNOS作为NO 的诱导型,在作用取决于脑损伤后不同时间点及不同细胞类型,发挥不同的作用。既往研究显示iNOS在自身免疫性疾病或慢性炎症过程及其它疾病中可能起有害的作用。一方面具有神经介质及扩张血管的作用,另一方面神经毒性作用。本实验结果显示,大鼠局灶性缺氧模型鼠,在大脑中动脉供血皮质区有iNOS的表达,这与任俊等[4]的研究结果一致。使用不同浓度的红花注射液后,皮质区iNOS的表达明显下调,呈浓度依赖性,当高剂量组(3.2 ml·kg-1·d-1)时,保护作用接近传统尼莫地平阳性对照组。提示红花注射液在减低iNOS的表达,存在一定的保护作用。COX-2是环氧化酶的诱生型,在正常组织内的活性较低,仅在一些细胞(例如:神经元)有低水平表达。在受到缺氧等刺激后表达上调。本实验结果显示,大鼠局灶性缺氧模型鼠,在大脑中动脉供血皮质区有COX-2 的表达,这与既往研究结果一致[5-6]。COX-2的毒性作用可能与活性氧和毒性PGS有关,通过产生大量的超氧化物或其介导引起炎症反应及炎症细胞毒性,促进血小板聚集、血栓形成,加重损伤[7-8]。在使用特异性抑制剂lumiracoxib后,能降低COX-2 依赖性的自由基毒性,从而改善中风患者预后,并对多种神经系统疾病具有一定的治疗作用。本研究显示使用不同浓度的红花注射液后,皮质区COX-2 的表达明显下调,呈浓度依赖性,当给予高剂量(3.2ml·kg-1·d-1)时,保护作用接近传统尼莫地平阳性对照组。提示红花注射液在减低COX-2在海马区的表达有一定的作用。不同浓度的红花注射液在减轻炎症反应物iNOS、COX-2显示一定的保护性,并呈浓度依赖性。但是两者在缺血性脑卒中患者的保护作用及机制,需要更深入的研究。
[1] 刘世清,吴飞,饶婷,等.单味黄芪红花丹参注射液对神经干细胞分化影响的初步研究[J].第三军医大学学报,2008,28(14):1470-1472.
[2] 林涛.红花注射液对冠心病患者冠脉血流、抗氧化能力及脂质代谢的影响[J].重庆医学,2012,41(31):3267-3269.
[3] Longa EZ,Weinsterin PR,Carlson S,et al.Reversible middle cerebral artery occusionwithout craniotomy in rsts[J].Stroke,1989,20(1):84-91.
[4] 任俊,贾正平,张汝学,等.银杏内酯对大脑中动脉阻塞大鼠脑内iNOS表达的影响[J].中成药,2004,26(12):1037-1039.
[5] 王枫涛,范生尧.局灶性脑缺血再灌注时诱导型一氧化氮合酶在大鼠脑组织的分布特点[J].四川医学,2009,3(3):306-308.
[6] 吉登波,崔景荣.β-七叶皂甙钠对与炎症相关的恶性肿瘤作用研究[J].中国肺癌杂志,2009,12(6):664.
[7] 吴会生,郭培培,尚游,等.氟比洛芬酯预处理对大鼠全脑缺血/再灌注时脑组织TXA2/PGI2 的影响[J].中国药理学通报,2009,25(9):1176-1180.
[8] Kim EJ,Raval AP,Hirsch N,et al.Ischemic preconditioning mediates cyclooxygenase-2expressionvia nuclear factor-kappa B activation in mixed cortical neuronal cultures[J].Transl Stroke Res,2010,1(1):40-47.

