载10-羟基喜树碱超声微泡的制备、表征及其体外超声成像特性
李思阳, 孔庆新, 王 洋
(1. 江苏食品药品职业技术学院,江苏淮安223003;2. 东北林业大学盐碱地生物资源环境研究中心,东北油田盐碱植被恢复与重建教育部重点实验室,黑龙江哈尔滨150040)
喜树碱 (camptothecin,CPT)是1966 年由Wall 等[1]从我国特有珙桐科植物喜树Camptotheca acuminata Decne 中分离得到的一种吲哚类生物碱[2],具有良好的抗肿瘤活性[3]。10-羟基喜树碱(10-hydroxycamptothecin,HCPT)是喜树碱的纯天然微量衍生物[2],是我国临床使用的重要抗肿瘤类药物[4],但由于不良反应大、生物利用度低限制了其应用[2]。因此,改进剂型、修饰结构、以及研究新型药物传递系统成为关注的热点[5-6]。
超声微泡也称超声造影剂,是一种含气体的高分子微泡[7],超声微泡作为载药工具有以下特点:(1)靶向作用[7];(2)药物在靶组织中可以维持较高的浓度[7-9]; (3)显著提高基因转染率[10];(4)降低机体免疫反应[7-11]。聚乳酸也称为聚丙交酯(polylactide),是一种常见的可生物降解的高分子多聚物成膜材料,具有无毒、化学稳定好、成球性好、生物相容性良好等特性[12]。PLA 载药微泡具有适用药物范围广,载药量高,表面易修饰,辅助识别功能等优点[13]。
本研究以聚乳酸为材料,以W/O/W 型乳化溶剂挥发法制备载羟基喜树碱超声微泡,以保证其在体内释放的稳定性,使其达到一种长期平稳缓释的效果,为进一步的药代动力学研究提供基础数据。
1 材料与仪器
1.1 试药 聚乳酸(PLA)(山东省医疗器械研究所);HCPT (批号081020,纯度99%,哈尔滨峰源高科技开发有限公司);其他试剂均为市售分析纯。
1.2 仪器与设备 Cary Eclipse 荧光光谱仪(美国Varian 公司);FEI QUANTA 200 扫描电子显微镜(美国FEI 公司);FD5505 真空离心浓缩系统(美国SIM 公司);KQ-50 型超声波清洗器(昆山市超声仪器有限公司);LA-920 型激光散射粒度仪(日本HORIBA 公司)。
2 方法与结果
2.1 载羟基喜树碱超声微泡的制备 称取10 mg HCPT、250 mg PLA 于10 mL 二氯甲烷中,磁力搅拌30 min 至溶液完全混匀。取出转子,加入0.5 mL 4%的(NH4)2CO3溶液,探头超声(110 W,30 s),形成初级W/O 微球。然后将得到的初级微乳缓慢滴加到预冷的25 mL 2% PVA 溶液中,使用高速分散均质机匀化(9 000 r/min,5 min),形成W/O/W微球。将上述溶液转移至50 mL 1%的异丙醇溶液中,磁力搅拌4 h,使微球表面逐渐固化,并完全去除二氯甲烷。将得到的乳液5 000 ×g 离心5 min,去上清液。沉淀加入30 mL正己烷洗涤,重复3 次,所得沉淀空气干燥,除去残留的正己烷。加3 mL 去离子水于沉淀中,涡旋,使沉淀充分分散后用液氮预冻,于-53 ℃下真空冷冻干燥48 h,将样品称定质量后密封低温避光保存。
2.2 扫描电子显微镜观察 称取3 mg 冻干粉样品于离心管中,加入适量去离子水,涡旋,使冻干粉分散均匀,取50 μL 悬浊液于铝片上,涂抹均匀,喷金后观察样品。扫描电镜图像在12.5 kV、9.5 mm工作距离的阳离子加速电压下获得。其结果见图1。

图1 载羟基喜树碱超声微泡扫描电镜图像Fig.1 SEM image of HCPT-loaded microbubbles
由图1 可以看出,载羟基喜树碱超声微泡呈明显的球状结构,表面光滑,粒径大小在2 μm 左右。有一定的聚集现象,主要是因为在样品制备的过程中,干燥、喷金等步骤会其有一定的影响,但依然保持着完好的球形结构,证明了其稳定性。此外,在真空冷冻干燥的过程中,由于碳酸铵的挥发,会形成一些表面带孔状的微球,这一结构有利于微泡在超声破碎的过程中将HCPT 释放出来。
2.3 粒径分布 粒度的大小及分布是评价超声微泡性能的重要指标,通过静态光散射的方法测定空白超声微泡和载羟基喜树碱超声微泡的粒度及分布。结果见图2。
图2 结果表明,新型微泡具有多分散性,和空白超声微泡相比,载羟基喜树碱超声微泡的粒径大小和分布没有明显变化,粒度分布比较集中,所有的微泡粒径都小于6 μm,可以达到临床使用的安全范围。粒径大小在0.45 ~5.12 μm 之间分布,这与扫描电子显微镜观察的结果相吻合。
2.4 包封率和载药量测定
2.4.1 标准曲线的绘制 称取HCPT 对照品5.0 mg,于50 mL 量瓶中,用DMSO 定容得0.1 mg/mL 的母液。将母液分别稀释至0.1、0.2、0.4、0.6、0.8 μg/mL 系列对照品溶液。通过荧光分光光度计[7]检测HCPT 的激发波长Ex和发射波长Em,确定其激发波长Ex=373 nm,发射波长Em=430 nm,在此条件下测定对照品溶液的吸光度值。以HCPT 的质量浓度为横坐标,对应的吸光度值为纵坐标,得到标准曲线方程y =1 208.1x +16.022,r2=0.998 5,结果表明HCPT 在0.1 ~0.8 μg/mL 质量浓度范围内线性关系良好。

图2 空白微泡(A)和载羟基喜树碱超声微泡(B)粒度分布Fig.2 Size distribution of freshly prepared blank microbubbles (A)and HCPT-loaded microbubbles (B)
2.4.2 包封率和载药量测定 精密称取5 mg 冻干粉样品3 份,分别加入4 mL DMSO 使其完全溶解,稀释300 倍,测定其吸光度值,根据“2.4.1”项标准曲线计算HCPT 量,并根据公式(1)和(2)计算包封率和载药量。

载羟基喜树碱超声微泡的包封率和载药量分别为(67.44 ±2.55)%、 (4.10 ±1.29)%。结果表明,这种载羟基喜树碱超声微泡具有很高的载药量,能够实现药物的有效运载,可以作为载药系统传递HCPT。
2.5 体外释药特性研究
2.5.1 HCPT-PBS 标准曲线绘制 精密称取5 mg HCPT 粉末,用DMSO 定容至50 mL,得到0.1 mg/mL HCPT 母液。母液用PBS 溶液分别稀释至0.1、0.2、0.4、0.6、0.8、1 μg/mL 系列对照品溶液。通过荧光分光光度计检测HCPT 在PBS 中的激发波长Ex=375 nm,发射波长Em=552 nm,在此条件下进行荧光分光光度分析,并绘制标准曲线。以HCPT 质量浓度为横坐标,吸光度值为纵坐标,得到标准曲线方程y = 206.54 x + 7.136 7,R2=0.999 1,表明HCPT 在0.1 ~1 μg/mL 质量浓度范围内线性关系良好。
2.5.2 体外释放 精密称取2 mg 冻干粉末样品于10 mL 离心管中,加入5 mL 去离子水,待涡旋混匀后,吸取1 mL 溶液于透析袋内密封。透析袋置于25 mL PBS (pH=7.4)释放介质中,37 ℃恒温培养箱中磁力搅拌,在0.08、0.16、0.5、1、1.5、2、2.5、3、3.5、4、5、6、8、10、12、18、24、36、48 h 时间点分别取3 mL 释放液并补充相同体积的新鲜释放液。使用荧光分光光度计测定释放液中HCPT 的吸光度值,通过“2.5.1”项标准曲线计算出释放液中HCPT 的量,计算出累积释放率。结果见图3。
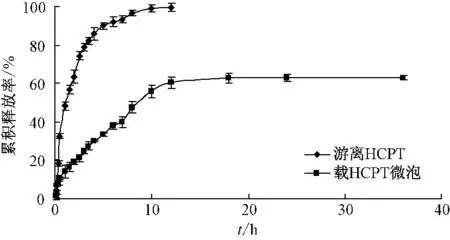
图3 载羟基喜树碱超声微泡体外释放Fig.3 In vitro release of free HCPT and HCPTloaded microbubbles
从图3 中可以看出,游离HCPT 释放较快,约4 h 累积释放率超过了80%,12 h 后基本释放完全;载羟基喜树碱微泡持续缓慢释放,48 h 后,累积释放率接近60%,且仍然继续释放。这一结果充分证实了载羟基喜树碱超声微泡具有连续的释放特性和明显的缓释效果,为下一步的体内释放试验提供一定的数据支持。
2.6 体外超声成像[14]通过体外超声显影效果来评价载羟基喜树碱超声微泡的超声成像特性。以医用级硅胶管作为血管模型,在管中分别注入载羟基喜树碱超声微泡和经脱气处理的蒸馏水,在普通B超模式和脉冲反向谐波模式(PIHI)条件下同时成像,用超声诊断仪检测和比较两者的超声效果。结果见图4。

图4 载羟基喜树碱超声微泡体外超声成像图Fig.4 In vitro ultrasound images of HCPTloaded microbubbles
从图像中可以看出,由于管壁密度较大,当推注脱气水后,在超声场里回声较高,但是管腔呈现无回声状态(图4a 和4b)。当推注载羟基喜树碱超声微泡之后(图4c 和4d),与推注之前相比,硅胶管管腔回声明显增强,呈现密集细点状强回声,说明了制备的载羟基喜树碱超声微泡具有较好的体外超声特性,可以进行临床的深入开发与应用。
3 讨论
羟基喜树碱是一种临床应用非常广泛的抗癌药物[15],已经广泛引起各国研究者的关注。但是由于其活性内酯环容易开环,往往导致其药理活性降低。针对该缺陷,众多学者纷纷通过修饰其活性内酯环的结构或改变羟基喜树碱的剂型,通过新型载药系统来传递药物,如脂质体[16]、纳米颗粒等形式[17],这些给药系统能够在一定程度上提高药物的疗效,降低其毒副作用。
本课题组研究采用的PLA 具有良好的生物降解性,是获得美国FDA 批准的可用于注射的药用辅料之一。以W/O/W 型乳化溶剂挥发法制备载羟基喜树碱超声微泡,该超声微泡粒度分布在0.45 ~5.12 μm 之间,载药量和包封率分别为(4.10 ±1.29)%和(67.44 ± 2.55)%,体外释放可持续48 h,累积释放率达到60%,具有良好的缓释效果。体外超声成像显示该微泡具有良好的反射超声信号能力,可以作为载药超声造影剂进行深入的研究和应用。此外,该研究对于载羟基喜树碱超声微泡的药代动力学研究提供一定的数据支持。
[1] Wall M E,Wani M C,Cook C E,et al. Plant antitumor agents. I. The isolation and structure of camptothecin,a novel alkaloidal leukemia and tumor inhibitor from Camptotheca acuminata[J]. J Am Chem Soc,1966,88(16):3888-3890.
[2] 李思阳,郑 健,骆沙曼,等. 10-羟基喜树碱的聚赖氨酸/海藻酸钠微胶囊的制备及其体外释药特性研究[J]. 中草药,2011,42(9):1724-1727.
[3] 杨玉焕,邵长敏,骆沙曼,等. 10-羟基喜树碱缓释微胶囊的组织分布学研究[J]. 中成药,2013,35(8):1644-1648.
[4] 郭宏红. 羟基喜树碱微胶囊药代动力学研究[D]. 哈尔滨:东北林业大学,2011.
[5] 宋文霞,索绪斌,邓妍芳,等. 羟基喜树碱/羟丙基-β-环糊精包合物凝胶骨架缓释片的制备及体外释放[J]. 中成药,2013,35(6):1188-1192.
[6] 华海婴,冯 欣,赵永星,等. 羟基喜树碱纳米晶体抗肿瘤作用及其机制评价[J]. 中成药,2010,32 (12):2048-2052.
[ 7] 李思阳. 羟基喜树碱缓释制剂的制备及其表征[D]. 哈尔滨:东北林业大学,2012.
[8] Fokong S,Theek B,Wu Z,et al. Image-guided,targeted and triggered drug delivery to tumors using polymer-based microbubbles[J]. J Control Rel,2012,163(1):75-81.
[ 9] 费小非,曹心珂,汤致强. 超声微泡造影剂在肿瘤治疗方面的研究进展[J]. 中国新药杂志,2006,15 (13):1057-1060.
[10] 何年安. 超声靶向微泡破坏促进基因转染与药物传送的实验研究[D]. 上海:复旦大学,2011.
[11] 杨 健. 载多烯紫杉醇靶向脂质微泡联合超声靶向微泡破裂技术对肝癌作用及其机制的实验研究[D]. 重庆:重庆医科大学,2012.
[12] Lucas N,Bienaime C,Belloy C,et al. Polymer biodegradation:mechanism and estimation[J]. Chemosphere,2008,73(4):429-442.
[13] Nampoothiri K M,Nair N R,John R P. An overview of the recent developments in polylactide (PLA)research[J]. Biores Technol,2010,101(22):8493-8501.
[14] 郭盛磊. 喜树碱衍生物CZ48 高分子载体系统的构建及其性能研究[D]. 哈尔滨:东北林业大学,2012.
[15] 索绪斌,李慕玲,王玉强,等. 羟基喜树碱的油/水分配系数与大鼠小肠吸收的相关研究[J]. 中成药,2010,32(4):566-569.
[16] 凌家俊,古锦辉,谢 毅,等. 羟基喜树碱磁性脂质体的制备及其靶向性特征试验[J]. 中国实验方剂学杂志,2012,18(16):19-23.
[17] 王 莹,祖元刚,赵修华. 羟基喜树碱纳米颗粒超声反溶剂法制备工艺及表征[J]. 植物研究,2012,32(3):369-372.

