人参皂苷Rg1参与诱导小鼠多潜能干细胞的研究
胡文涛,闫秋月,方瑜,邱占东,张苏明
人参皂苷Rg1参与诱导小鼠多潜能干细胞的研究
胡文涛1,闫秋月2,方瑜1,邱占东1,张苏明1
目的:观察人参皂苷Rg1对鼠胚成纤维细胞(MEF)向诱导多潜能干细胞(iPSCs)诱导转化效率的影响。方法:采用经典四因子的逆转录病毒载体感染,在细胞感染后3 d内在MEF培养基里加入人参皂苷Rg1(0、0.3、1、3、10 μg/mL),进行iPSCs诱导及鉴定。结果:人参皂苷Rg1(1 μg/mL)组可明显提高iPSCs的诱导效率,诱导效率为(0.0450±0.0019)%,人参皂苷Rg1(0 μg/mL)组为(0.0100±0.0033)%,所获iPSCs经鉴定为阳性。结论:人参皂苷Rg1可能在提高小鼠iPSCs的诱导效率方面发挥一定作用。
人参皂苷Rg1;诱导多潜能干细胞;细胞重编程;鼠胚成纤维细胞
2006 年Takahashi和Yamanaka将成年大鼠的成纤维细胞通过转入一组转录因子将成体细胞重编程为诱导多潜能干细胞(induced pluripotent stem cells,iPSCs)[1]。iPSCs具备胚胎干细胞自我更新和多向分化的特性,解决了影响胚胎干细胞应用过程中所存在的伦理学和免疫原性问题,在疾病模型、药物筛选、机制研究方面具有特定的优势,为再生医学的发展开辟了新方向。然而诱导效率低和外源基因的引入制约着iPSCs的应用,近年来在解决这两大问题方面已做过较多尝试,包括减少外源性因子的应用[2]、非整合基因方式[3]及蛋白转导途径[4]等,但诱导效率低下一直阻碍iPSCs的研究及应用。本研究通过在经典的四因子诱导体系中添加人参皂苷Rg1诱导鼠iPSCs,观察人参皂苷Rg1对小鼠多潜能干细胞诱导效率的影响。
1 材料与方法
1.1 材料
1.1.1 实验动物 孕12.5 d的昆明孕鼠,由武汉大学医学院实验动物中心提供。
1.1.2 主要试剂与仪器 质粒 pMXs-IRES-Sox2、pMXs-IRES-c-Myc、pMXs-IRES-Klf4、pMXs-IRESOct4购于美国Addgene公司;Plat-E细胞由本实验室保存;DMEM高糖培养基、DMEM/F12培养基、0.25%胰蛋白酶购于美国Hyclone公司;非必需氨基酸、胎牛血清购于美国Gibco公司;L-谷氨酰胺、青/链霉素、β-巯基乙醇购于美国Sigma公司;LIF、SSEA-1、Oct4和碱性磷酸酶(alkaline phosphatase,AP)染色试剂购于美国Millipore公司;荧光显微镜购于日本Olympus公司;Lipofectamine2000脂质体转染试剂购于美国Invitrogen公司;小提质粒提取试剂盒购于美国Omega公司;37℃CO2培养箱购于美国Thermo公司。
1.2 方法
1.2.1 鼠 胚 成 纤 维 细 胞 (mouse embryonic fibroblasts,MEF)的获取 处死昆明孕鼠,用无菌手术器械剖腹取出胎鼠,PBS冲洗,分离皮肤组织,剪碎后经0.25%胰蛋白酶消化获得单细胞悬液,接种于MEF培养基(DMEM/F12培养基、10%胎牛血清和2%青/链霉素)中,放于37℃细胞培养箱培养,待细胞长满后进行传代,冻存备用。
1.2.2 感染病毒颗粒的制备 将质粒(pMXs-IRES-Sox2、pMXs-IRES-c-Myc、pMXs-IRESKlf4、pMXs-IRES-Oct4) 分别通过 Lipofectamine 2000转染包装细胞(Plat-E细胞),48 h后收取逆转录病毒液,经0.45 μm滤膜过滤后待用,加入polybrene(终浓度4 μg/mL)。以含绿色荧光蛋白(green fluorescent protein,GFP)的逆转录病毒载体质粒作为对照。
1.2.3 iPSCs的诱导 将第1或2代MEF分为实验组和对照组,用无抗培养基(DMEM高糖溶液+10%胎牛血清)按3× 104/孔的密度分别接种到六孔板中,每组接种6个孔,当细胞融合度达约30%时每孔中加4种病毒各250 μL进行感染,感染12 h后换无抗培养基培养6 h,如此再循环2次,然后加入胚胎干细胞培养基(DMEM高糖溶液、15%胎牛血清、1%谷氨酰胺、1%非必需氨基酸、1%β-巯基乙醇、1%青/链霉素、1‰LIF)培养,感染后第1~3天每孔人参皂苷Rg1分别按0、0.3、1、3、10 μg/mL剂量添加,每天换液观察直到克隆出现。根据每孔出现的克隆数/接种细胞数计算诱导效率,实验重复3次。
1.2.4 iPSCs的鉴定 iPSCs克隆出现后用1 mL注射器挑出后在MEF制成的饲养层上扩增,在添加了LIF因子的胚胎干细胞培养基中可有效保持其未分化状态及增殖能力,为细胞提供包被有0.1%明胶的培养皿作为粘附细胞的基质,每2~3天按1∶(4~8)的比率传代细胞一次。细胞传代以后,如有分化的细胞,可将细胞接种在0.1%明胶包被的培养皿之前,通过将分化细胞黏附在没有包被的组织培养板上去除分化细胞,从而纯化iPSCs,传代后对其进行AP、Oct4及SSEA-1染色鉴定。AP鉴定根据AP染色试剂盒说明书进行,显微镜下观察。免疫荧光Oct4及SSEA-1染色用4%多聚甲醛固定;0.2%TritonX-100破膜10 min;PBS冲洗;羊血清封闭,一抗Oct4或SSEA-1(1∶200稀释)4℃孵育过夜;加1∶200稀释的FITC标记的二抗,室温孵育后DAPI染核,荧光显微镜下观察。
1.3 统计学处理
2 结果
2.1 病毒颗粒的包装
脂质体转染法转染PLAT-E细胞进行病毒包装,转染后48 h平行对照组GFP的转染效率为80%~90%,见图1。

图1 PLAT-E细胞转染后48 h光镜下形态(A)和荧光显微镜下GFP表达(B)(×100)
2.2 iPSCs的诱导效率及鉴定
感染后第20天观察到胚胎干样细胞克隆。根据每孔出现的克隆个数计算出细胞的诱导效率,分别添加人参皂苷Rg1 0、0.3、1、3、10 μg/mL的诱导效率分别为(0.0100±0.0033)%、(0.0280±0.0019)%、(0.0450±0.0019)%、(0.0240±0.0019)%、(0.0160±0.0019)%,见图2。对四因子诱导添加人参皂苷Rg1 1 μg/mL获得的iPSCs进行AP、SSEA-1、Oct4染色鉴定均呈阳性,见图3。
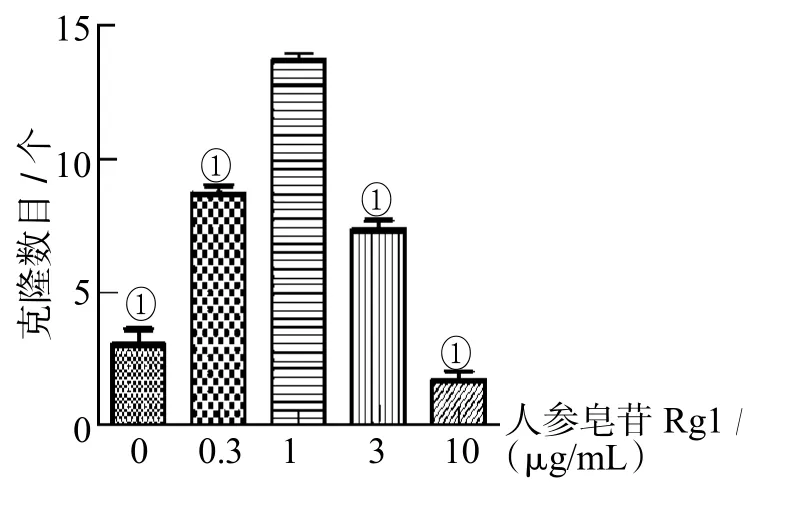
图2 不同浓度人参皂苷Rg1诱导所得iPSCs克隆数目
3 讨论
本实验在小鼠iPSCs诱导过程中添加人参皂苷Rg1,对逆转录病毒介导的iPSCs诱导系统进行优化,提高了诱导效率。Chen等[5]发现Rapamycin等抗衰老药物可以提高小鼠细胞重编程的效率,在小鼠细胞重编程的早期给予Rapamycin或mTOR信号通路的抑制剂pp242处理都能显著提高重编程的效率。同时进一步的研究发现,包括Sirtuin蛋白的激动剂Resveratrol,以及 Autophagy的激活剂Spermidine在内的多种抗衰老药物都可有效提高细胞重编程的效率。人参皂苷Rg1是人参活性成分中已提纯的单体成分,也是抗衰老药物的一种,具有Ca2+拮抗作用、抗衰老作用,改善学习记忆技能,促进DNA、RNA和蛋白质合成作用,对中枢神经有兴奋作用[6]。已有研究表明人参皂苷Rg1能促进骨髓间充质干细胞表达 c-Myc、Nanog, 且 Oct4、Klf4、Sox2 mRNA表达均有升高,Nanog阳性的iPSCs在基因表达谱上很难与胚胎干细胞区分出来[7]。此外,有研究发现Rg1能够抑制由TGF-beta1带来的NRK-52k细胞的形态改变,抑制α-SMA的表达和增加E-cadherin的表达,同时抑制P-ERK1/2的表达[8]。E-cadherin的表达增加和P-ERK1/2的表达减少均可以加速间质上皮转变,从而提高重编程效率[9]。此外,人参皂苷Rg1通过β-catenin核内聚集激活WNT/β-catenin信号途径促进成骨细胞的分化[10],而研究表明在培养液中添加Wnt3a,可激活Wnt信号传导通路,提高4因子和3因子的重编程效率,并可部分补偿c-myc的缺失[11]。本研究通过感染后分别以4种浓度添加人参皂苷Rg1,观察到1 μg/mL可明显提高iPSCs的诱导效率,但人参皂苷Rg1在诱导过程中的最佳浓度及机制仍需进一步研究。本研究首次将人参皂苷Rg1引入iPSCs诱导体系,提高了iPSCs的诱导效率,丰富了细胞重编程的发生机制,为iPSCs的研究及临床应用奠定了基础。
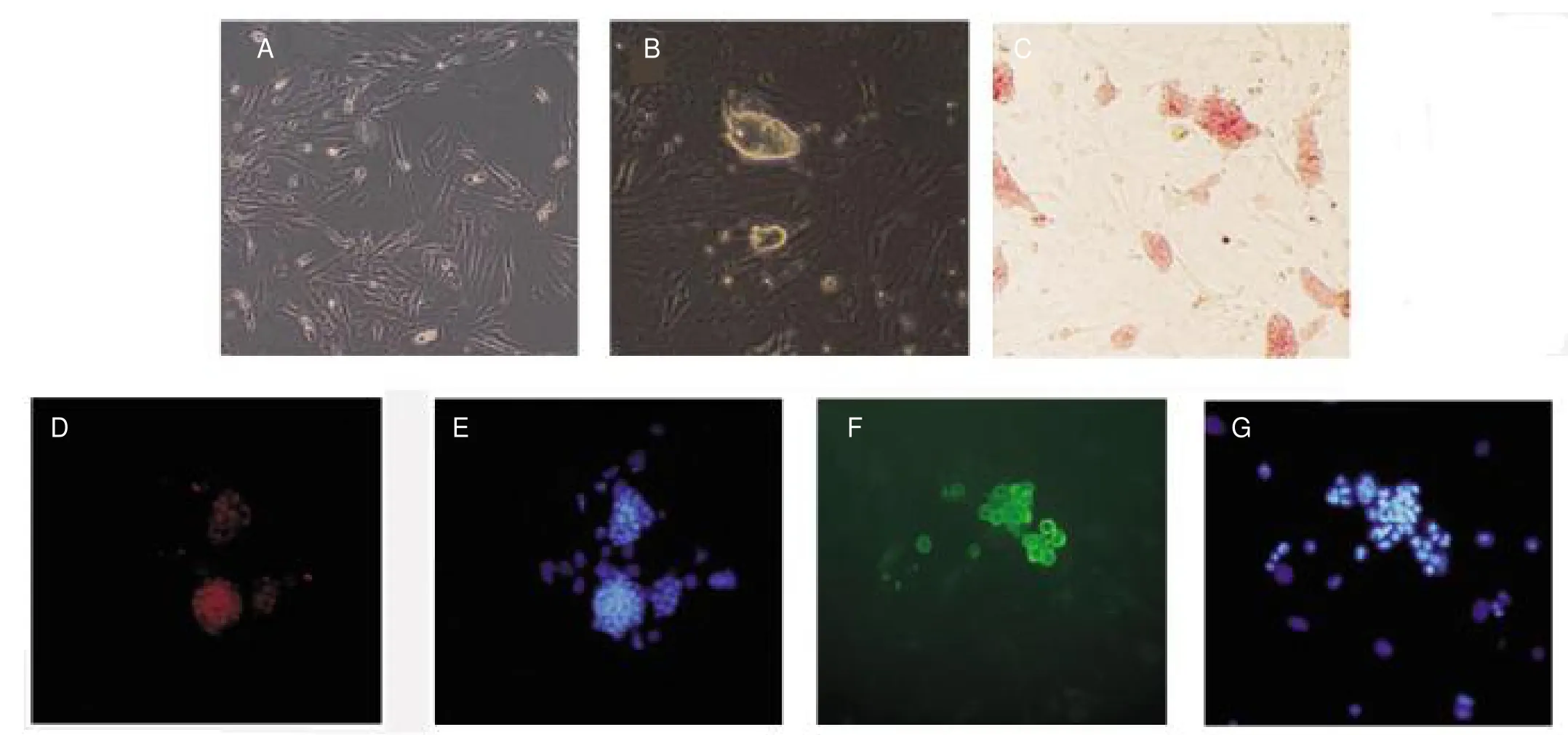
图3 实验组MEF感染前形态(A)和iPSCs形态(B),iPSCs的AP染色(C)(×100),iPSCs的Oct-4免疫荧光(×200)(D),D中细胞核DAPI染色(E),iPSCs的SSEA-1免疫荧光(×200)(F),F中细胞核DAPI染色(G)
[1]Takahashi K,Yamanaka S.Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors[J]. Cell,2006,126:663-676.
[2]Kim JB,Sebastiano V,Wu G,et al.Oct4-induced pluripotency in adult neural stem cells[J]. Cell,2009,136:411-419.
[3]Gonzalez F,Barragan Monasterio M,Tiscornia G,et al.Generation of mouse-induced pluripotent stem cells by transient expression of a single nonviral polycistronic vector[J].Proc Natl Acad Sci USA,2009,106:8918-8922.
[4]Kim D,Kim CH,Moon JI,et al.Generation ofhuman induced pluripotent stem cells by direct delivery of reprogramming proteins[J]. Cell Stem Cell,2009,4:472-476.
[5]Chen T,Shen L,Yu J,et al.Rapamycin and other longevity-promoting compounds enhance the generation of mouse induced pluripotent stem cells[J].Aging Cell,2011,10:908-911.
[6]Bahrke MS,Morgan WR.Evaluation of the ergogenic properties of ginseng:an update[J]. Sports Med,2000,29:113-133.
[7]李佳玮,张密霞,周涛,等.人参皂苷Rg1干预骨髓间充质干细胞转化为多潜能干细胞关键基因mRNA的表达[J].中国组织工程研究与临床康复,2011,15:6032-6035.
[8]Xie XS,Yang M,Liu HC,et al.Ginsenoside Rg1,a major active component isolated from Panax notoginseng,restrains tubular epithelial to myofibroblast transition in vitro[J].J Ethnopharmacol,2009,122:35-41.
[9]Lu X,Law BK,Chytil AM,et al.Activation of the Erk pathway is required for TGF-beta 1-induced EMT in vitro [J].Neoplasia,2004,6: 603-610.
[10]Tang T,Zhang G,Guo B,et al.Ginsenoside-Rg1,as an activator of WNT/β-catenin signaling,promotes human osteoblastic differentiation in vitro[J].Bone,2010,47:S385-S458.
[11]Marson A,Foreman R,Chevalier B,et al. Wnt signal promotes reprogramming of somatic cells to pluripotency cell[J].Stem cell,2008,3: 132-135.
Roles of Ginsenoside Rg1 in the Induction of Mouse Induced Pluripotent Stem Cells


Objective:To observe the effects of Ginsenoside Rg1 on the induce efficiency of mouse induced pluripotent stem cells(iPSCs)from Mouse embryonic fibroblasts(MEF).Methods:The cells were infected with classic retro-viruses vector expressing classic 4 factors,then Ginsenoside Rg1 (0、0.3、1、3、10 μg/mL)was added to the MEF medium during the first 3 days after infection.Then the clones were identified.Results:Ginsenoside Rg1(1 μg/mL)can obviously improve the induction efficiency of iPSCs[(0.0450±0.0019)%in the Ginsenoside Rg1group vs(0.0100±0.0033)%in the control group)].The clones were positive.Conclusion:Ginsenoside Rg1 may facilitate the inducing efficiency of iPS cells.
Ginsenoside Rg1;induced pluripotent stem cells;cellular reprogramming;mouse embryonic fibroblasts
R741;R741.02
A DOI 10.3870/sjsscj.2014.03.004
1.华中科技大学同济医学院附属同济医院神经内科武汉430030 2.沧州市中心医院神经内科河北 沧州061000
国家自然科学基金(No.81271407)中国博士后科学基金(No.20110490453)
2013-10-14
张苏明suming_zhang@163. com

