卵巢性索-间质肿瘤的MRI表现与病理学的关系
袁晓春 张贵祥 张在先 胡运胜
卵巢性索-间质肿瘤是起源于卵巢胚胎生殖腺的间充质细胞的一类肿瘤。临床上,该类肿瘤可发生在女性的任何年龄阶段,常伴有各类性激素分泌异常的临床症状。我们对一组经手术病理证实的病例进行多序列、多参数的分析,目的是提高术前诊断和鉴别诊断水平。
方 法
1.临床资料
本组经手术病理证实的卵巢性索-间质类肿瘤,共29例31个,27例为单侧病灶,2例为双侧病灶。年龄为26~79岁,平均59.5岁。临床表现为盆腔肿块25例,绝经后阴道出血13例,月经不规则5例。所有患者均于手术前3天~1周行MRI检查。
2.MRI检查方法及图像分析
使用GE Signa Excite Twin Speed 3.0T HDXT MR机,高分辨率心脏线圈,常规序列为横断面FSE T1WI(TR440ms,TE7ms);横断面和矢状面FSE T2WI(TR3060ms,TE140ms)。动态增强扫描采用LAVA技术,横断面和矢状面动态扫描,TR3.8ms,TE1.7ms,TI5.0ms,翻转角15。,带宽62.5kHz,NEX0.75。团注Gd-DTPA 15ml后于动脉早期15s、动脉晚期30s,实质期60s和延迟期90s共4期扫描。DWI横断面扫描(b值为0、800s/mm2。TR4225ms,TE67ms,FOV40cm×40cm,层厚5mm,间隔1mm,采集4次)。动态增强曲线、信号强度值、ADC图及ADC值的测量均于AW4.4工作站进行。影像分析。包括:①在T2WI上测量横断面肿瘤的最大径线,肿瘤有无包膜,肿瘤内囊变的程度(分为4级:I级-无囊变,II级-低于25%,III级-25%~75%,IV级-大于75%。盆腔积液。②观察T2WI、DWI上肿瘤的信号强度,与子宫肌层相对照。在LAVA序列上测量肿瘤的动态强化曲线图,最大强化比率。将ROI分别放置于肿瘤实质区与子宫肌层上,避开囊变区。最大强化比率的公式为:(SI增强后最高值-SI增强前)/SI增强前。在ADC图上,放置在肿瘤实质区及子宫肌层上,避开囊变区,选取时可参照T2WI序列。
3.统计学分析
采用SPSS19.0软件进行统计学分析,运用配对t检验分析良、恶性组肿瘤与各自子宫肌层的最大强化比率,ADC值有无差异,独立样本t检验分析两组肿瘤的最大强化比率,ADC值有无差异,以P<0.05认为有统计学意义。
结 果
1.手术病理结果
29例31个肿瘤中,良性组22个,其中纤维瘤9例11个,卵泡膜细胞瘤6个,纤维卵泡膜细胞瘤5个(图1);恶性组成年型颗粒细胞瘤6个(图2),支持-间质细胞瘤3个(图3)。肿瘤变性17个,其中良性组12个,颗粒细胞瘤3个,支持间质细胞瘤2个。29例患者中27例伴有子宫良性疾病(内膜增生15例,内膜息肉5例,腺肌症7例),1例患者伴子宫内膜癌。
2.MRI表现(表1)
31个肿瘤在MRI上阳性率为100%,术前MRI诊断准确率为77.4%(24/31)。在T2WI上与子宫肌层对照,26个呈低及混杂信号(图1A,2A),5个呈高信号。在T2WI上,31个肿瘤中含低信号包膜16个;无囊变12个,囊性变19个(II级7个,III级7个,IV级5个)。良性组囊变12个,占54.5%(12/22),恶性组囊变7个,占77.8%(7/9),总的囊变率61%(19/31)。盆腔积液9个。良性组平均最大径线为50.6mm×48.7mm;恶性组最大径线为50.9mm×61.7mm。27个肿瘤在LAVA增强曲线图上,22个呈平坦上升型曲线(图1C),5个呈快速上升型曲线(图3B)。良、恶性组肿瘤的最大强化比率均值为0.51±0.53,1.47±0.73;良、恶性组子宫肌层的最大强化比率均值为1.10±0.65,1.61±0.73。在DWI上,27个肿瘤呈等或高信号(图1D,2B),4个良性肿瘤呈低信号。良性组的ADC均值为1.33±0.26×10-3mm2/s,恶性组的ADC均值为1.21±0.24×10-3mm2/s,两组子宫肌层的ADC值分别为1.55×10-3mm2/s、1.45×10-3mm2/s。
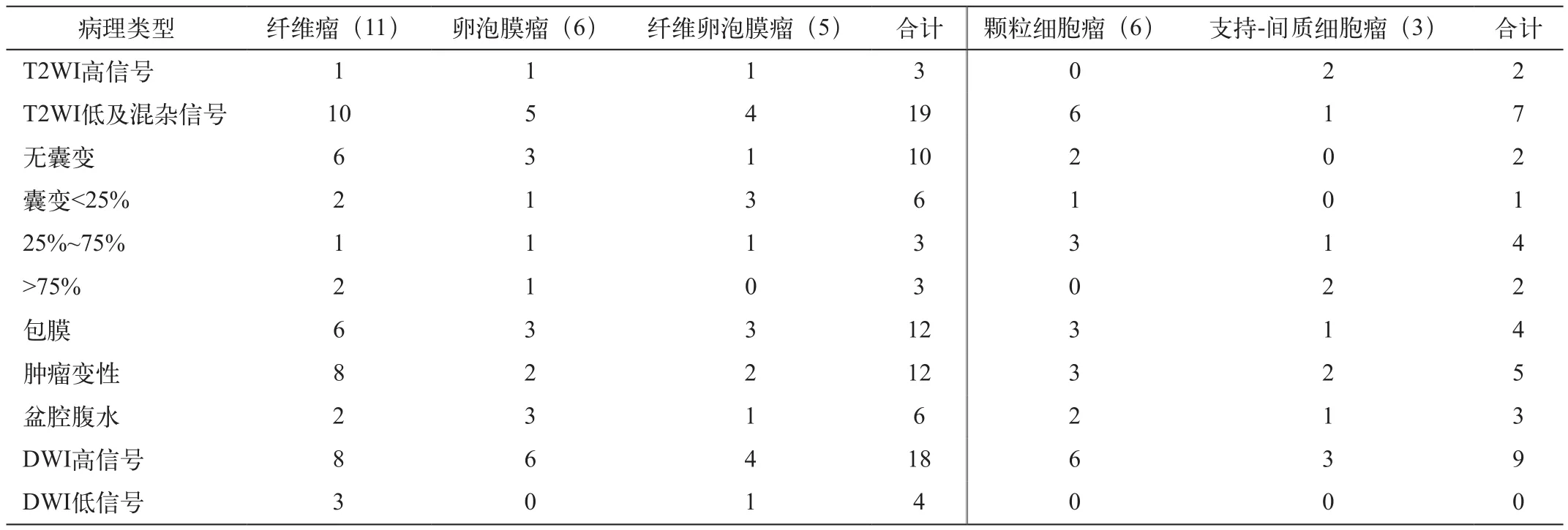
表1 卵巢性索-间质肿瘤的MRI表现及病理学特征
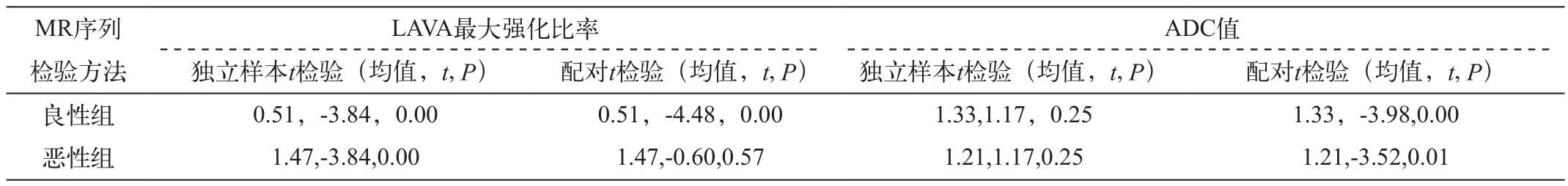
表2 27个卵巢性索-间质肿瘤LAVA最大强化比率、ADC值与子宫肌层配对t检验统计表
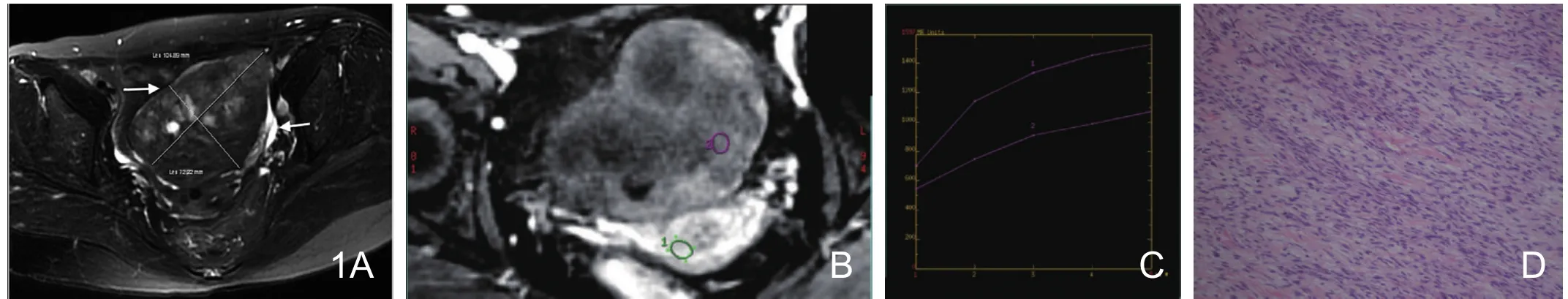
图1 女性,57岁,左侧卵巢纤维卵泡膜细胞瘤。A.横断面T2WI示盆腔内低信号为主肿瘤,中央夹杂高信号囊变区,囊变区低于肿块面积25%,肿块横断面最宽么线72.2mm×104.9mm,肿瘤低信号包膜(左白箭),边缘见高信号灶(右白箭)。B.LAVA序列示肿块轻度强化,子宫肌层强化显著。C.动态曲线呈平坦上升型曲线,无峰值。D.病理示纤维卵泡膜细胞瘤(HE×10)。
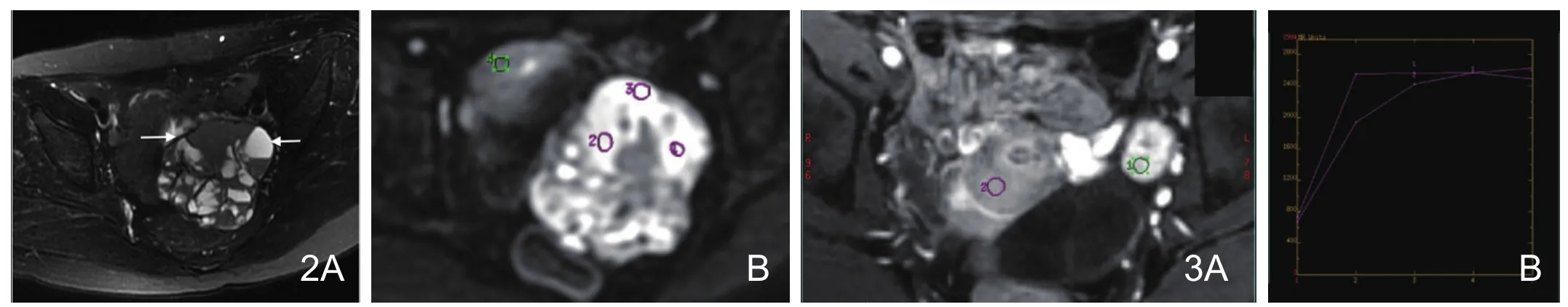
图2 女性,50岁,左卵巢成年型颗粒细胞瘤。A.T2WI,左侧卵巢高低混杂信号肿块影,呈“海绵状改变”,低信号包膜(左白箭),囊变区(右白箭)。B.DWI(b=800s/mm2)示ROI选取在子宫肌层及实性部分,实性部分呈高信号灶。图3 女性,34岁,左侧卵巢支持-间质细胞瘤。A.LAVA序列示肿块实性部分明显强化,囊变区无强化。B.动态曲线显示呈快速上升型曲线。
3.统计学结果
运用Levene方差齐性检验数据是否符合正态分布。如表2所示,t检验结果:良性组肿瘤的最大强化比率低于恶性组,低于子宫肌层,数据有统计学意义(P<0.05);恶性组的最大强化比率与子宫肌层相似(P>0.05);良、恶性组的ADC均值低于子宫肌层(P<0.05)。
讨 论
1.病理学特点
按WHO卵巢肿瘤组织学分类,性索-间质肿瘤分为颗粒细胞-间质细胞肿瘤、支持-间质细胞肿瘤等,前者又分为颗粒细胞瘤及卵泡膜-纤维组织肿瘤[1]。纤维瘤-卵泡膜细胞瘤是最常见的良性类肿瘤,根据成纤维细胞,纤维和卵泡膜细胞的成份比例分为纤维瘤、卵泡膜瘤及纤维卵泡膜瘤[2]。颗粒细胞瘤是卵巢最常见的恶性类肿瘤,但不足卵巢恶性肿瘤的5%,其特点是分泌雌激素[3-4],临床上伴有子宫内膜增生、息肉等疾病。其中成年型颗粒细胞瘤占95%,青少年型占5%,本组6例均为成年型。支持-间质细胞瘤是少见的卵巢低度恶性肿瘤,具有分泌雄激素和女性男性化的特点,因此紧密结合临床表现对诊断至关重要。
2.MRI表现与病理学基础
本组31个肿瘤在MRI上均清晰显示,阳性率为100%,术前MRI诊断准确率为77.4%(24/31)。性索-间质类肿瘤在T2WI上呈低信号是由于肿瘤内含有不同比例的纤维间质成分[3-4],本组病例中有26个为低及混杂信号,占比83.9%,5个呈高信号的肿瘤中,有2个为支持-间质细胞,囊变为IV级,术前均误诊为上皮类肿瘤,另3个为良性组含细胞丰富型肿瘤。本组病例中,良性组肿瘤囊变12个,占比54.5%,恶性组囊变7个,占比77.8%,总的囊变率61%(19/31)。Shinagare等[5]报道一组35例纤维瘤-纤维卵泡膜细胞瘤中,22例有囊变,占比63%,与本文基本一致。在T2WI上,纤维卵泡膜瘤囊变具有特征性,周边以低信号条索状影为主,中央夹杂着不规则点片状高信号影(图1)。颗粒细胞瘤的信号更混杂,囊变呈多房蜂窝状改变,称为“海绵状改变”,本组中有2例呈典型的蜂窝状囊变(图2)。肿瘤周边的低信号包膜在病理上代表被压缩的卵巢间质及纤维结缔组织,亦称假包膜;肿瘤边缘囊状高信号影代表卵泡影或水肿区[5]。本组31个肿瘤中16个出现低信号包膜(图1,2),并观察到肿瘤边缘囊状高信号(图1)。纤维瘤出现腹水,称为Meigs综合征,本组11个纤维瘤中,2个出现腹水,占比18%,Yen等[6]报道7个纤维瘤中有1个出现腹水,占比基本一致。文献报道[7],DCE MRI通过时间-信号曲线半定量分析肿瘤的ROI,对鉴别卵巢上皮性良恶性肿瘤有较高的价值。本文运用LAVA增强4期,对良,恶性肿瘤及子宫肌层进行分组配对比较,得出了良性肿瘤的强化比率低于恶性肿瘤及子宫肌层。Thomassin-Naggara等[8]对各15例卵巢纤维瘤及子宫浆膜下平滑肌瘤进行比较,显示子宫平滑肌瘤的强化高于纤维瘤的结论。文献报道[9],DWI上病灶信号的异常并不能鉴别卵巢肿瘤的良恶性,由于肿瘤内的出血、囊变、坏死、角化物等均可影响MR信号。本组在DWI序列上,22个良性肿瘤中18个呈高信号,4个实性肿瘤呈低信号影。恶性组9个均呈高信号,由于恶性肿瘤细胞排列致密,弥散受限,且肿瘤多囊变并伴有T2穿透效应所致。性索-间质类肿瘤含有纤维间质成分,其ADC值较低,良恶性难以鉴别,与本文结果相符。Nougaret等[10]认为,DWI在卵巢良恶性肿瘤的定性诊断上,需结合多种MR序列综合分析。
综上所述,卵巢性索-间质肿瘤在MRI上有特征性表现,肿瘤的病理基础表现在T2WI上呈低及混杂信号,恶性组强化较良性组显著,良、恶性肿瘤的ADC值均较低。
[1] Fattaneh A. 乳腺及女性生殖器官肿瘤病理学和遗传学. 程 虹,译.北京:人民卫生出版社,2006:138-139.
[2] 赵书全,强金伟,张国富,等. 卵巢性索-间质肿瘤的MRI诊断及病理学对照. 中国医学计算机成像杂志,2012,18:431-435.
[3] Jung SE, Rha SE, Lee JM, et al. CT and MRI findings of sex cordstromal tumor of the ovary. AJR, 2005, 185: 207-215.
[4] Jung SE, Lee JM, Rha SE, et al. CT and MR imaging of ovarian tumors with emphasis on differential diagnosis. Radiographics,2002, 22: 1305-1325.
[5] Shinagare AB, Meylaerts LJ, Laury AR, et al. MRI features of ovarian fibroma and fibrothecoma with histopathologic correlation.AJR, 2012, 198: W296-303.
[6] Yen P, Khong K, Lamba R, et al. Ovarian fibromas and fibrothecomas: sonographic correlation with computed tomography and magnetic resonance imaging: a 5-year single-institution experience. J Ultrasound Med, 2013, 32: 13-18.
[7] Thomassin-Naggara I, Daraï E, Cuenod CA, et al. Dynamic contrast-enhanced magnetic resonance imaging: a useful tool for characterizing ovarian epithelial tumors. J Magn Reson Imaging,2008, 28: 111-120.
[8] Thomassin-Naggara I, Daraï E, Nassar-Slaba J, et al. Value of dynamic enhanced magnetic resonance imaging for distinguishing between ovarian fibroma and subserous uterine leiomyoma. J Comput Assist Tomogr, 2007, 31: 236-242.
[9] Fujii S, Kakite S, Nishikara K, et al. Diagnostic accuracy of diffusion-weighted imaging in differentiating benign from malignant ovarian lesions. J Magn Reson Imaging, 2008, 28: 1149-1156.
[10] Nougaret S, Tirumani SH, Addley H, et al. Pearls and pitfalls in MRI of gynecologic malignancy with diffusion-weighted technique.AJR, 2013, 200: 261-276.

