SPE-HPLC 法分离合欢皮中抗血管新生的活性组分
蔡维维,施建军,冯 磊,杜 斌,邱丽颖,*
1江南大学药学院;2江南大学无锡医学院,无锡 214122
合欢皮为豆科植物合欢(Albizia julibrissin Durazz.)的干燥树皮,具有解郁安神、活血消肿的作用,用于心神不安,忧郁失眠,跌扑伤痛[1]。近代药理学研究发现,合欢皮还具有抗生育、抗过敏、抗肿瘤、免疫增强、镇静安神等作用[2]。研究室前期研究已发现,合欢皮的乙醇提取物-正丁醇萃取组分(简称:合欢皮正丁醇相)是合欢皮中抑制肿瘤血管新生的有效部位[3],经鉴定其活性组分群为皂苷类物质[4]。本研究拟建立SPE-HPLC 快速分离法,从合欢皮正丁醇相中分离得到抗血管新生活性高并且组成简单的有效部位,以替代传统的大孔树脂洗脱、薄层色谱分离等常规分离方法,为下一步分离得到活性单体提供合欢皮活性组分提取物。
1 仪器与材料
DIONEX Ultimate-3000 型液相色谱仪(戴安中国有限公司);R-201 型旋转蒸发器(上海申顺生物科技有限公司)。InnovationTMHLB Cartridge 固相萃取柱(60 mg,3 mL)、InnovationTMRTP Amide 制备色谱柱(21.2 mm ×250 mm,10 μm)和InnovationTMRTP Amide 色谱柱(4.6 mm ×250 mm,10 μm)均为无锡科奥美萃生物科技有限公司产品。
合欢皮产于浙江,由南京中医药大学陈健伟教授鉴定为Albizia julibrissin Durazz.的干燥树皮。MCDB 131 细胞培养基(美国Gibco BRL 公司);胰蛋白酶、小牛血清和L-谷氨酰胺(华美生物工程公司);磺酰罗丹明B(SRB)和表皮生长因子(EGF)(美国Sigma 公司);甲醇、乙腈为色谱纯,乙醇、正丁醇等均为分析纯,水为去离子水。
细胞株为SV40 病毒转染的人微血管内皮细胞(HMEC-1)传代株,由法国国家卫生医学研究院U553 研究所(INSERM U553)陆核教授馈赠,保存于液氮灌中。
2 方法与结果
2.1 合欢皮正丁醇相的制备
称取合欢皮100 g 置2 L 圆底烧瓶中,加入75%乙醇1 L 加热回流两次,每次2~2.5 h,冷却后合并提取液,过滤。旋转蒸发至干,以水复溶至400 mL,用等体积水饱和正丁醇萃取至正丁醇相无色,合并正丁醇相,旋转蒸发至干,再用水复溶,置60 ℃真空干燥箱中干燥,得黄棕色无定形粉末状合欢皮正丁醇相样品,具有吸湿性和辛辣味,干粉得率为3.92%。
2.2 固相萃取法分离合欢皮正丁醇相样品
精密称取合欢皮正丁醇相干粉20 mg,加水制成浓度为2 mg/mL 的溶液。取InnovationTMHLB Cartridge 固相萃取柱,用甲醇、超纯水活化。然后取样品溶液3 mL 进行分离,流速为1 mL/min,先用3倍体积的超纯水进行冲洗,然后再分别用3 倍体积的50%甲醇和100% 甲醇洗脱,收集洗脱液,将50%甲醇洗脱部分记为组分I,100%甲醇洗脱部分记为组分II,分别旋转蒸发至干,加水复溶,真空干燥,计算得组分I 和II 的干粉得率为40.7% 和49.25%。
2.3 RTP Amide 制备柱分离制备合欢皮有效部位
精密称取组分II 50 mg,加水定容至10 mL,得5 mg/mL 的供试品溶液,经0.45 μm 微孔滤膜过滤,备用。按以下色谱条件分离制备:色谱柱InnovationTMRTP Amide 制备色谱柱(21.2 mm ×250 mm,10 μm);流动相:乙腈(A)-水(B),梯度洗脱:0~2 min,0%(A);2~35 min,0%~25% (A);35~50 min,25%~40% (A),50~60 min,40%~100%(A);流速:10 mL/min;检测波长:210 nm;柱温:40℃;进样量:0.5 mL。在5 个不同的时间段收集样品,分别记为组分II-1~5,并计算得各组分得率分别为 15.13%、17.06%、11.63%、34.88% 和9.31%。
2.4 细胞活性评价
分别精密称取组分I、组分II 和组分II-1~5 干粉各2 mg,用MCDB131 培养基溶解,得1 mg/mL 母液,经0.22 μm 微孔滤膜过滤,备用。
将HMEC-1 细胞正常培养,至细胞消化前1 d换含2%小牛血清的培养基使之同步化。消化细胞,计数,按每孔8000 个细胞铺96 孔板,置37 ℃、5% CO2的培养箱中24 h,再加入不同浓度的各组分溶液,设阴性对照组(即不加药组),每组设4 个复孔,重复试验3 次。48 h 后取出96 孔板,弃去上清液,每孔加入100 mg/mL 三氯乙酸(TCA)200 μL后置4 ℃冰箱40 min,倒去TCA 后用水冲洗4 遍,晾干;各孔再加入4 mg/mL SRB 溶液100 μL 于37℃放置30 min,倒去SRB 溶液,再用水洗4 遍,各孔再加入10 mmol/L Tris 碱液(pH 10.5)150 μL 充分溶解,在540 nm 波长处测各孔吸光度值(D),按下式计算各组分的抑制率(inhibition rate,IR)及IC50值。

表1 不同组分对HMEC-1 细胞的抑制率(n=3,)Table 1 Inhibition rates of different components of A.julibrissin on HMEC-1 cells (n=3,)
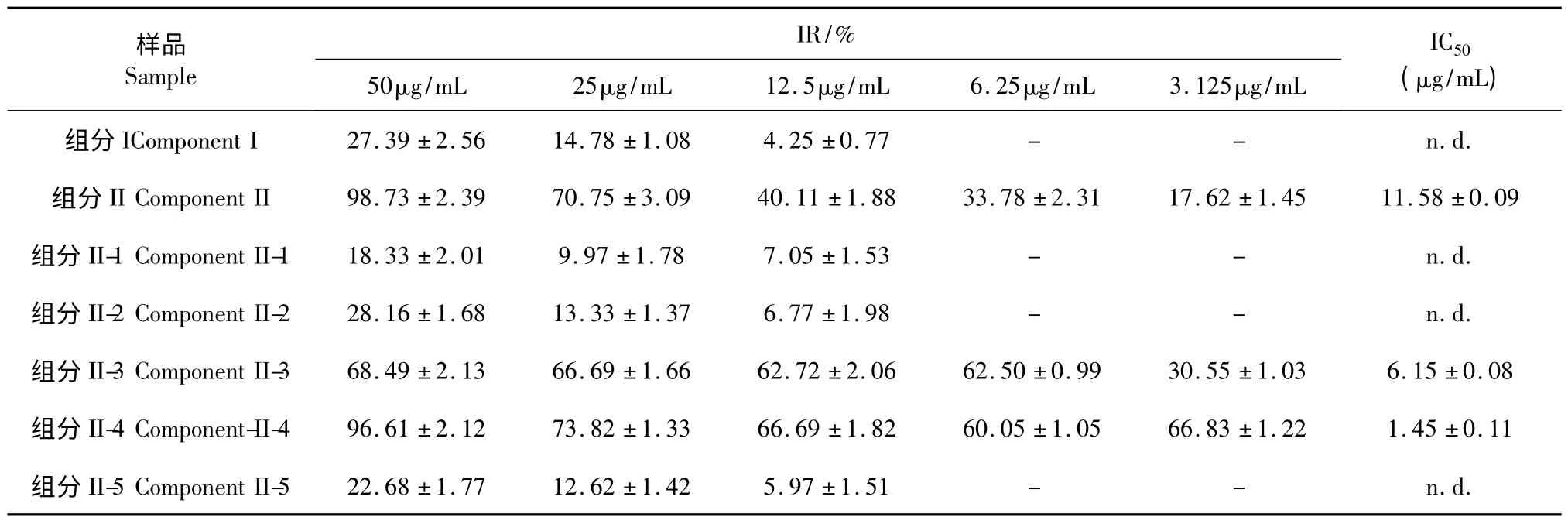
表1 不同组分对HMEC-1 细胞的抑制率(n=3,)Table 1 Inhibition rates of different components of A.julibrissin on HMEC-1 cells (n=3,)
注:“-”表示此浓度下的组分对HMEC 细胞没有抑制作用;“n.d.”表示无法确定。Note:“-”means no inhibitory effect on HMEC cells at that concentration;“n.d.”means not determined.
依据不同组分对HMEC-1 细胞的抑制作用,结果见表1。结果表明组分II 的活性比组分I 更佳,组分II 的IC50为(11.58 ±0.09)μg/mL。实验证明固相萃取法中100%甲醇溶液洗脱能有效地富集合欢皮的活性部位。因此,将组分II 作为制备色谱柱分离的原料。HMEC-1 细胞抑制实验结果也表明了组分II-1、组分II-2 和组分II-5 没有抑制细胞生长的活性,组分II-3(IC50为6.15 ±0.08 μg/mL)与组分II-4(IC50为1.45 ±0.11 μg/mL)均表现有一定的抑制作用,且组分II-4 的抑制作用更明显。
2.5 样品溶液的HPLC 分析
分别取合欢皮正丁醇相、组分I、组分II 及组分II-4 干粉各10 mg,用水溶解,定容至10 mL,得1 mg/mL 供试品溶液,0.45 μm 微孔滤膜过滤,备用。按以下色谱条件进行分析,色谱柱:InnovationTMRTP Amide 液相色谱柱(4.6 mm × 250 mm,10 μm);流动相:乙腈(A)-水(B),梯度洗脱:0~5 min,0%(A);5~35 min,0%~25%(A);35~50 min,25%~40%(A);50~60 min,40%~100%(A);流速:1.0 mL/min;检测波长:210 nm;柱温:40 ℃;进样体积:20 μL。
比较合欢皮正丁醇相、组分I、组分II 的分析色谱图(图1A、B、C),HLB 固相萃取柱能将合欢皮正丁醇相分为两部分,且组分I 为合欢皮正丁醇相的10~40 min 部分,组分II 为其40~60 min 部分。
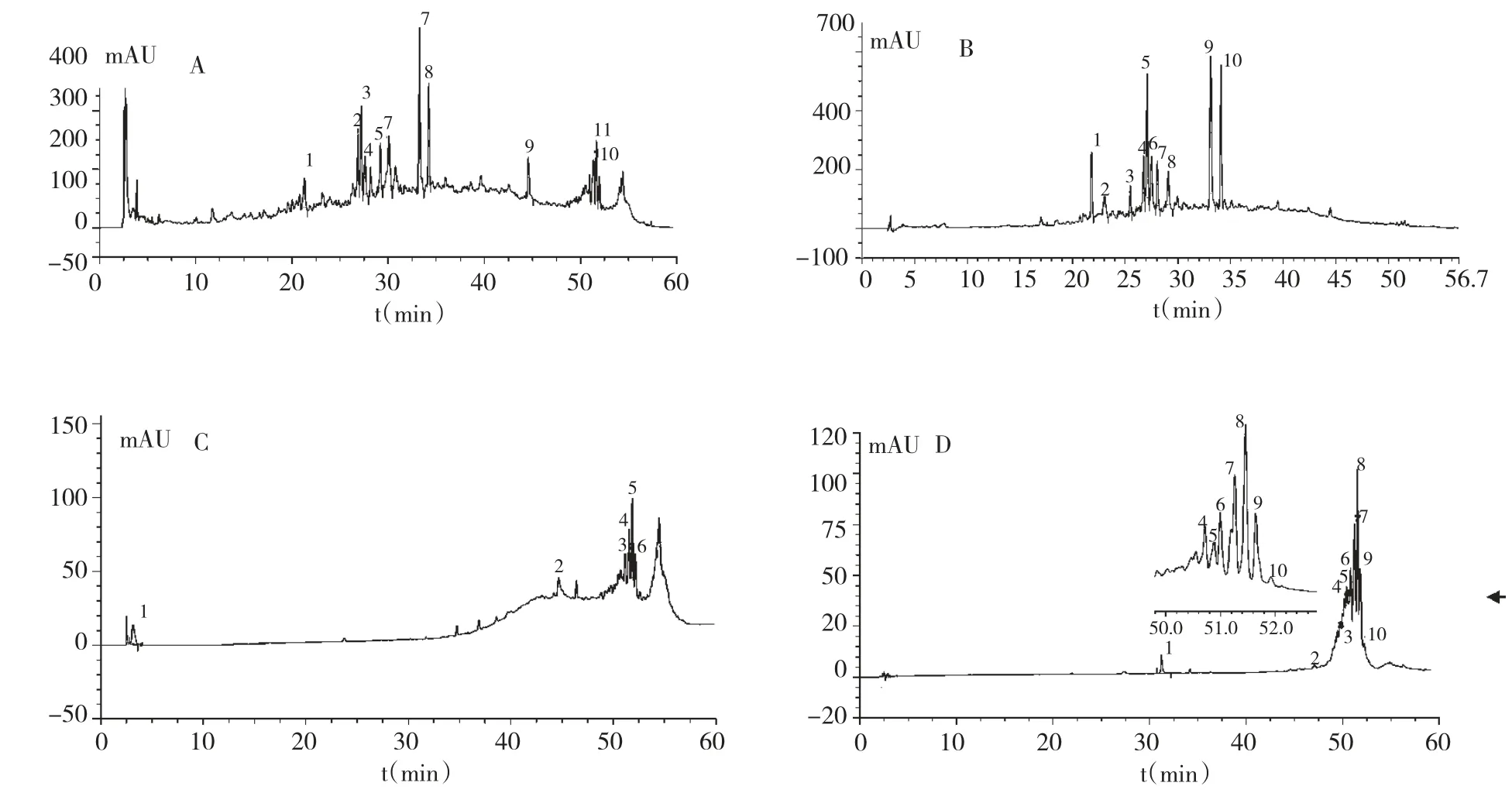
图1 各组分样品的HPLC 图谱Fig.1 HPLC chromatograms of A.julibrissin ethanol reflux-n-butanol extract (A),component I (B),component II (C)and component II-4 (D)
分析组分II-4 的HPLC 色谱图(图1D)发现,组分II-4 的组成简单,物质主要集中在50~52 min内,且峰形较好,虽然在本HPLC 分析条件下各个组分色谱峰的分离度没有达到制备分离的要求,但可以在此基础上,通过改变色谱条件,分离得到活性单体,这也为后期合欢皮质量标准的建立提供实验依据。因此本研究将组分II-4 定为抑制血管新生活性较好的最佳组分,作为后期分离单体的合欢皮活性组分提取物。
3 讨论
传统的分离技术(如大孔树脂洗脱、薄层色谱分离等)存在工作量大、耗时长等缺点,因此需要寻求一种高效快速的分离方法以替代传统的分离技术。InnovationTMHLB Cartridge 固相萃取柱是由亲脂性二乙烯苯和亲水性N-乙烯基吡咯烷酮两种单体按一定比例聚合成的超低压快速反相层析填料,它的基架为大小均一的坚硬的聚苯乙烯分子,适用于天然产物的分离纯化[5]以及环境水资源、生物样品的分析[6,7]。这种HLB 填料还可用于其他极性或非极性化合物的提取、富集和净化。InnovationTMRTP Amide 是酰胺极性嵌入式键合相,这种键合相的选择性独特,一些在C18键合相上分离困难的物质,可以在极性嵌入式键合相上获得很好的解决。它是在类似C18链长度的硅烷试剂中嵌入极性酰胺,使得键合相亲水,在100%水相条件下稳定。由于本研究中的合欢皮皂苷极性较大,实验结果证明使用HLB 固相萃取柱可以很好的分离合欢皮正丁醇相,富集得到合欢皮的有效部位。实验还发现,合欢皮正丁醇相在InnovationTMRTP Amide 液相色谱柱上的分离度较好,一些主要的有效物质峰,例如组分II-4 能够被分离开,作为下一步分离有效单体的合欢皮活性组分提取物。
1 Chinese Pharmacopoeia Commission(国家药典委员会).Pharmacopoeia of the People’s Republic of China(中华人民共和国药典).Beijing:China Medical Science Press,2010.Vol I,134.
2 Wei DH(蔚冬红),Qiao SY(乔善义),Zhao YM(赵毅民),et al.Advances in study on bark of Albizzia julibrissin.China J Chin Mater Med(中国中药杂志),2004,29:619-624.
3 Li Q(李倩),Feng L(冯磊),Shi JJ(施建军),et al.Screening of active substances of anti-angiogenesis induced by tumour cell in Albizia.Chin Tradit Pat Med(中成药),2012,34:744-747.
4 Hua H(花慧),Feng L(冯磊),Zhang XP(张小平),et al.Study on the compound isolated from Albizia julibrissin extract on proliferation of HMECs.West China J Pharm Sci(华西药学杂志),2011,26:229-231.
5 Jauffrais T,Kilcoyne J,Séchet V,et al.Production and isolation of azaspiracid-1 and -2 from Azadinium spinosum culture in pilot scale photobioreactors.Mar Drugs,2012,10:1360-1382.
6 Yin J,Yang Y,Li KJ,et al.Analysis of anticancer drugs in Sewage water by selective SPE and UPLC-ESI-MS-MS.J Chromatogr Sci,2010,48:781-789.
7 Tamura M,Takahashi A,Uyama A,et al.A method for multiple mycotoxin analysis in wines by solid phase extraction and multifunctional cartridge purification,and ultra-high-performance liquid chromatography coupled to tandem mass spec-trometry.Toxins,2012,4:476-486.

