关于他汀类药若干争议的思考——从临床药理学角度诠释
孙忠实 (海军总医院,北京 100048)
近10 年来,他汀类药已从单一的调节血脂药,发展成为一类重要的抗动脉粥样硬化的药物而广泛用于动脉粥样硬化性心血管疾病,并已载入多国的临床最新指南。此外,在高血圧、心房颤动、肿瘤、哮喘以及造影剂肾病(CIN)等治疗都显示出良好的疗效,致使他汀类药焕发青春,迈入新的里程碑,也开创了治疗冠心病的新纪元。但必须强调,上述多种心脑血管疾病的获益主要是建立在他汀类高强度或强化给药(即早期、高剂量、长期)的基础之上。为此,临床必须把握他汀类药的获益/风险比!
2013 年11 月12 日发布了在美国国立心肺血液研究所(NHLBI)指导下,由美国心脏学会/美国心脏病学学会(ACC/AHA)联合制定的《2013 ACC/AHA 降低成人动脉粥样硬化性心血管风险胆固醇治疗指南》(以下简称“新指南”)[1],是继2001 年发布的ATP-Ⅲ指南以来的、世界各国心血管疾病医师、13 年的科学智慧与研究实践的总结,其指导思想异常明确:直指动脉粥样硬化这个靶心,而射向这个靶心的利箭就是唯一具有抗动脉粥样硬化作用的他汀类药!“新指南”来自实践,经过提炼、升华后又指导实践,这是一次质的飞跃。“新指南”以崭新的面貌公布于众,其最大亮点就是摒弃了临床采用近30 年的、以降低低密度脂蛋白胆固醇(LDL-C)为终点目标值,而代之以减少动脉粥样硬化心血管疾病(atherosclerotic cardiovascular disease,ASCVD)的风险事件为目标值。这个巨大转变表明,“新指南”既充分肯定了他汀类药降低胆固醇的重要性,也肯定了他汀类药不可或缺的多效性的作用。毫无疑问,随着“新指南”的借鉴或实施,他汀类药的使用将越来越广,但迄今围绕他汀类药还有一些认识问题值得商榷,是非要明,谬误要清,否则真会影响到把控心血管疾病防治的大方向和全局。
1 他汀类药的疗效与安全性是“类效应”吗?
当代药物治疗史,从正、反两方面的教训都告诉我们,欲做到合理用药就必须从掌握同类药物的共性入手,同时更要熟悉每个药物的个性以实践个体化给药——选用适当的药物。他汀类药也不例外,不论从其发展史,还是从近期大样本的循证报告,都清晰地看到它们之间既有许多共性,即类效应;但更多、更重要的是每种他汀类药的个性,即异质性。
迄今研发上市的他汀类药共有8 个:洛伐他汀(美降之,LOV)、辛伐他汀(舒降之,SIV)、普伐他汀(普拉固、美百乐镇,PRV)、氟伐他汀(来适可,FLV)、西立伐他汀(拜斯亭,CEV)、阿托伐他汀(立普妥,ATV)、瑞舒代他汀(可定,RSV)以及匹伐他汀(Pitavastatin、Livalo,力清之,PIV)。众所周知,从药物构效原理分析,8 个他汀类药因具有相同的功能团——羟基戊二酸(hydroxyglutaric acid),必然具有类效应(共性),如均可竞争性抑制胆固醇的合成;均有调血脂外的多效性;均有肝、肾、肌肉不良反应;均可轻度升高血糖和轻度影响智力等。但因具有不同的取代基,故每个他汀类药又具有独特的异质性(个性):如药效学的强度(降脂效价)、药动学的参数、适应证、肌肾毒性的大小、相互作用的多少以及药物基因组学(PGx)的影响等均不相同。异质性最集中的体现就是药物的适应证,如美国食品药品管理局(FDA)批准7 种他汀类药的适应证就各不相同(见表1,“√”表示可用于相应疾病的治疗)[2]。2007 年3 月8日FDA 又一次批准ATV 的5 个新增适应证:非致死性心脏病发作、致死性与非致死性卒中、住院心力衰竭患者、某些心脏手术以及心脏病的胸痛。此外,2010 年6 月29 日,国家食品药品监督管理局(SFDA)亦批准了ATV 直接治疗冠心病的新适应证。故决不能将类效应与异质性混为一谈,更不能用类效应掩盖异质性。
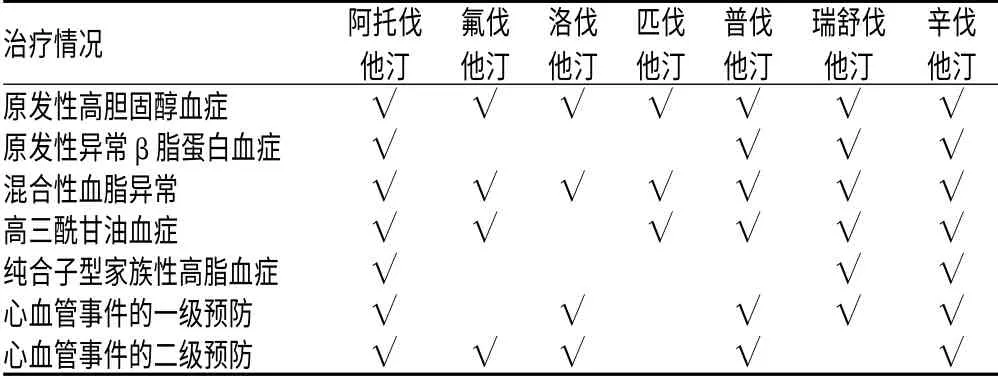
表1 FDA 批准的7 种他汀类药适应证比较
异质性的最典型药例,就是具有最大脂溶性和最强降低LDL-C 作用的CEV,在上市不久的1997 年11 月—2000 年3 月的短短2.4 年里,世界卫生组织(WHO)不良反应监测中心报告,全球共引发横纹肌溶解症549 例[3];FDA 报告由CEV 致横纹肌溶解症死亡者共192 例[4],终在上市后仅4 年的2001 年8月因严重肌肉安全性问题被拜尔公司自动撤市。这个事件给予临床以深刻的警示和教训,即他汀类药决不是一样的,更不能动则宣传所谓“超级他汀”,要摒弃“降脂作用越强就是越好的他汀类药”的片面认识。这个沉重的代价引发了人们对强效降脂安全性的思考,即一个优秀的他汀类药并非降低胆固醇越多越好。如RSV 降低LDL-C 的能力比ATV 约强1 倍,但FDA 药物评价中心(CDER)主任Galson SK 在给美国大众维权协会主席Wolfe SM 诉求FDA 立即将RSV 撤出市场的回信中指出,RSV 致横纹肌溶解症的发生率是ATV 的5 倍,即RSV∶ATV 为0.3/10 万处方∶0.06/10 万处方[5]。又如2012 年,美国加州Hoffman 教授等发表的一个谓之“真实世界”的(realworld AEs reporting)他汀类药肌肉安全性的专题报告[5],报告的“真实”是源自作者对2005 年7 月1 日—2011 年3 月31 日每种他汀类药的处方量作了统计,将引发的肌肉事件报告数除以该时间段各个他汀类药的处方总量,即可得知不良事件的真实发生率。结果显示,RSV 的肌肉风险(肌病、肌痛、肌炎)与横纹肌溶解症的风险均显著高于其他他汀类药。由此,作者结论认为,他汀类药的相对肌肉风险大约与其每1 mg 降低LDLC 的能力成正相关(relative risk of muscle-related AEs,therefore,approximately tracked with per milligram LDL-lowering potency),完全印证了过往的临床共识:效价越强的他汀类药可能具有更大的肌肉不良事件发生率(highest potency statins showed higher muscle adverse event rates)。大量循证与病例充分表明,包括他汀类药在内的所有药物的有效性与安全性均非类效应。
2 他汀类药究竟有无多效性?
此问题争论已久。刚刚发布的“新指南”作了最好的回答:强调高强度他汀类药用于ASCVD 四类人群的获益,就是源于唯一具有抗动脉粥样硬化作用的、他汀类药的多效性。美国著名血脂管理专家Libby 教授近期于2013 年5 月在《新英格兰医学杂志》再次撰文——《ACS 的机制及其对治疗的影响》[6],不仅详细阐明了ACS 的病理机制,也总结了他汀类药对动脉粥样硬化斑块良好作用的机制,包括:(1)抗炎作用(降低巨噬细胞、细胞因子以及趋化因子水平,减少白细胞黏附分子的表达;(2)减少间质胶原酶(MMP-1)的表达;(3)增加间质胶原水平;(4)降低ox-LDL-C 水平;(5)减少活性氧的产生;(6)增加内皮细胞NO 合酶水平;(7)抗血栓(减少组织因子含量与活性);(8)增加纤溶能力(减少纤溶酶原激活物抑制剂-1),所有这些作用均为他汀类药的调脂外作用,即多效性。
2013 年8 月发表的1 篇由几位英国、美国、荷兰著名学者对他汀类药的有效性所做的网络荟萃分析(network meta-analysis)报告[7],入选92 项安慰剂对照和阳性药物对照研究,共199 721 例患者;采用配对分析(pairwise )和网络荟萃分析(network meta-analyses)方法,分析在可比剂量的不同他汀类药(ATV、SIV、FLV、PRV、LOV、RSV)对主要终点:主要冠脉事件(MACE)和全因死亡(ACM)的比较。结果,他汀类药与对照组相比,显著降低人群一级和二级预防的MACE 和ACM,但6 种他汀类药中以ATV 疗效最佳。最令人感到意外的是阿托伐他汀在常规剂量和强化剂量时,可使主要终点事件发生率分别降低76%和80%,而降低LDL-C 最强的瑞舒伐他汀仅分别降低31%和27%!原因何在?作者在总结时指出:他汀类药降低MACE 和ACM 能力的差异,无法用降低LDL-C 能力的差异来充分解释。事实上许多循证证明,当2 种他汀类药降低LDL-C水平相同时,而ACM 和MACE 的降低却相差甚远,根本原因就是2 药的多效性不同所致。
关于他汀类药确有多效性的最佳反证,是2013 年4 月9日发表的1 篇《冠脉干预后的氧化应激与病理变化》重要文章[8],它由来自不同国家和地区的5 位专家所撰写,文章明确指出氧化应激是各种心血管疾病的重要发病机制。冠脉干预包括球囊血管成形术和冠状动脉支架植入术,均伴发血管内氧自由基(ROS)水平的显著增加,并改变内皮细胞与平滑肌细胞的功能,从而导致支架周围区域的再狭窄、血栓或内皮功能紊乱,认识ROS 在冠脉干预期或干预后,或两者同在时的病理生理作用,对于改善手术的成功率是至关重要的。他汀类药的多效性尤其是抗氧化作用可改善上述不同的病理过程,其主要机制是通过抑制法尼基焦磷酸(FPP)的成员之一p21 RAC 的异戊二烯化而显著减少超氧阴离子的形成[8-9];同时,还可上调血管内皮细胞的内皮型一氧化氮合酶(eNOS)的表达,增加NO的供给而减少心肌和血管内皮细胞的损伤[8]。
3 关于水溶性他汀类药与脂溶性他汀类药的利弊之争
不少人认为水溶性他汀类药较脂溶性他汀类药更为安全,因为它在非肝组织如肌肉等的分布很少。显然这是形而上学的认识,照此理论根本无法解释水溶性他汀类药是如何分布肝脏发挥降脂作用的。
首先,所谓水溶性他汀类药与脂溶性他汀类药,是由它们的油水分配系数或辛醇/水分配系数(octanol/water partition coefficients)所决定(见表2)[10]。Log D 表示在生理条件(pH =7.4)药物在血清中的分配系数(distribution coefficient)。他汀类药的油水分配系数与其吸收、分布、代谢、以及排泄强烈相关。无论亲水性他汀类药还是亲脂性他汀类药均有利有弊,而理想的分配系数应是中性,即不太疏水性也不太亲水性(not too hydrophobic nor too hydrophilic),也就是通常所谓的水脂兼溶的他汀类药利大于弊。

表2 6 种他汀类药的油水分配系数
由表2 可知,CEV 亲脂性最强,SIV、FLV 次之,RSV、LOV则为亲水性他汀类药,而ATV 介于二者之间,即为水脂兼溶的他汀类药。Serajuddin ATH 等测定了6 种他汀类药在不同pH值的辛醇/水分配系数[11],结果,在pH=7.4 条件下,它们的相对脂溶性分别是PRV 为1.0(水溶性他汀类药)、LOV 为71、FLV 为76、ATV 为105、SIV 为310、CEV 为219,也证实ATV 为水脂兼溶的他汀类药。此外,因ATV 的分子结构更符合李宾斯基关于影响药物吸收“5”的原则[Lipinski’s“rule of 5”(Ro5)][12],因此,该药吸收最快,Cmax平均为1.5 h,可大量跨膜渗入血管平滑肌的上皮细胞发挥多效性。
事实上,药理学早已证明,亲脂性对于他汀类药的肝选择性十分重要,而更高亲脂性的则可更多的分布于非肝组织如肌肉等(包括与受体结合力强、作用持续久、风险更大等);亲水性他汀类药也有很高的肝选择性,否则就无降脂作用。两类他汀类药分布方式的区别在于亲脂性他汀类药是通过被动转运和非选择性扩散进入肝细胞和非肝组织;而亲水性他汀类药则更多的是依靠主动转运进入到肝脏与非肝组织如肌肉等。如典型水溶性他汀类药RSV 的主动转运是依靠位于肝细胞基底外侧膜(又称窦状隙膜)上的转运体所介导,包括由基因[solute carrier organic ion transporter(SLCO)system]的SLCO1B1、SLCO1A2 碥码的有机阴离子转运蛋白(organic anion transporting polypeptide,OATP)OATP1B1 (SLCO1B1 * 5)、OATP-A、OATP1A2 等转运蛋白;基因SLCO1B3 碥码的OATP1B3、OATP8 等转运蛋白,以及基因SLCO2B1 碥码的OATP2B1;OATP-B 等转运蛋白[13]。利福平、环孢素、吉非贝齐以及大环内酯抗菌药物等均是SLCO1B1 和SLCO1B3 的抑制剂,由此可知,RSV 并非没有药物相互作用,只不过它是发生在转运体而非代谢药酶。此外,研究发现我国患者服用RSV 后,还可受到乳腺癌耐药蛋白(breast cancer resistance protein,BCRP)介导胆汁外排的显著影响[14]。可见,RSV 在肝脏的摄入与外排均可受到PGx 的变化。为什么“新指南”明确强调只适用于白人和黑人,就是因为某些他汀类药的有效性和安全性具有种族差异,尤其是对我国患者高强度给予RSV 时更应小心谨慎!
[1] Stone NJ,Robinson J,Lichtenstein AH,et al.2013 ACC/AHA Guideline on the Treatment of Blood Cholesterol to Reduce Atherosclerotic Cardiovascular Risk inAdults:A Report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines[J].Circulation,2013.
[2] Lemke TL.Foye’s Principles of Medicinal Chemistry[M].7th.Wolters Kluwer,2012.
[3] WHO international drug monitoring:cerivastatin and gemfibrozil[J].WHO Drug Information,2002,16(1):8.
[4] Omar MA,Wilson JP.FDA adverse event reports on dtatin-associated rhabdomyolysis[J].Ann Pharmacother,2002,36(2):288-295.
[5] Hoffman KB,Kraus C,Dimbil M,et al.A survey of the FDA’s AERS database regarding muscle and tendon adverse events linked to the statin drug class[J].PLoS One,2012,7(8):e42866.
[6] Libby P.Mechanisms of acute coronary syndromes and their implications for therapy[J].N Engl J Med,2013,368(21):2004-2013.
[7] Naci H,Brugts JJ,Fleurence R,et al.Comparative benefits of statins in the primary and secondary prevention of major coronary events and all-cause mortality:a network meta-analysis of placebo-controlled and active-comparator trials[J].Eur J Prev Cardiol,2013,20(4):641-657.
[8] Juni,RP,Duckers HJ,Vanhoutte PM,et al.Oxidative stress and pathological changes after coronary artery interventions[J].J Am Coll Cardiol,2013,61(14):1471-1481.
[9] Wagner AH,Köhler T,Rückschloss U,et al.Improvement of nitric oxide-dependent vasodilatation by HMG-CoA reductase inhibitors through attenuation of endothelial superoxide anion formation[J].Arterioscler Thromb Vasc Biol,2000,20(1):61-69.
[10] White CM.A review of the pharmacologic and pharmacokinetic aspects of rosuvastatin[J].J Clin Pharmacol,2002,42(9):963-970.
[11] Serajuddin AT,Ranadive SA,Mahoney EM.Relative lipophilicities,solubilities,and structure-pharmacological considerations of 3-hydroxy-3-methylglutaryl-coenzyme A(HMG-CoA)reductase inhibitors pravastatin,lovastatin,mevastatin,and simvastatin[J].J Pharm Sci,1991,80(9):830-834.
[12] Lipinski CA,Lombardo F,Dominy BW,et al.Experimental and computational approaches to estimate solubility and permeability in drug discovery and development settings[J].Adv Drug Deliv Rev,2001,46(1-3):3-26.
[13] Dobson PD,Kell DB.Carrier-mediated cellular uptake of pharmaceutical drugs:an exception or the rule?[J].Nat Rev Drug Dis,2008,7(3):205-220.
[14] Zhang W,Yu BN,He YJ.et al.Role of BCRP 421C >A polymorphism on rosuvastatin pharmacokinetics in healthy Chinese males[J].Clin Chim Acta,2006,373(1-2):99-103.

