贝伐单抗在中晚期肿瘤治疗中的疗效与安全性评价Δ
肖 婧,杨薏帆,车娟娟,俞 静(首都医科大学附属北京友谊医院肿瘤科,北京 100050)
据统计,2008 年新增的肿瘤患者达1 270 万,新增的肿瘤死亡例数已达760万,其中发展中国家所占的比例分别为56%、63%[1]。所以,肿瘤的治疗尤其是药物治疗越来越受到重视。目前抗肿瘤的药物主要有:细胞毒类药物、激素类、生物反应调节剂、单克隆抗体以及其他种类的药物等[2]。贝伐单抗作为单克隆抗体中的一种,是针对血管内皮生长因子(VEGF)的靶向药物,近年来其与化疗药物联合被广泛用于结直肠癌、非小细胞肺癌、乳腺癌以及子宫内膜癌的治疗[3]。多项临床研究报道指出,在不同部位肿瘤的化疗过程中,加用贝伐单抗或可以提高患者治疗的有效率并且延长患者总生存期及无进展生存期。然而,肿瘤患者在应用贝伐单抗后会出现不同程度的不良反应,如胃肠道穿孔、出血、高血压、蛋白尿、血管栓塞等[4]。因此,关于贝伐单抗对肿瘤的治疗仍需进一步的研究。本文对贝伐单抗联合化疗药物治疗中晚期肿瘤的疗效以及安全性进行了评价。
1 资料与方法
1.1 资料来源
纳入2011 年11 月至2014 年5 月在北京友谊医院肿瘤科按照标准剂量及给药方法接受贝伐单抗联合化疗药物治疗的中晚期患者34 例,包括已经停止和正在使用贝伐单抗的病例。其中男性15例(44.1%),女性19例(55.9%);年龄22~80岁,中位年龄55 岁,≥50 岁者24 例(70.6%),<50 岁者10 例(29.4%)。非小细胞肺癌12 例(35.3%),结直肠癌9 例(26.5%),子宫内膜癌4 例(11.8%),乳腺癌3 例(8.8%),卵巢癌3例(8.8%),胃癌1例(2.9%),胆囊癌1例(2.9%),膀胱癌1例(2.9%)。18 例初次使用的化疗药物就是贝伐单抗。有18例患者可随访(52.9%);有10例患者已经死亡(29.4%),其中1例死于脑栓塞;有6例患者因严重的不良反应或经济原因终止使用贝伐单抗治疗,有4例患者正在接受贝伐单抗联合化疗药物的治疗。6例患者失访(17.6%)。治疗前患者的肝肾功能、血常规及尿常规均基本正常。
1.2 评价方法
化疗评价的标准根据实体瘤疗效评价标准(RECIST)分为完全缓解(CR)、部分缓解(PR)、稳定(SD)和进展(PD)[5]。治疗的总有效率以CR+PR计算,疾病控制率以SD+CR+PR计算。按照美国国立癌症研究所通用毒性(NCI)标准,分别对患者白细胞减少、中性粒细胞减少、血小板减少、肝功能异常以及恶心、呕吐的情况进行了评估。另外,根据贝伐单抗常见的不良反应,就患者出现蛋白尿、鼻衄、尿血以及出现血管栓塞的情况进行了评估。
1.3 统计学方法
应用Excel 2003 软件,分别按照患者姓名、病种、性别、年龄、是否为此次接受贝伐单抗治疗、治疗开始以及结束的时间、接受治疗的周期数、治疗后效果如何、治疗过程中出现的不良反应以及是否失访或死亡等进行数据统计。应用SPSS 18.0软件进行χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 疗效评估
对化疗2个周期以上的中晚期肿瘤患者(除外正在接受贝伐单抗以及无法进行评估的患者)使用贝伐单抗后的疾病进展情况进行了评估。在19 例患者中,无CR 者,SD 8 例(42.1%),PR 2 例(10.5%),PD 9 例(47.4%),总有效率为10.5%,疾病控制率为52.6%。在SD 的患者中,肺癌4 例(50%),卵巢癌、子宫内膜癌、结肠癌及乳腺癌各1 例(12.5%);在PD 的患者中,胃癌3 例(33.3%),结直肠癌3 例(33.3%),子宫内膜癌、乳腺癌及肺癌各1例(11.1%);在PR的患者中,结肠癌及肺癌各1例(50%)。疗效评价结果见表1。
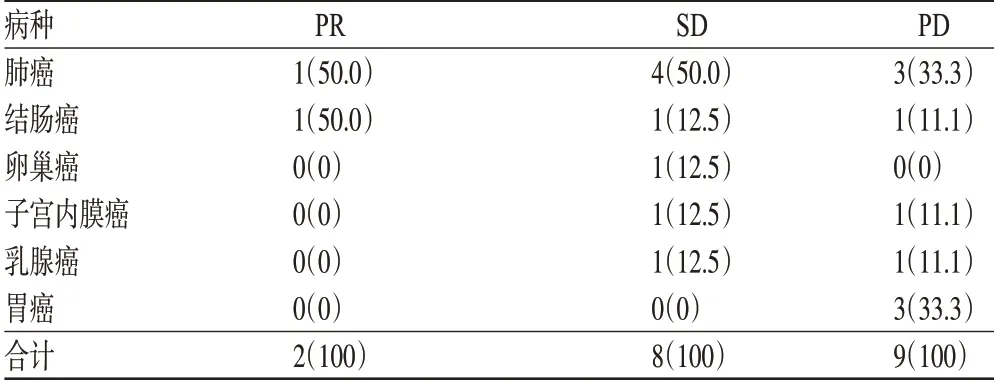
表1 贝伐单抗联合化疗药物的疗效评价[例(%)]
对于接受贝伐单抗治疗后SD+PR的患者以及PD的患者的年龄分布情况进行了分析,其中有3组患者的中位年龄在55岁以上,结果见图1。

图1 使用贝伐单抗的患者年龄情况比较
2.2 安全性评估
在接受贝伐单抗联合化疗药物治疗的34 例患者中,有25例患者出现不同程度的骨髓抑制:白细胞减少发生25 例(73.5%),其中Ⅰ度11例,Ⅱ度12例,Ⅲ度3例;粒细胞减少发生18 例(52.9%);血小板减少发生4 例(16.0%),其中Ⅰ度1例,Ⅱ度2 例,Ⅳ度1 例。有9 例患者出现转氨酶升高(26.4%),均为Ⅰ度。有8 例发生恶心(32.0%),5 例发生呕吐(20.0%)。在本研究中所纳入的病例中,发生与贝伐单抗毒性相关性较大的不良反应有尿蛋白阳性、鼻衄、尿血以及血管栓塞,分别为3 例(8.8%)、3 例(12.0%)、1 例(2.9%)、2 例(6.9%)。
另外,根据中位年龄(55岁)将患者分组,对两组患者出现白细胞减少、粒细胞减少、血小板减少、转氨酶升高以及恶心、呕吐的情况进行比较分析,差异均无统计学意义(P>0.05)。不同年龄患者不良反应发生率比较见图2。

图2 不同年龄患者不良反应发生率比较
3 讨论
分子靶向治疗是针对不同的靶点,在发挥抗肿瘤作用的同时,减少对于正常组织的损伤[6]。根据药物靶点的不同,主要将分子靶向药物分为:小分子表皮生长因子受体(EGFR)酪氨酸激酶抑制剂、抗EGFR 的单抗、抗人表皮生长因子受体2(HER2)的单抗、VEGF 受体抑制剂等[7]。贝伐单抗属于VEGF 受体抑制剂的一种,其作为针对VEGF 的人源化单克隆抗体,可与VEGF 靶向结合,从而阻碍VEGF 与其受体的相互作用[8]。
目前有很多研究对于贝伐单抗联合化疗药物治疗肿瘤的疗效进了评估。Hurwitz H 等[9]的一项大样本临床研究显示,贝伐单抗联合伊立替康的治疗可以延长直肠癌患者的生存期。在一项名为AVAil[10]的研究中,研究者对贝伐单抗联合吉西他滨及顺铂治疗晚期非小细胞肺癌的疗效进行了比较,结果显示,加用贝伐单抗可以延长患者的无进展生存期。在另外一项针对乳腺癌的名为AVEREL[11]的Ⅲ期临床试验中证实,贝伐单抗联合多西紫杉醇及曲多珠单抗的治疗并没有显著地延长HER-2阳性乳腺癌患者的无进展生存期。本研究对贝伐单抗联合化疗药物治疗中晚期肿瘤的疗效进行了评估,纳入的病例中无患者达到CR,总有效率为10.5%,疾病控制率为52.6%。在对贝伐单抗疗效进行评估的过程中,并未发现其与年龄有着显著的关联。
贝伐单抗常见的不良反应为蛋白尿、出血、血栓栓塞、胃肠穿孔等不良反应[12]。Raez LE 等[13]报道了贝伐单抗联合多西紫杉醇及奥沙利铂治疗非小细胞肺癌时出现的不良反应,研究中患者出现了不同程度的粒细胞减少、腹泻及疲乏等。本研究对于患者在化疗中出现的不良事件进行了统计,患者的不良反应较轻,在接受化疗的34例患者中,出现的与贝伐单抗毒性相关性比较大的不良反应有尿蛋白阳性、鼻衄、尿血以及血管栓塞,分别有3、3、1、2 例。另外,一部分患者出现了化疗相关的毒性反应例如白细胞减少、粒细胞减少、血小板减少及转氨酶升高,但大多数患者的毒性反应按照NCI 的标准评价均为Ⅰ~Ⅱ度。本研究还根据患者的年龄对患者进行分组,比较两组出现白细胞减少、粒细胞减少、血小板减少、转氨酶升高以及恶心、呕吐的情况,未发现年龄对不良反应发生有显著影响。
综上所述,贝伐单抗联合化疗药物治疗不同部位的中晚期肿瘤有一定疗效,但是患者用药后出现的毒性反应仍然是不可避免的。本研究存在着一定的局限性,研究所纳入的样本量比较小,尚不能作为指导临床用药的依据。还需要更加完善、大型以及多中心的临床试验,来确证贝伐单抗在肿瘤治疗中的疗效,同时进一步规范贝伐单抗用法、用量,使贝伐单抗在安全的基础上发挥最大的效能。
[1] Jacques F,Hai-Rim S,Freddie B,et al. Estimates of worldwide burden of cancer in 2008:GLOBOCAN 2008[J].Int J Cancer,2010,127(12):2893-2917.
[2] Wu XZ. A new classification system of anticancer drugs based on cell biological mechanisms[J].Med Hypotheses,2006,66(5):883-887.
[3] Jenab-Wolcott J,Giatonio BJ. Bevacizumab:current indications and future development for management of solid tumors[J].Expert Opinion Biological Therapy,2009,9(4):507-517.
[4] Guan Z,Xu JM,Luo RC,et al. Efficacy and safety of bevacizumab plus chemotherapy in Chinese patients with metastic colorectal cancer:a randomized phase ⅢARTIST trail[J].Chin J Cancer,2011,30(10):682-689.
[5] Duffaud F,Therasse P.New guidelines to evaluate the response to treatment in solid tumors[J].Bull Cancer,2000,87(12):881-886.
[6] 田红.靶向抗肿瘤药物的研究进展[J].世界临床药物,2008,29(8):494-501.
[7] 徐建明.肿瘤靶向药物治疗的疗效评价[J].中国实用外科杂志,2010,30(7):529-533.
[8] Lee EK,Revil C,Ngoh CA,et al. Clinical and cost effectiveness of bevacizumab +FOLFIRI combination versus FOLFIRI alone as first line treatment of metastatic colorectal cancer in South Korea[J].Clin Ther,2012,34(6):1408-1419.
[9] Hurwitz H,Fehrenbacher L,Novotny W,et al. Bevacizumab plus irinotecan,fluorouracil,and leucovorin for metastatic colorectal cancer[J].N Engl J Med,2004,350(23):2335-2342.
[10] Reck M,von Pawel J,Zatloukal P,et al. Phase Ⅲtrial of cisplatin plus gemcitabine with either placebo or bevacizumab as first-line therapy for nonsquamous non-smallcell lung cancer:AVAil[J].J Clin Oncol,2009,27(8):1227-1234.
[11] Gianni L,Romieu GH,Lichinitser M,et al. AVEREL:a randomized phase ⅢTrial evaluating bevacizumab in combination with docetaxel and trastuzumab as first-line therapy for HER2-positive locally recurrent/metastatic breast cancer[J].J Clin Oncol,2013,31(14):1719-1725.
[12] Vaziri SA,Kim J,Ganapatlri MK,et al.Vascular endothelial growth factor polymorphismsl:role in response and toxicity of tyrosine kinase inhibitors[J].Curr Oncol Rep,2010,73(7):856-872.
[13] Raez LE,Santos ES,Webb RT,et al.A multicenter phase Ⅲstudy of docetaxel,oxaliplatin,and bevacizumab in first-line therapy for unresctable locally advanced or metastatic non-squamous cell histology non-small-cell lung cancer(NSCLC)[J].Cancer Chemother Phamacol,2013,72(5):1103-1110.

