不同光强下盐胁迫对桑树幼苗叶片活性氧和叶绿素荧光特性的影响
逄好胜,张会慧,田 野,敖 红,孙广玉
(东北林业大学 生命科学学院,黑龙江 哈尔滨 150040)
不同光强下盐胁迫对桑树幼苗叶片活性氧和叶绿素荧光特性的影响
逄好胜,张会慧,田 野,敖 红,孙广玉
(东北林业大学 生命科学学院,黑龙江 哈尔滨 150040)
以桑树(Morus albaL.)为试验材料,分别研究了200、500和1 000 μmol·m-2s-1光强下,不同浓度盐胁迫对桑树幼苗叶片活性氧(ROS)代谢和叶绿素荧光参数的影响。结果表明:桑树幼苗叶片的ROS代谢和叶绿素荧光特性明显受到光强的影响。200 μmol·m-2s-1和500 μmol·m-2s-1下,超氧化物歧化酶(SOD)和抗坏血酸过氧化物酶(APX)有效降低了桑树幼苗叶片中的超氧阴离子(O2·-)和H2O2,且叶绿素荧光参数也没有发生明显变化,因此,弱光下桑树幼苗叶片抗氧化系统功能的增强在防止盐胁迫诱导的PSⅡ光抑制方面发挥了重要的作用。1 000 μmol·m-2s-1下,随着盐浓度的增加,桑树幼苗叶片O2·-大量产生,相应SOD活性增强,SOD的歧化作用导致了H2O2含量大量增加,同时在强氧化胁迫下,叶绿体内清除H2O2的APX活性却受到抑制,叶绿体内过量的H2O2可能破坏了电子传递链上的电子传递,并且PSⅡ发生了明显的光抑制。因此强光是引起盐胁迫下桑树幼苗叶片PSⅡ光抑制的重要原因之一,而强光引起盐胁迫下PSⅡ光抑制与ROS的代谢紊乱有关。
桑树;光强;盐胁迫;活性氧;叶绿素荧光
桑树Moros albaL.较耐盐碱,特别是对中性盐抗性较强[1],近年来在松嫩盐碱地种植桑树进行生态恢复和桑粮间作促进农民增收的模式已经初见成效[2]。植桑不仅可以发展桑蚕业,桑树叶片因其丰富的蛋白含量,还是一种优良的饲料添加剂[3-4],桑树在种植过程中多采用育苗移栽的方式,新移栽到盐碱地的桑树幼苗,由于移栽过程伤根以及幼苗对光照、温度和湿度等新生境的适应能力较差,盐碱地桑树在移栽初期经常发现强光灼伤现象,桑树幼苗的移栽成活率降低、缓苗期较长。光是植物进行光合作用的基础,在一定范围内光强的增加会提高植物的光合速率,但当植物吸收的光能超过光合作用所能利用的能量时,随着光强的增加就会出现过剩光能而会损伤光合机构[5],造成光抑制,甚至光氧化和光破坏。在逆境下,植物对光的利用能力降低,光也是引逆境下起植物光抑制、阻碍植物正常生长发育的重要原因之一[6-7]。逆境下过强的光能会引起植物光合速率的降低[8],光合色素降解以及活性氧代谢紊乱[9]和膜质过氧化[10]等,因此,光在植物的光合作用中是一把双刃剑。为探明盐碱地桑树幼苗光合生理特性对光强的适应能力,本试验以一年生“青龙桑”实生幼苗为试验材料,研究了不同光强下盐胁迫对桑树幼苗活性氧(ROS)代谢和叶绿素荧光参数的影响,以期探明盐胁迫下桑树幼苗对光强的适应能力,为指导桑树在盐碱地区的合理生产提一些基础数据。
1 材料与方法
1.1 试验材料
试验于2012年3~5月在东北林业大学植物生理实验室进行。供桑树品种为“青龙桑”,种子由中国黑龙江省蚕业研究所。3月初播种,培养基质为充分混匀的草炭土和蛭石,比例2∶1(v/v)。在温度 25 ℃、光强 200 μmol·m-2s-1、光周期12 h/12 h(光/暗)光照培养架上培养,常规苗期管理。幼苗株高约10 cm时将幼苗从培养基质中拔出,洗净根系表面的培养基质,放入1/2 Hoagland溶液中进行水培,放在与育苗环境一致的条件下培养30 d,每隔5 d更换一次培养液。
1.2 试验处理
2012年5月10日将长势相对一致的桑树幼苗分别放在分别含有0、50、100和200 mmol·L-1NaCl的1/2 Hoagland溶液中进行盐激处理,每个处理15株,将各盐浓度处理的幼苗平均分为3组,即为3个处理(处理A、处理B和处理C),每组5株。其中处理A幼苗放在光强200 μmol·m-2s-1的白炽灯下培养,处理B幼苗放在光强500 μmol·m-2s-1的微波硫灯下培养,处理C幼苗放在光强1000 μmol·m-2s-1的LED照明灯下培养。由于白炽灯和微波硫灯为热光源,并且二者在发光时散发的热量不同,而LED照明灯为冷光源,因此为消除光源引起的温度不同,试验材料放置在距离光源1 m处。3种光源的光周期均设定为12/12 h(光/暗),试验材料在进行盐和不同光处理48 h后进行活性氧、抗氧化酶和叶绿素荧光参数的测定。
1.3 测定项目和方法
1.3.1 活性氧含量和抗氧化酶活性的测定
1.3.2 叶绿素荧光参数的测定
于9:00~11:00采用便携式脉冲调制荧光仪FMS-2(Hansatch公司,英国)测定各处理植株幼苗倒数第2片完全展开叶片的实际光化学效率(ФPSⅡ)和电子传递速率(RETR);然后将各处理桑树幼苗叶片进行0.5 h暗适应后测定其初始荧光(Fo)、最大荧光(Fm)、PSⅡ最大光化学效率(Fv/Fm)和PSⅡ潜在光化学活性(Fv/Fo)等。叶片的测定部位选择从叶基部数第3与第4叶脉之间,距离主叶脉2 cm左右处,每次测定重复5次。
1.4 数据处理和统计方法
运用Excel软件对试验数据进行统计分析,图中数据为5次重复的平均值±标准差(SE)。
2 结果与分析
2.1 不同光强下盐胁迫对桑树幼苗叶片产生速率和H2O2含量的影响
图1中可以看出,盐浓度在0~50 mmol·L-1时,3种光强下桑树幼苗叶片的产生速率没有发生明显变化,并且处理之间也无明显差异,但H2O2含量却呈增加趋势,特别是处理C增加更为明显。当盐浓度大于50 mmol·L-1时,3种光强下桑树幼苗叶片产生速率和H2O2含量均随着盐浓度的增加均呈明显上升趋势,但不同光强下的增加幅度明显不同,处理C的增加幅度明显大于处理B和处理A,处理A增加幅度最小。当盐浓度增加到 200 mmol·L-1时,处理 C 的产生速率分别高于处理A和处理B61.43%和29.14%,H2O2含量分别高于处理A和处理B 60.62%和35.96%。
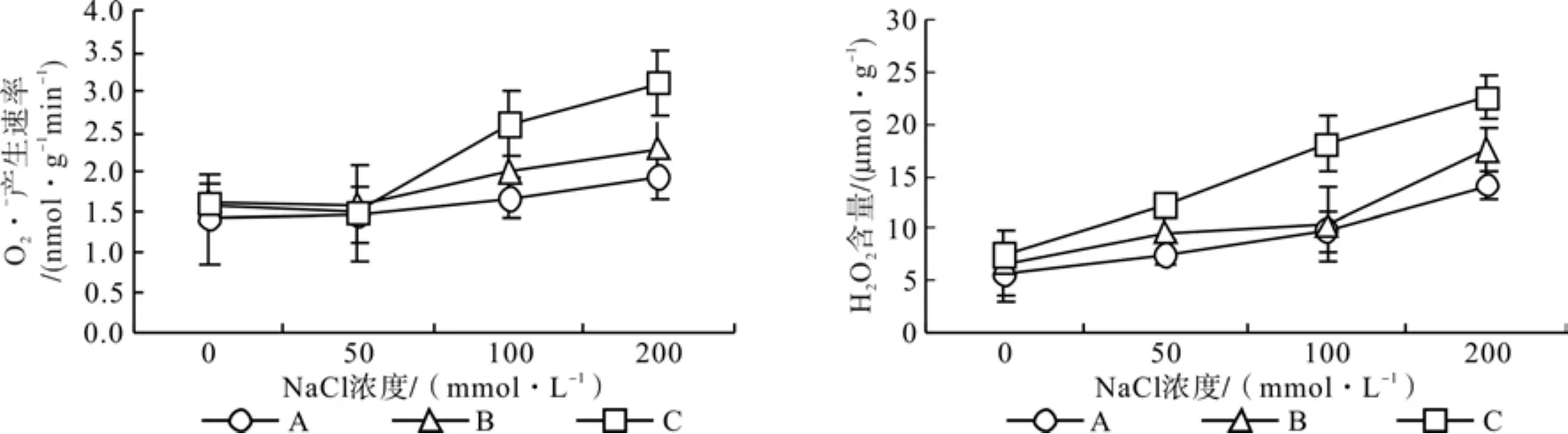
图1 不同光强下盐胁迫对桑树幼苗叶片产生速率和H2O2含量的影响Fig.1 Effects of salt stress under different light intensity on production rate of · and H2O2 contents in leaves of mulberry seedlings
2.2 不同光强下盐胁迫对桑树幼苗叶片SOD和APX活性的影响
图2 中可以看出,随着盐浓度的增加,3种光强下桑树幼苗叶片的SOD活性均呈先增加后降低的趋势,并且其活性的最大值均出现在盐浓度为100 mmol·L-1时,低于 100 mmol·L-1的盐浓度下,处理C的SOD活性始终大于处理A和处理B,但当盐浓度超过100 mmol·L-1时,处理C的SOD活性却下降到处理A和处理B的水平。随着盐浓度的增加,处理A和处理B的APX活性也呈先增加后降低的趋势,处理B的APX活性峰值出现在盐浓度为50 mmol·L-1时,而处理A峰值却出现在盐浓度为100 mmol·L-1时,与处理A和处理B不同,处理C的APX活性随着盐浓度的增加始终呈降低趋势,并且在不同盐浓度下处理C的APX活性也明显小于处理A和处理B。
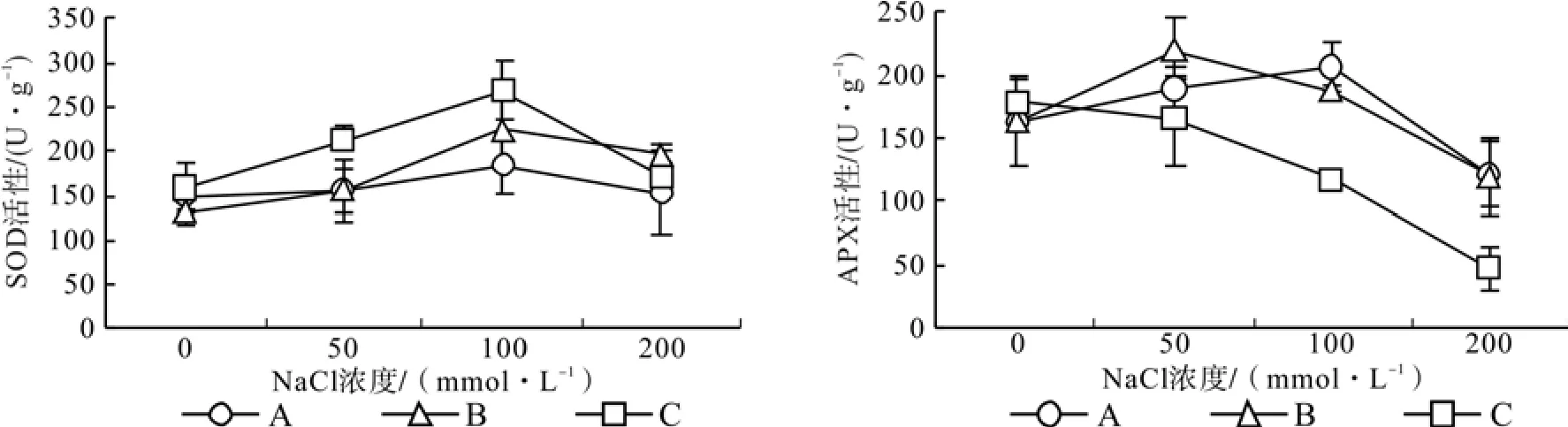
图2 不同光强下盐胁迫对桑树幼苗叶片SOD活性和APX活性的影响Fig.2 Effects of salt stress under different light intensity on SOD and APX activity in leaves of mulberry seedlings
2.3 不同光强下盐胁迫对桑树幼苗叶片ФPSⅡ和RETR的影响
图3 可以看出,不同浓度盐胁迫下,处理A桑树幼苗叶片的ФPSⅡ明显高于处理B和处理C,并且随着盐浓度的增加,其降低幅度也明显小于处理B和处理C。随着盐浓度的增加,处理A和处理B的RETR较低,并且其降低幅度也较小,0~100 mmol·L-1盐胁迫下,处理C的RETR均明显高于处理A和处理B,但处理C的RETR随盐浓度的升高降低幅度却较大,并且当盐浓度增加到200 mmol·L-1时,处理C的RETR降低到分别低于处理A和处理B 68.54%和70.51%的水平。
2.4 不同光强下盐胁迫对桑树幼苗叶片Fo和Fm的影响
图4可以看出,随着盐浓度的增加3种光强下桑树幼苗叶片的Fo均呈增加趋势,而Fm则呈明显的降低趋势,但3种光强下Fo和Fm的变化幅度却明显不同,当盐浓度为0 mmol·L-1时,3种光强下桑树幼苗叶片的Fo和Fm之间均无明显差异,但随着盐浓度的增加,处理C的Fo增加幅度和Fm的降低幅度均明显大于处理A和处理B,处理A桑树幼苗叶片的Fo和Fm变化幅度最小。
2.5 不同光强下盐胁迫对桑树幼苗叶片Fv/Fm和Fv/Fo的影响

图3 不同光强下盐胁迫对桑树幼苗叶片ФPSⅡ和RETR的影响Fig.3 Effects of salt stress under different light intensity on ФPSⅡ and RETR in leaves of mulberry seedlings

图4 不同光强下盐胁迫对桑树幼苗叶片Fo和Fm的影响Fig.4 Effects of salt stress under different light intensity on Fo and Fm in leaves of mulberry seedlings
图5 可以看出,当盐浓度在0~100 mmol·L-1时,处理A桑树幼苗叶片的Fv/Fm和Fv/Fo均没有发生明显变化,当盐浓度增加到200 mmol·L-1时,Fv/Fm和Fv/Fo才呈小幅度的降低;处理B和处理C桑树幼苗叶片的Fv/Fm和Fv/Fo随着盐浓度的增加呈明显的降低趋势,并且处理C降低更为明显,当盐浓度达200 mmol·L-1时,处理C桑树幼苗叶片的Fv/Fm和Fv/Fo分别降低到了0.23和0.36,1 000 μmol·m-2s-1的强光下明显加剧了盐胁迫引起的桑树幼苗叶片的光抑制。

图5 不同光强下盐胁迫对桑树幼苗叶片Fv/Fm和Fv/Fo的影响Fig.5 Effects of salt stress under different light intensity on Fv/Fm and Fv/Fo in leaves of mulberry seedlings
3 讨 论
逆境下植物细胞内的ROS的爆发多为光合作用介导的,当光合电子传递链中的电子过剩时,过剩电子就会攻击细胞内游离的O2分子形成O2·-[4]。本试验中,随着盐浓度的升高,桑树幼苗叶片的实际光化学效率(ФPSⅡ)和电子传递速率(RETR)降低,电子传递明显受阻(图3),电子传递链中过剩的电子激活了细胞中游离O2诱导了的产生(图1),为降低对桑树幼苗叶片的氧化伤害,细胞内清除的SOD活性相应增强(图2)。在浓度0~50 mmol·L-1的盐胁迫下,3种光强处理下桑树幼苗叶片的SOD活性均呈增加趋势,特别是1 000 μmol·m-2s-1光强处理增加更为明显,因此3种光强下桑树幼苗叶片中的产生速率并没有明显增加,即在低浓度的盐胁迫下,SOD活性的增加有效降低了桑树幼苗叶片中产生速率;但当盐浓度在50~100 mmol·L-1时,虽然桑树幼苗叶片的SOD活性也呈增加趋势,但SOD不足以有效清除细胞内的,产生速率增加;当盐浓度超过100 mmol·L-1后,桑树幼苗叶片的SOD活性反而呈降低趋势,导致产生速率增加更为明显。不同浓度的盐胁迫下,1 000 μmol·m-2s-1光强下桑树幼苗叶片的产生速率明显大于200 μmol·m-2s-1和 500 μmol·m-2s-1时,说明较高的光强增加了盐胁迫下的产生,既然的产生主要是由于光合电子传递链中电子过剩的结果,那么盐胁迫下强光加剧的产生原因可能是强光下P680捕获的光量子增加,电荷分离速率增大,电子传递链的压力增加,电子传递受阻所致;也有可能与强光下植物的暗反应利用同化力(ATP和ADPH)的能力降低,同化力的大量积累反馈抑制了光合电子传递链中的电子传递有关。
植物细胞中的H2O2来源大部分都是由SOD歧化产生的[16],· 的生成位于类囊体膜内,但大多数的在扩散出类囊体膜之前就被SOD催化为H2O2和。本试验中,随着盐诱导的爆发和SOD活性的增强,桑树幼苗叶片中的H2O2含量明显增加(图1)。在植物的叶绿体中并不存在清除H2O2的过氧化氧酶(CAT),高等植物的叶绿体内H2O2是由抗坏血酸过氧化物酶(APX)清除的[18-19],但有研究认为植物叶绿体内的APX对极端逆境下产生的过量ROS极其敏感[20],严重氧化胁迫下当ROS含量过高时,APX活性降低[21],因此,在植物的叶绿体内,抑制植物光合作用的ROS主要为H2O2。本试验中,随着盐浓度的增加,200和 500 μmol·m-2s-1光强下桑树幼苗的APX活性均呈先增加后降低的趋势,而1 000 μmol·m-2s-1光强下桑树幼苗的APX活性则始终呈降低趋势,说明强氧化胁迫下桑树幼苗叶片的APX活性明显降低,清除叶绿体内H2O2的能力减弱,特别是 1 000 μmol·m-2s-1光强下,当盐浓度达200 mmol·L-1时,APX基本失活,ROS清除能力的降低导致H2O2的积累。
研究表明,叶绿体内过量的H2O2会通过金属催化的Haber-Weiss反应生成高度活泼、破坏极强的羟基自由基(·OH)[22],·OH会破坏放氧复合体(OEC)的构成亚基并且妨碍其周转而降低PSⅡ的功能[23]。本试验中,1 000 μmol·m-2s-1光强下由于APX的钝化,叶绿体内H2O2的积累明显降低了盐胁迫下桑树幼苗叶片PSⅡ的功能,阻碍了电子传递链的正常生理功能。但有研究认为,单纯的盐胁迫或在弱光下盐胁迫并不会引起植物发生光抑制[24],盐胁迫下,强光会进一步降低植物的光合作用[25],当盐胁迫与强光胁迫交互作用时,植物叶片发生光抑制,甚至光氧化或光漂白死亡,强光是盐胁迫下植物发生光抑制的直接诱因[26]。本试验得到了相似的结果,由于RETR和ФPSⅡ主要受光强的决定,因此 200 μmol·m-2s-1和500 μmol·m-2s-1光强下,由于桑树幼苗叶片吸收的光量子较少,电子传递链的压力较小,桑树幼苗叶片的Fv/Fm和Fv/Fo仅在盐浓度增加到200 mmol·L-1时才呈小幅度的降低,并且随着盐浓度的增加,桑树幼苗叶片Fo的增加幅度和Fm的降低幅度也明显小于光强为1 000 μmol·m-2s-1时,因此,弱光下并没有引起盐胁迫对桑树幼苗叶片的PSⅡ光抑制。但在1 000 μmol·m-2s-1光强下,桑树幼苗叶片的RETR和ФPSⅡ明显高于光强为 200 μmol·m-2s-1和500 μmol·m-2s-1时,但随着盐浓度的增加,RETR和ФPSⅡ的降低幅度较大,并且当盐浓度增加到200 mmol·L-1时桑树幼苗叶片的RETR已降低到低于200 μmol·m-2s-1和 500 μmol·m-2s-1光强水平,另外,1 000 μmol·m-2s-1光强下桑树幼苗叶片的Fm、Fv/Fm和Fv/Fo也呈极显著的降低趋势,桑树幼苗叶片发生了明显的PSⅡ光抑制,结合强光下叶片ROS和保护酶活性的变化结果可以发现,强光下加剧盐胁迫下桑树幼苗叶片光抑制的原因可能与ROS的增加有关。
综上所述,盐胁迫下,桑树幼苗叶片的ROS代谢和叶绿素荧光特性明显受光强的影响。200 μmol·m-2s-1和 500 μmol·m-2s-1的光强下,桑树幼苗叶片抗氧化系统功能的增强在减轻盐胁迫诱导的PSⅡ光抑制方面发挥了重要的作用。但在1 000 μmol·m-2s-1的光强下,随着盐浓度的增加,桑树幼苗叶片大量产生,相应SOD活性增强,但在SOD的作用生成了大量的H2O2,而此时清除H2O2的APX活性却受到了抑制,从而导致PSⅡ发生了光抑制。
[1] 张会慧, 张秀丽, 朱文旭, 等. 桑树叶片光系统Ⅱ对NaCl和Na2CO3胁迫的响应[J]. 北京林业大学学报,2011,33(6):15-20.
[2] 郑晓媛, 赵 莉, 许 楠, 等. 桑树大豆间作地上部和地下部的种间作用研究[J]. 土壤, 2011, 43 (3): 493-49.
[3] 许 楠,张会慧,朱文旭,等.氮素形态对饮料桑树幼苗生长和光合特性的影响[J]. 草业科学,2012,29(10):1574-1580.
[4] 黄自然,杨 军,吕雪娟.桑树作为动物饲料的应用价值与研究进展[J]. 蚕业科学,2006,32(3):337-385.
[5] Alves PLCA, Magalhães ACN, Barja PR. The phenomenon of phot oinhibit ion of photosynthesis and its importance in reforestation[J]. The Botanical Review, 2002, 68(2): 193-208.
[6] 张会慧, 张秀丽, 李 鑫, 等. NaCl和Na2CO3胁迫对桑树幼苗生长和光合特性的影响[J]. 应用生态学报, 2012, 23(3):625-631.
[7] Andrea P, Krisanu C, Sila C,et al.A ntioxidants and manganese def i ciency in needles of Norway Spruce(Picea abiesL.) trees[J].Plant Physiology, 1992, 99: 1084-1089.
[8] Egerton JG, Banks JC, Gibson A,et al.Facilitation of seedling establishment: Reduction in irradiance enhances winter growth of Eucalyptus paucif l ora[J]. Ecology, 2000, 81(5):1437-1449.
[9] 寿森炎, 杨信廷, 朱祝军, 等. 氮素形态和光照强度对番茄生长及抗氧化酶活性的影响[J]. 浙江大学学报:农业与生命科学版, 2000, 26(5): 500-504.
[10] Long SP, Humphries S. Photoinhibition of photosynthesis in nature[J]. Annual Review of Plant Physiology and Plant Molecular Biology, 1994, 45: 633-662.
[11] 王爱国, 罗广华. 植物的超氧物自由基与羟胺反应的定量关系[J]. 植物生理学通讯, 1990, (6): 55-57.
[12] 林植芳, 李双顺, 林桂珠, 等. 衰老叶片和叶绿体中H2O2的积累与膜脂过氧化的关系[J].植物生理学报,1988,14(1):16-12.
[13] 李合生, 陈翠莲. 植物生理生化实验原理和技术[M]. 武汉:华中农业大学出版社, 1998.
[14] 沈文飚, 徐郎莱, 叶茂炳, 等. 抗坏血酸过氧化物酶活性测定的探讨[J]. 植物生理学通讯,1996, 32(3): 203-205.
[15] 柯世省, 金则新. 干旱胁迫对夏腊梅叶片脂质过氧化及抗氧化系统的影响[J]. 林业科学, 2007, 43(10): 28-33.
[16] 朱会娟, 王瑞刚, 陈少良, 等. NaCl胁迫下胡杨(Populus euphratica)和群众杨(P. popularis)抗氧化能力及耐盐性[J].生态学报, 2007, 27(10): 4113-4121.
[17] Takahashi MA, Asada K. Superoxide production in aprotic interior of chloroplast thylakoids[J]. Archives of Biochemistry and Biophysics, 1988, 26: 714-722.
[18] Aran M, Ferrero DS, Pagano E, Wolosiuk RA. Typical 2-Cys peroxiredoxins-modulation by covalent transformations and non covalent interactions[J]. The FEBS Journal, 2009, 276(9): 2478-2483.
[19] Asada K. The water-water cycle as alternative photon and electron sinks[J]. Philosophical Transactions of the Royal Society Biological Sciences, 2000, 355(1402): 1419-1430.
[20] Dietz KJ, Horling F, Konig J,et al.The function of the chloroplast 2-cysteine peroxiredoxin in peroxide detoxification and its regulation[J]. Journal of Experimental Botany, 2002,53(372): 1321-1329.
[21] Santos CVD, Rey P. Plant thioredoxins are key actors in the oxidative stress response[J]. Trends in Plant Science, 2006, 11(7):329-334.
[22] 孙卫红, 王伟青, 孟庆伟. 植物抗坏血酸过氧化物酶的作用机制、酶学及分子特性[J]. 植物生理学通讯,2005,41(2):143-147.
[23] Henmi T, Miyao M, Yamamoto Y. Release and reactive-oxygenmediated damage of the oxygen-evolving complex subunits of PSⅡ during photoinhibition[J]. Plant Cell and Physiology, 2004,45(2): 243-250.
[24] Lu C M, Zhang J H. Role of light in he response of PSⅡphotochemistry to salt stress in the canobacterium Spirulina platensis[J]. Journal of Expermental Botany, 2000,51(3):911-917.
[25] 柏新富, 朱建军, 张 萍, 等. 不同光照强度下三角叶滨藜光合作用对盐激胁迫的响应[J]. 西北植物学报, 2008, 28(9):1823-1829.
[26] Masojidek J, Hall DO. Salinity and drought stresses are amplif i ed by high irradiance in sorghum[J]. Photosynthetica, 1992, 27(1):159-171.
[27] 姜 英, 郝海坤, 黄志玲, 等. 红锥苗期生长特性和叶绿素荧光对不同光强的响应[J]. 中南林业科技大学学报, 2013,33(10): 61-65.
[28] 卢广超, 许建新, 薛 立, 等. 低温胁迫对4种幼苗的叶绿素荧光特性的影响[J].中南林业科技大学学报,2014,34(2):44-49.
Effects of salt stress with different light intensity on active oxygen and chlorophyll fl uorescence characteristics in leaves ofMoros albaL seedlings
PANG Hao-sheng, ZHANG Hui-hui, TIAN Ye, AO Hong, SUN Guang-yu
(College of Life Science, Northeast Forest University, Harbin 150040, Heilongjiang, China)
By taking the seedlings ofMorus albaL as the tested materials, the effects of the stresses of different concentration salt on reactive oxygen species (ROS) and chlorophyll fl uorescence characteristics under different light intensities (200, 500 and 1000 μmol·m-2s-1)were studied. The superoxide anion (O2·-) and H2O2in leaves of mulberry seedlings were obviously decreased by superoxide dismutase(SOD) and ascorbate peroxidase (APX), and the chlorophyll fluorescence parameters did not change obviously under 200 and 500 μmol·m-2s-1; therefore, the enhancement of antioxidant system function in leaves of mulberry seedlings played an important effect on preventing salt-induced of PS Ⅱ photoinhibition under weak light; As the increase of salt concentration, the O2·-contents abundantly produced, and the correspondingly SOD activities enhanced under 1000 μmol·m-2s-1; the dismutation of SOD led to H2O2content increased signif i cantly; meanwhile, APX activities which were mainly responsible for eliminating H2O2were inhibited in chloroplasts under strong oxidative stress, the excessive H2O2in chloroplasts possible damaged electron transports in the electron transport chain,and led to obvious PSⅡ photoinhibitions; hence, the high light was an important cause of PSⅡ photoinhibition in leaves of mulberry seedlings inducing by salt stress; however, PSⅡ photoinhibition caused by high light under salt stress were related to the metabolic disturbance of ROS.
Moros albaL seedlings; active oxygen in leaves; chlorophyll fl uorescence characteristics; illumination intensity; salt stress
S718.43
A
1673-923X(2014)08-0042-06
2013-10-15
国家科技支撑项目(2011BAD08B02-3);国家自然科学基金(30771746,31070307);黑龙江省自然科学基金重点项目(ZD201105)共同资助
逄好胜(1991-),男,山东青岛人,硕士研究生,主要从事植物生理生态学研究;E-mail:haoshengpang@sina.cn
孙广玉(1963-),男,黑龙江巴彦人,教授,博士生导师,主要从事植物生理生态学研究;E-mail:sungy@vip.sina.com
[本文编校:吴 彬]

