叶黄化对俄罗斯杨生理生化特征的影响
王梅,刘晓梅,牛攀新,楚光明
(石河子大学农学院,石河子 832003)
新疆地区风沙大,自然灾害严重,为改善农区生态环境和保证农作物生产安全,营造了大量以杨树为主的防护林。由于多种因素的影响,杨树叶片在生长季常出现发黄、落叶等现象,呈现夏季“秋景”的景象,既破坏了防护林的整齐度和视觉效果,还造成防护林生长衰弱、严重时甚至枯死,严重威胁着防护林的防护效果。
叶片黄化是叶片叶绿素含量减少并衰老的明显标志,叶片黄化引起植物体内其他生理生化特征的变化[1]。目前,林木黄化的研究多集中于樟树、葡萄等景观经济树种的研究[2-3],针对杨树黄化的研究主要集中在杨树黄化苗木叶部氧化酶、叶绿素、生长量以及杨树黄化原因与防治等方面[4-7],而对不同黄化等级杨树生理生化特征的综合研究较少。植物的各种生理生化指标直接反应了植物生长状况的好坏[8-9],因此,若要了解黄化对树木生长的影响,就要明确黄化对树木生长过程中各生理生化指标变化的影响。因此,本研究对不同黄化等级俄罗斯杨(Populus Russkii)树叶片的各项生理生化指标进行测定,分析各项指标与不同黄化等级的关系,明确黄化对俄罗斯杨生理生化特征的影响,以期为杨树黄化的防治研究和林业的发展提供帮助。
1 材料与方法
1.1 材料
实验材料为克拉玛依农业开发区防护林中的俄罗斯杨。
露点水势仪 (HR-33T)(美国WESCOR公司生产),LI-6400便携式光合仪(美国LICOR公司生产)。
1.2 方法
1.2.1 黄化等级划分方法
用叶绿素分析仪(JC503-SPAD502)测量俄罗斯杨叶片的SPAD,将其分为5个黄化等级(表1)。

表1 俄罗斯杨叶片黄化分级标准Tab.1 Leaf etiolation grade standard of Populus Russkii
1.2.2 采样方法
于6月中旬,在克拉玛依农业开发区防护林中选择具有代表性的俄罗斯杨黄化样地1块,逐株对黄化情况进行调查,按照表1的黄化分级标准对树木进行逐株分级,用叶绿素分析仪确定叶片的黄化等级,每个等级采集距新梢顶端5 cm处的叶片各10片,将同一病级叶片分别装入保鲜袋中,用装有冰块的保温桶带回实验室备用。
实验室内对采集的样品进行清洗并晾干表面水分,对不同黄化等级的叶片组织进行相应的生理生化指标测定。
1.2.3 生理生化指标测定方法
本研究所有测定方法参照文献[1 0-1 2]中的方法。
1)水势测定:用露点水势仪(HR-33T-R)测定叶片的水势,每个黄化等级分别选取3个叶片,每个叶片测定3次,7:00-19:00,每隔2 h测1次,共7次。
2)净光合速率测定:用LI-6400便携式光合仪测定净光合速率,每个黄化等级选取3个叶片,每个叶片测定3次,9:00-19:00,每隔2 h测1次,共6次。
3)叶绿素含量测定:采用比色法。
4)丙二醛(MDA)含量的测定:采用硫代巴比妥酸(TBA)显色法。
5)超氧化物歧化酶(SOD)活性测定:采用NBT光化学还原法。
6)过氧化物酶(POD)活性测定:采用愈创木酚显色法。
7)多酚氧化酶(PPO)活性测定:采用儿茶酚法。
1.2.4 数据处理
采用Excel 2003和SPSS18.0软件对试验所得数据进行分析,采用ORIGIN 8.0软件进行绘图。
2 结果与分析
2.1 不同黄化等级叶片水势日变化
通过对不同黄化等级的俄罗斯杨叶片水势的测定结果(图1)表明,从早晨到傍晚,Ⅰ~Ⅳ级水势总体呈现先下降后上升的趋势,7:00叶片具有较高的水势,至 13:00 时降到最低,分别为-1.04、-0.91、-1.01、1.44 和-1.81 MPa,正常(Ⅰ级)叶片水势下降最多。Ⅴ级叶片水势呈持续下降趋势,17:00时达到最低点-2.04 MPa。
对于同一时间来说,叶片的水势随着黄化等级的增加而显著降低,正常(Ⅰ级)叶片水势最高,Ⅴ级的最低。
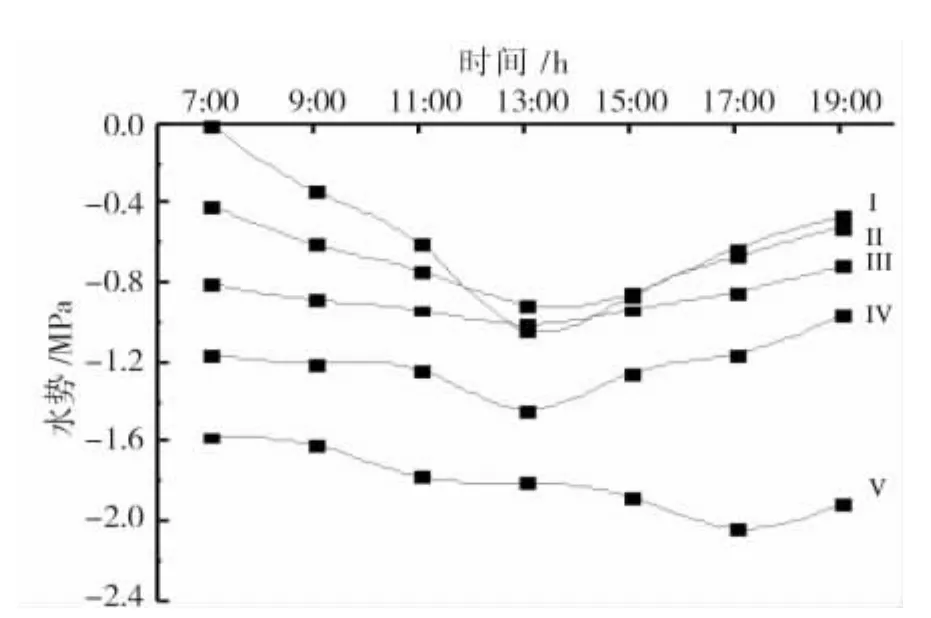
图1 不同黄化等级叶片水势日变化Fig.1 Diurnal variation of leaf water potential under different etiolation grade
2.2 不同黄化等级叶片净光合速率的日变化
不同黄化等级的叶片随着气温和光合有效辐射升高,由图2可见:净光合速率呈现的变化趋势为,13:00 时出现最高峰,Ⅰ级(19.70 μmol/(m2/s))、Ⅱ级(6.47 μmol(/m2/s))、Ⅲ级(4.93 μmol/(m2/s))、Ⅳ级(4.54 μmol/(m2/s))、Ⅴ级(3.42 μmol/(m2/s));此后下降,15:00时出现低谷,Ⅰ~Ⅴ级的净光合速率分 别 占 了 13:00 时 的 32.64% 、10.53% 、19.07% 、24.53%和34.21%;而后净光合速率有所回升,17:00时出现第 2 个峰值,Ⅰ~Ⅴ级分别为 16.70、3.27、3.25、2.52 和2.17 μmol/m2·s。 说明净光合速率的日变化有明显的“午休”现象。在此过程中,正常(Ⅰ级)叶片变化最为明显,Ⅴ级的净光合速率变化最小。
对于同一时间来说,叶片的净光合速率随着黄化等级的增加而显著下降,正常(Ⅰ级)叶片净光合速率最高,Ⅴ级的最小。
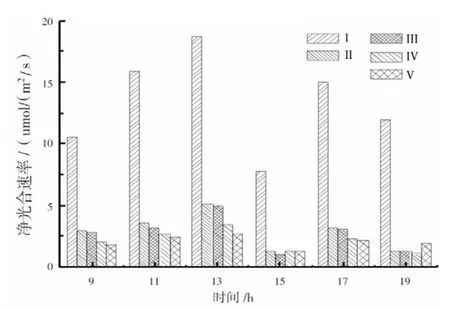
图2 不同黄化等级叶片净光合速率日变化Fig.2 Diurnal variation of leaf net photosynthetic rate under different etiolation grade
2.3 不同黄化等级对叶片叶绿素含量的影响
黄化是叶片叶绿素减少所造成的,因此叶绿素含量是植物黄化最为直接的影响因素[13-14]。通过对不同黄化等级叶片叶绿素含量测定结果(图3)表明,随着黄化程度的加重,叶绿素a的含量快速减少,正常(Ⅰ级)的叶绿素a含量为1.40 mg/g,黄化程度最严重Ⅴ级为0.07 mg/g,Ⅴ级含量分别占到Ⅰ级的5.06%。经方差分析表明,不同黄化等级叶片叶绿素a 含量差异达到显著水平 (F=1199.090,Sig=0.000,P<0.05)。
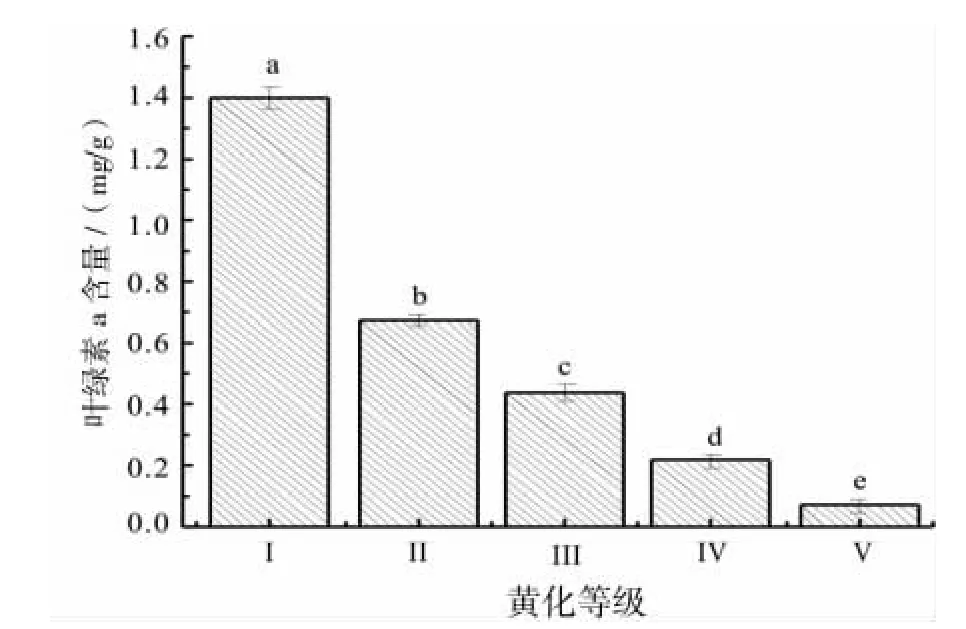
图3 不同黄化等级叶片叶绿素a含量Fig.3 Leaf chlorophyll a content under different etiolation grade
叶绿素b含量与叶绿素a含量一样,其含量也是随着黄化程度的加重而显著下降(图4),自Ⅰ级的 0.55 mg/g 下降至Ⅴ级的 0.24 mg/g,Ⅴ级含量分别占到Ⅰ级的43.12%。经方差分析表明,叶绿素b含量差异极显著(F=7.931,Sig=0.004,P<0.01)。
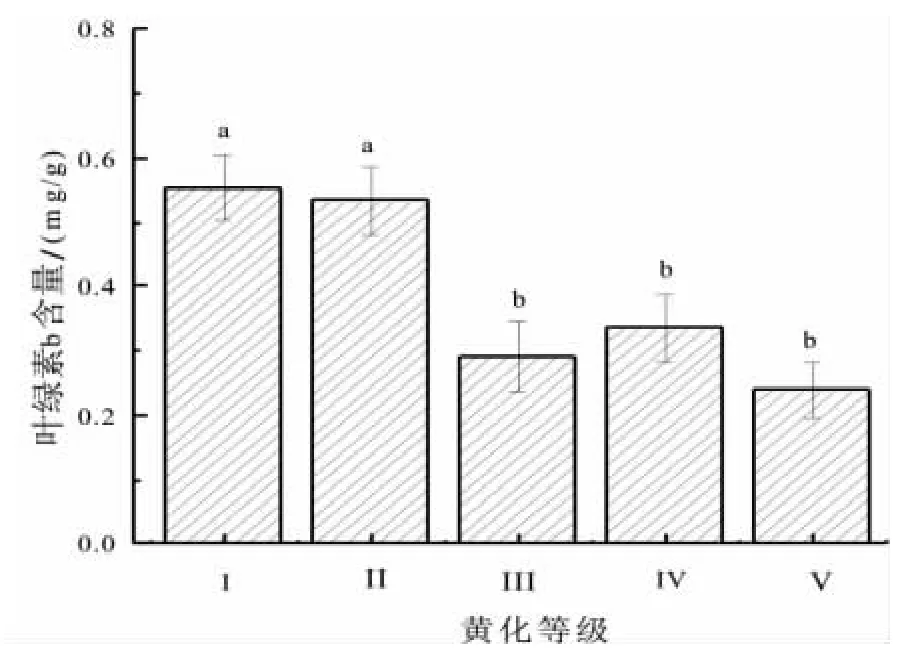
图4 不同黄化等级叶片叶绿素b含量Fig.4 Leaf chlorophyll b content under different etiolation grade
叶绿素含量随着黄化程度的加剧,其含量也显著下降趋势,自Ⅰ级的1.79 mg/g下降至Ⅴ级的0.14 mg/g,Ⅴ级叶绿素含量为Ⅰ级含量的7.99%,降幅达到92.01%,叶绿素含量差异极显著 (F=87.494,Sig=0.000,P<0.01(图 5))。
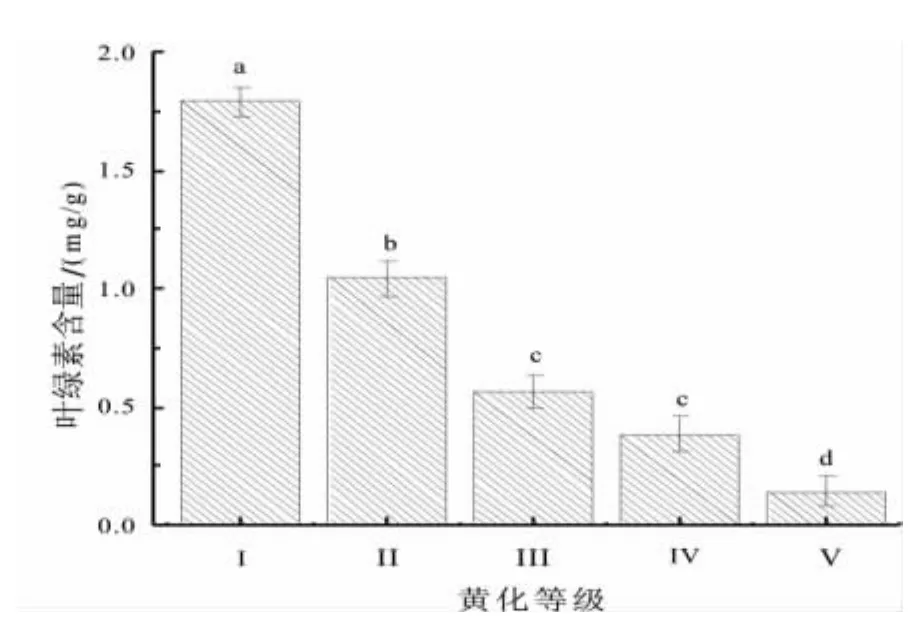
图5 不同黄化等级叶片叶绿素含量Fig.5 Leaf chlorophyll content under different etiolation grade
对叶绿素含量与黄化等级之间的关系作模拟曲线(图6),探讨二者之间的联系。得到指数曲线拟合方程为:Y=3.4754e-0.605X,R2=0.979。
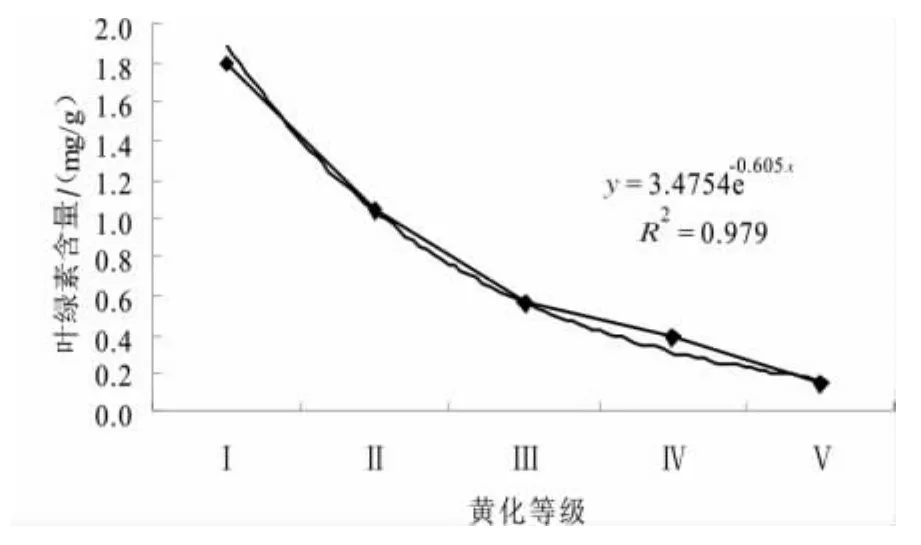
图6 叶绿素含量随叶片黄化等级模拟曲线Fig.6 Simulation curve of Chlorophyll content and etiolation grade
2.4 不同黄化等级对叶片MDA含量的影响
通过对不同黄化等级的俄罗斯杨叶片中的MDA的含量测定结果(图7)表明:黄化叶片除Ⅱ级的 MDA 含量(19.16 μmol/g)高于正常叶片外,其他均低于正常叶片。对5种不同黄化等级叶片的MDA含量进行多重比较,Ⅰ、Ⅱ等级之间差异不显著,Ⅲ、Ⅳ和Ⅴ等级之间差异不显著,Ⅱ、Ⅲ等级之间差异显著(F=10.628,Sig=0.001,P<0.01)。
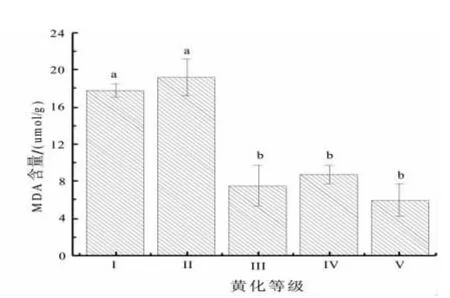
图7 不同黄化等级叶片MDA含量Fig.7 Leaf MDA content under different leaf etiolation grade
2.5 不同黄化等级对叶片SOD含量的影响
SOD作为清除自由基重要物质,关系着植株抗性强弱的重要指标。对不同黄化等级叶片SOD酶含量测定结果(图8)显示,随着黄化程度的加重,叶片SOD酶活性呈下降趋势,黄化叶片中SOD均低于正常叶,正常(Ⅰ级)叶片 SOD 含量为 149.08 U/g,Ⅴ级为 54.35 U/g,SOD 酶降低幅度为 36.46%。经方差分析表明,SOD酶的含量差异显著 (F=4.731,Sig=0.021,P<0.05)。
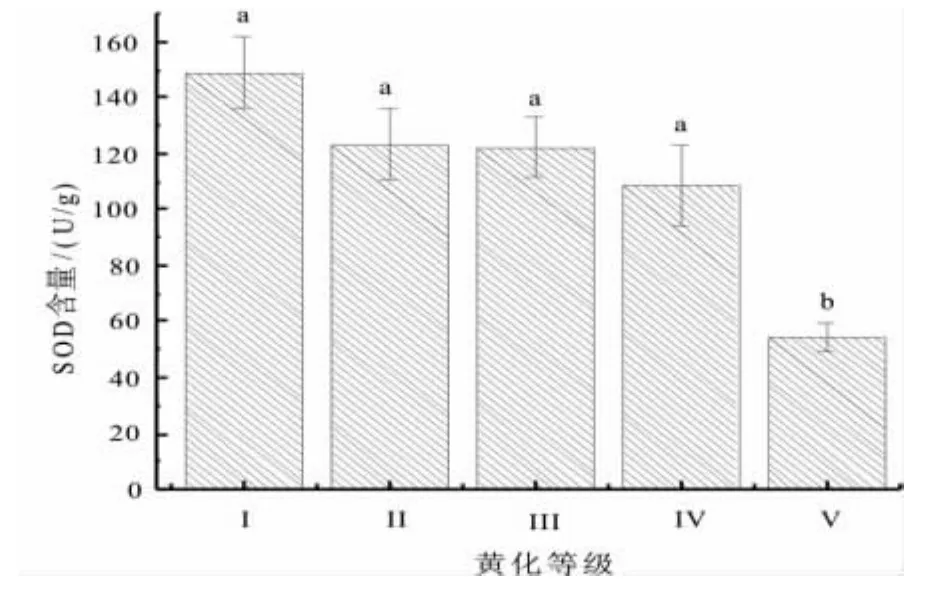
图8 不同黄化等级叶片SOD含量Fig.8 Leaf SOD content under different leaf etiolation grade
2.6 不同黄化等级对叶片PPO含量的影响
PPO酶是植物组织内广泛存在的一种含铜氧化酶,植物受到机械损伤和病菌侵染后,PPO催化酚与O2氧化形成醌,使组织形成褐变,以便损伤恢复,防止或减少感染,提高抗病能力。由图9可见,黄化叶片中的PPO含量呈现不规则波动,正常叶片含量最高,为146.67 U/g·min。经方差分析表明,PPO 含量差异不显著(F=1.578,Sig=0.254,P>0.05)。
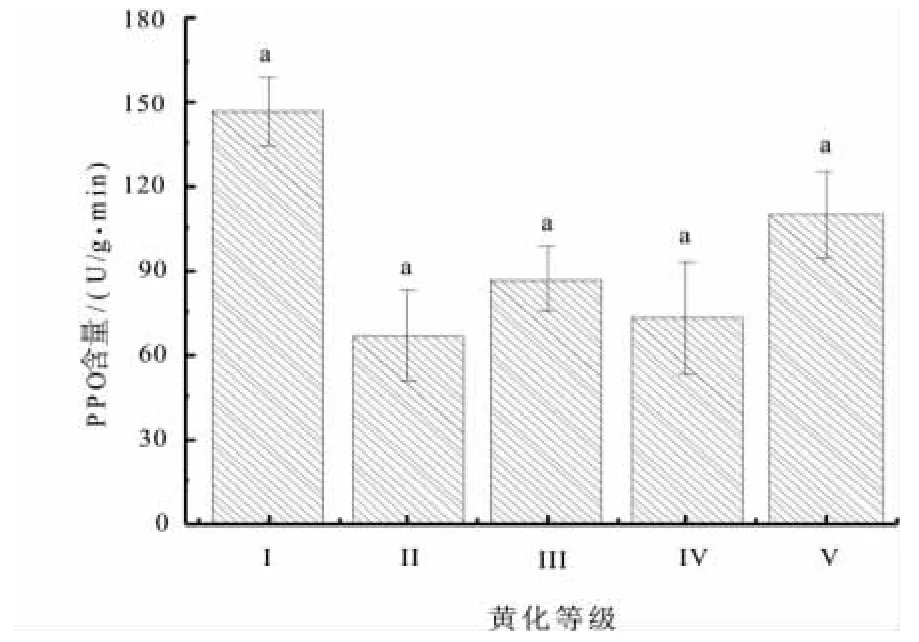
图9 不同黄化等级叶片PPO含量Fig.9 leaf PPO content under different leaf etiolation grade
2.7 不同黄化等级对叶片POD含量的影响
POD酶与呼吸作用、光合作用及生长素的氧化等都有密切关系,其含量的多少直接体现了植株的生长状况。对不同黄化等级叶片中POD含量的测定结果(图10)表明:POD随等级的加重,其含量也逐渐降低。Ⅳ级(330.67 U/g)、Ⅴ级(260.00 U/g)下降极其明显。经方差分析表明,POD含量差异极显著(F=23.720,Sig=0.000,P<0.01)。
2.8 各指标与杨树黄化级别之间的相关性分析
对黄化等级和各生化指标的含量进行了相关性分析,结果(表2)表明:各生化指标与黄化均呈负相关关系,其中叶绿素、SOD、POD含量与黄化具有较高的负相关性,并达到显著水平,即随着黄化程度的增加其含量逐步减少。
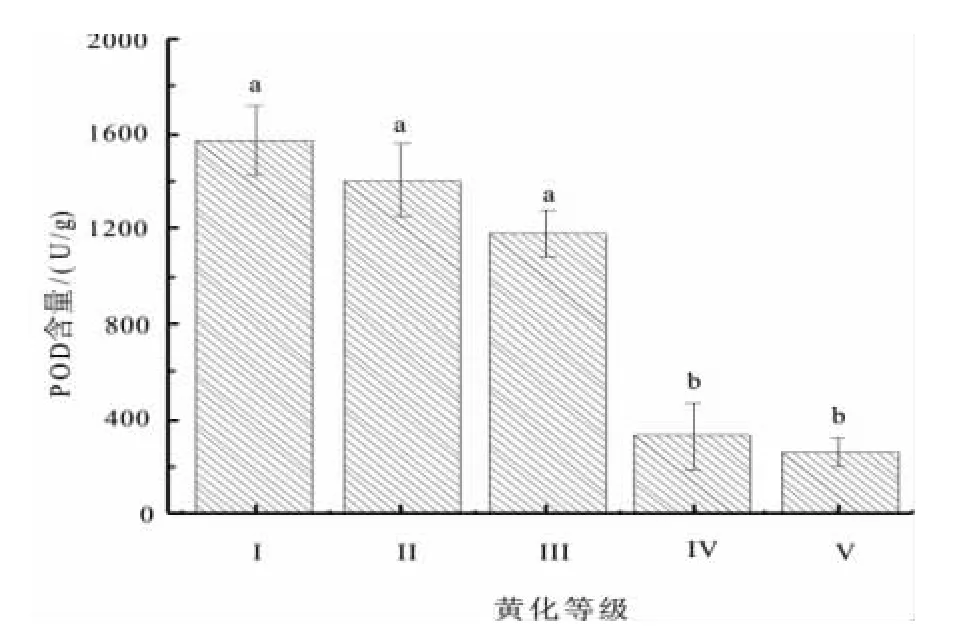
图10 不同黄化等级叶片POD含量Fig.10 Leaf POD content under different leaf etiolation grade

表2 各生化指标与黄化等级之间的相关系数Tab.2 Correlation coefficient of biochemical indexes and tiolation grade
3 结论与讨论
在植物各部位的水势当中,叶片水势代表植物水分运动的能量水平,是植物组织水分状况的直接表现,反映了植物在生长季节中各种生理的活动受环境水分条件制约的程度[15]。光合效率是估计植物潜在生产力的重要指标[16]。本结果研究表明,发生黄化的俄罗斯杨叶水势和叶片净光合速率均低于正常叶片,这主要是由于黄化导致叶片组织结构受到破坏,进而阻碍了植物水分运输和光合作用的进行。
叶绿素的含量减少既是树木黄化形成的原因,也是黄化对树木生理影响的原因。叶绿素含量的减少,形成的化学能也就相应减少,当黄化程度较严重的时候,叶片就会出现白化,直至新梢有枯死现象。本研究结果表明,随黄化等级的增加,叶片叶绿素a、b和a+b含量均呈下降趋势。由于受到外界不良环境的影响,叶片中叶绿素合成受阻,导致叶绿素含量降低。叶绿素含量的大幅下降造成叶片失绿,光合作用受到严重影响,致使植株生长不良。
MDA是膜脂过氧化的产物,其含量的变化可作为衡量逆境胁迫对植物造成氧化损害程度的指标,也可间接反映植物组织的抗氧化能力的强弱。因此,测定植物体内MDA的含量,在一定程度上可以判断逆境对植物的危害程度和植物对逆境的抵抗力[17]。植物受到胁迫后,MDA的含量会随胁迫程度的增加呈现增加的趋势[18-19]。而在本研究中,MDA的含量随黄化等级的加重呈先上升后下降趋势,主要是由于在黄化发生的初期,黄化伤害刺激了叶片细胞中MDA的合成,MDA的含量升高。但随着黄化的逐步加重,叶片内生理代谢不足,生化反应难以维持,则MDA合成量也随之减少。
植物细胞中SOD、POD酶是主要保护酶之一,通过清除体内产生的氧自由基,阻止氧化损伤[20-21]。本研究表明,黄化的叶片中SOD、POD酶含量随着黄化等级的逐步加重,其含量随之下降。这说明叶片黄化影响了植株的正常生长代谢,严重影响了这些保护酶的合成,进而影响了正常的叶片生理功能。
PPO酶的活性并没有随黄化等级的增加而出现显著的升高或降低,呈现不规则波动。只在黄化最严重(Ⅴ级)有所增加,这就说明了黄化并不会直接影响PPO酶的含量,只有当杨树叶片出现极度营养不足或者枯死情况下,细胞萎缩,才会间接引起PPO酶的含量的增加以形成组织褐变,防止或者减少外界病原物的再次侵染。
俄罗斯杨叶黄化后,其各项生理生化指标发生了不同程度的改变,轻微的黄化(Ⅱ级)对各指标影响较小,但随着黄化等级的升高各指标含量均减少,尤其是叶绿素、SOD、POD含量。
[1]Matile P.Biochemistry of Indian summer:physiology of autumnal leaf coloration[J].Exp.Gerontol,2000,35:145-158.
[2]陈超,刘洪剑,束庆龙,等.影响市区樟树黄化病的主要因素研究[J].林业科学研究,2008,21(5):625-629.
[3]王翠玲,杨晓明,曹孜义.缺铁黄化对葡萄生长及果实品质的影响[J].果树学报,2007,24(1):26-29.
[4]刘云鹏,徐福元,朱兴俊,等.杨树黄化苗木叶部氧化酶及 MDA 响应特征[J].林业科学研究,2010,23(3):355-361.
[5]刘云鹏,解春霞,郑华英,等.苏北杨树黄化病对苗木生长量的影响[J].江苏林业科技,2010,37(5):10-13.
[6]李东.防护林体系中杨树叶黄化原因与防治[J].新疆林业,2008(1):39-40.
[7]Thevathasan N V,Gordon A M.Poplar leaf biomass distribution and nitrogen dynamics in a poplar-barley intercropped system in southern Ontario,Canada[J].Agroforestry System,1997,37(1):79-90.
[8]Cha Um S,Ulziibat B,Kirdmanee C.Effects of temperature and relative humidity during in vitro acclimatization,on physiological changes and growth characters of Phalaenopsis adapted to in vivo[J].Australian Journal of Crop Science,2010,4(9):750-756.
[9]Borrelli G M,Ficco D B M,Giuzio,L,et al.Durum wheat salt tolerance in relation to physiological,yield and quality characters[J].Cereal Research Communications,2011,39(4):525-534.
[10]陈毓荃.生物化学实验方法和技术[M].北京:科学出版社,2005.
[11]梁振娟,张亚黎,罗宏海,等.钾营养对棉花叶片光合作用及衰老特性的影响[J].石河子大学学报:自然科学版,2013,31(3):265-270.
[12]李维,胡渊渊,张亚黎,等.土壤水分对棉花生育后期叶片衰老及光合功能的影响[J].石河子大学学报:自然科学版,2012,30(3):296-301.
[13]Fang Z Y,Bouwkamp J C,Solomos T.Chlorophyllase activities and chlorophyll degradation during leaf senescence in nonyellowing mutant and wild type of Phaseolus vulgaris[J].Journal of Experimental Botany,1998,49(320):503-510.
[14]Matile P,Hortensteiner S,Thomas H,et al.Chlorophyll breakdown in senescent leaves[J].Plant Physiology,1996,112:1403-1409.
[15]Tomar V S,Toole J C.A field study on leaf water potential,transpiration and plant resistance to water flow in rice[J].Crop Science,1982,22:5-9.
[16]栗媛,潘存德,王世伟.果实不同生长发育阶段轮台白杏光合特性[J].新疆农业科学,2012,49(6):1015-1021.
[17]赵文勤,庄丽,远方,等.新疆准噶尔盆地南缘不同生境下的梭梭和柽柳生理生态特性[J].石河子大学学报:自然科学版,2010,28(3):285-289.
[18]周伟伟,王雁,杜静.干旱胁迫对景天属植物生理生化特性的影响[J].林业科学研究,2009,22(6):829-834.
[19]高丽,杨劼,刘瑞香.不同土壤水分条件下中国沙棘雌雄株叶片形态结构及生理生化特征 [J].应用生态学报,2010,21(9):2201-2208.
[20]李晶,阎秀峰,祖元刚.低温胁迫下红松幼苗活性氧的产生及保护酶的变化[J].植物学报,2000,42(2):148-152.
[21]徐小万,曹必好,陈国菊,等.高温高湿对辣椒抗氧化系统的影响及不同品种抗氧化性差异研究 [J].中国生态农业学报,2008,23(1):81-86.

