美洲鲥鱼卵巢发育规律和性类固醇激素变化研究
洪 磊,李兆新,陈 超,郭正龙,王蔚芳,雷霁霖
(1.中国水产科学研究院黄海水产研究所,农业部海洋渔业可持续发展重点实验室,青岛市海水鱼类种子工程与生物技术重点实验室,山东青岛266071;2.江苏中洋集团,江苏南通226600)
1 前言
鲥鱼俗称迟鱼,是我国传统名贵经济鱼类,因其肉细味鲜,营养价值高,明朝时即位列中国四大名鱼。由于多年过度捕捞以及江河水质变化等原因,我国鲥鱼种群数量锐减[1,2],1988年已被列入国家一级重点保护野生物种。美洲鲥鱼(Alosa sapidissima)原产北美洲大西洋海岸[3],与中国鲥鱼同属不同种,具有相同的溯河产卵习性,形态特征、鱼肉品质和品味等都与中国鲥鱼十分相似,在后者濒临灭绝的情况下引入我国市场,销售价格十分可观,前景良好。目前国内美洲鲥鱼相关的研究工作主要集中在繁殖、养殖技术及早期发育管理等方面[4~7],对亲鱼卵巢结构、发育及卵子发生方面未见报道。本研究利用组织学、形态学及电化学发光免疫等技术方法,系统研究美洲鲥鱼亲鱼卵巢发育的组织学特征、性类固醇激素(雌二醇)的周期性变化,旨在了解美洲鲥鱼卵子发生及内分泌调控规律,以期能为亲鱼营养强化和人工大规模繁殖提供科学依据,其结果对渔业资源的保护和珍稀鱼类开发利用都具有重大的意义。
2 材料和方法
2.1 实验鱼培育
本实验所用美洲鲥鱼样本来自江苏中洋集团繁育中心。实验样本为达到性成熟的3龄以上雌性亲鱼,全长(40±5)cm,体重(1.2±0.5)kg。亲鱼培育水温(19±2.0)℃,溶解氧>7mg/L,pH 7.3±0.2,总氨氮<0.05mg/L,日换水率5%,投喂量为鱼体重的3%,每日按时清饵排污。
2.2 组织切片和性腺分期
实验鱼用MS222麻醉后解剖,小心取出性腺,在Davis固定液中固定24 h后转入70%酒精保存。固定的性腺组织经梯度脱水、透明和石蜡包埋后,用Leica RM 2016型切片机连续切片,厚度为5~7μm,H.E染色,中性树脂封片。在显微镜(Olym-pus BX51)下拍照观察。根据Мейен的分类标准,结合卵母细胞发育的结构特点,对卵母细胞发育进行分期。
2.3 性类固醇激素测定
使用罗氏ROCHE cobas e601型电化学发光免疫分析仪测定血清中雌二醇(E2)的表达含量,测定数据以pg/m L单位来表示。
2.4 数量特征测量和数据统计分析
对实验鱼进行生物学测量,包括体重(BW)、全长(TL)、性腺重(GW)及肝脏重(LW)等。性腺发育相关指数计算:性腺指数(GSI)=GW/BW×100;肝脏指数(HSI)=LW/BW×100;肥满度(CF)=[BW/(BL)3]×100。对以上数值进行单因素方差(ANOVA)分析(SPSS软件,V11.5),检测变化差异的显著性。取差异显著性(P)为0.05,P≤0.05视为差异显著,反之不显著。
3 结果与分析
3.1 美洲鲥鱼卵巢发育周期变化规律
鲥鱼卵巢成对发育,分左右两叶,位于体腔的腹中线,紧贴于肾脏腹面两侧,在身体后端形成短小的输卵管(见图1)。卵巢内有卵巢腔和产卵板,成熟的卵子先突破包围在它周围的滤泡膜而跌入卵巢腔,然后经输卵管从泄殖孔排出体外。卵巢的外部形态和组织结构,随着年龄的增加、季节和性周期的运转而变化。根据卵巢外部形状、色泽及卵母细胞不同的发育时相(切片视野中数量或者面积占优势的卵母细胞类型)为卵巢划分依据,将鲥鱼的卵巢发育分为6个时期。
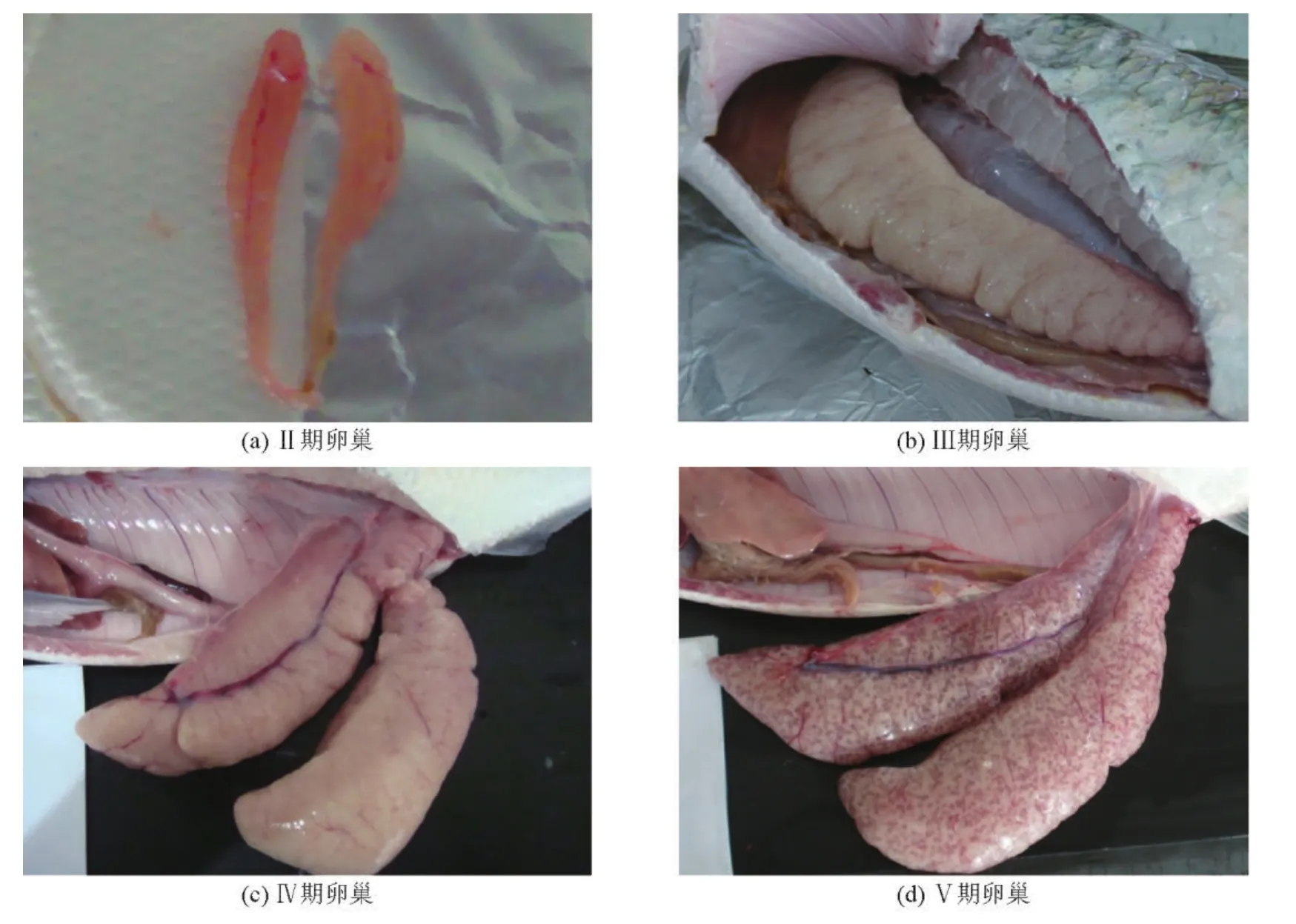
图1 美洲鲥鱼卵巢Fig.1 The ovary of Alosa sapidissima
第Ⅰ期,卵巢很小,呈透明线状,难辨雌雄,卵巢内以卵原细胞为主,终生只出现一次,在亲鱼卵巢成熟周期调查中不可见。
第Ⅱ期,已分化出完整的双叶状结构,长度较第Ⅰ期性腺有所增加,呈前部钝圆逐渐往后细长延伸的圆锥形,肉红色,表面被覆一层淡红色被膜,可见微细的血管,肉眼可初步辨别雌、雄。性腺发育系数为1左右(见图1a)。肉眼不可分辨卵母细胞,组织切片观察,卵巢有明显的卵巢腔,由卵巢表面向腔体内部折叠形成产卵板,大量发育中的卵母细胞封闭在产卵板内。卵巢中以第2时相卵母细胞为主(见图2a)。
第Ⅲ期,卵巢呈淡黄色,表面血管丰富。卵巢体积明显增大,总体仍为扁平长囊状,卵巢上分叶所形成的横纹明显,细小的卵母细胞肉眼可见,但不易分离。组织切片观察,卵母细胞大小不均,第3时相卵母细胞占绝大部分面积,第2时相卵母细胞所占面积很小,多分布于小叶边缘(见图1b)。
第Ⅳ期,卵巢为淡黄色或浅桔色,迅速生长,体积明显膨胀,呈囊状,左右侧卵巢在鳔处有少量重叠,整个体腔几乎被卵巢充满,肉眼可见增大的卵粒,颗粒饱满,卵粒相互粘连,不易游离。以第4时相初期卵母细胞为主,存在部分第2、3时相卵母细胞(见图1c)。
第Ⅴ期,产卵期卵巢,卵巢极度发育,鱼腹表面可见圆柱形隆起,卵巢大、松软,卵粒大都游离,透明状。轻轻地挤压,泄殖孔处有成熟卵粒流出。组织切片观察,卵巢内除第5时相的卵母细胞外,还含有第3、4时相的卵母细胞(见图1d)。
第Ⅵ期,即刚产过卵的卵巢,卵巢退化,体积和重量大为减小,松软瘪塌,卵巢腔萎缩。保有未产出的成熟卵及发育未成熟而未产出退化的卵。
3.2 美洲鲥鱼卵母细胞形态发育特征及分期
鱼类卵子的发生经过增殖、生长和成熟这几个时期。随着季节的变化和性周期的运转,在卵巢的组织发育过程中,可以观察到处在不同发育阶段的生殖细胞。
第1时相,处于卵原细胞阶段或由卵原细胞向初级卵母细胞过度的细胞。
第2时相,处于小生长期的初级卵母细胞,呈圆形、椭圆形或多角形,细胞质增长较快,细胞质呈现强嗜碱性,苏木精染色成蓝紫色(见图2a)。细胞质中出现大而圆的细胞核,略近中央,核膜明显,核质着色浅,早期核中可见极细,棒状染色体。核仁多个,分布于核膜内缘。细胞外有单层滤泡膜包被。在较早阶段的细胞质中存在与核仁染色相近的团块状卵黄核(见图2b)。
第3时相,初级卵母细胞进入大生长期,其形态基本呈圆球形,细胞体积明显增大,细胞质呈现弱嗜碱性。核膜呈波状形,十几个到数十个不等的细小核仁附在核膜上,一般未见粗大核仁存在。细胞质外缘出现皮质液泡。早期只出现一层松散排列、大小不一的液泡,随后液泡数目不断增加并逐渐向内缘移位,从一层、两层到数层(见图2c、2d)。到Ⅲ时相晚期,胞质的皮质部分首先出现一些被H.E法染成紫红色的卵黄颗粒,以后卵黄颗粒逐渐增多,广泛分布于液泡之间的细胞质中。细胞外的滤泡细胞由单层扁平滤泡细胞期逐渐转化为双层扁平滤泡细胞期(见图2c)、立方形颗粒细胞期(见图2e)。卵母细胞膜与滤泡细胞之间开始出现放射带并分化为内外两层(见图2d、2e)。
第4时相,处于大生长期晚期的初级卵母细胞,即卵黄充满期。细胞和胞核直径均有所增大。小核仁数量增多,多位于核膜内侧周边;核膜形状不规则。卵黄球逐渐增多,直至几乎充满核外空间,只有在核的周围及靠近卵膜边缘有较多的细胞质,呈弱嗜碱性。放射带明显增厚,相对而言,内层放射带较厚,外层放射带较薄,放射带上的条纹清晰可见。胞外膜可分为滤泡细胞构成的颗粒细胞层及由荚膜细胞、毛细血管等构成的荚膜细胞层(见图2f、2h)。
第5时相,成熟的卵细胞。核膜破裂并消失,细胞质被卵黄挤到细胞的边缘。卵黄球散布于整个卵母细胞的胞质内,大多数呈椭圆形,排列十分紧密,有的卵黄球已经融合成卵黄板,呈均质红染。卵质的边缘仍有液泡,即将排卵的滤泡膜松驰,大部分与卵膜分离(见图2i)。
第6时相,细胞形状不规则,蜷曲于卵巢内,其特征是核消失,卵黄液化。在卵母细胞生长发育的过程中存在卵母细胞萎缩现象(见图2j)。
3.3 美洲鲥鱼卵巢发育过程生物学数据变化
在鲥鱼卵巢发育周期,亲鱼肝脏指数HSI在1.32~2.64范围内波动,Ⅰ期水平最低,逐渐升高并于Ⅳ期达到峰值,此后降至1.48的水平产卵,与Ⅱ期、Ⅲ期亲鱼HSI水平基本持平。整个发育周期HSI值差异不显著。随着卵巢的发育,亲鱼肥满度CF呈逐渐增加的趋势,Ⅰ~Ⅱ期维持在0.8左右,在Ⅴ期卵巢达到1.1的最大值。CF变化差异不显著(见图3)。
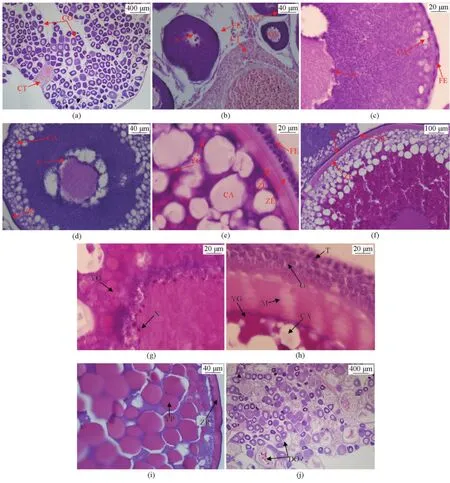
图2 美洲鲥鱼卵母细胞Fig.2 The oocyte of Alosa sapidissima
美洲鲥鱼雌性亲鱼性腺指数GSI与血浆中E2的变化如图4所示。随着鲥鱼性腺开始发育,卵巢增大增重,亲鱼GSI开始升高,Ⅱ期后发育加速,在产卵期(卵巢Ⅴ期)时达到顶峰。本实验中卵巢发育Ⅴ期的鲥鱼GSI为18.47±1.10,显著高于卵巢Ⅲ期鲥鱼GSI(11.78±0.33),但是与卵巢Ⅳ期鲥鱼GSI(14.92±2.04)差异不显著。在性腺发育过程中E2的变化规律与GSI基本相同,性腺发育早期鲥鱼血浆中E2表达水平较低,进入Ⅲ期以后E2表达水平开始上升。本实验中卵巢发育处于Ⅴ期的鲥鱼血浆E2表达水平最高,虽与卵巢Ⅳ期鲥鱼E2表达量相比没有显著性差异,但是显著高于卵巢Ⅰ~Ⅲ期鲥鱼样品中E2表达水平。
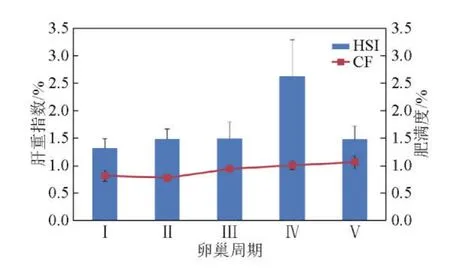
图3 美洲鲥鱼肝脏指数(HSI)和肥满度(CF)的变化Fig.3 Hepatosomatic index and condition factor variation of Alosa sapidissima
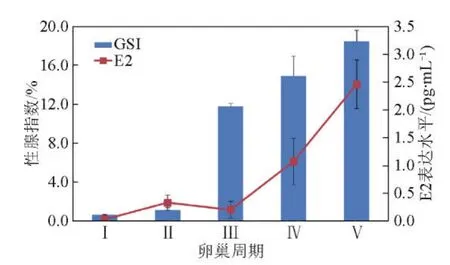
图4 美洲鲥鱼性腺指数(GSI)和血浆中雌二醇(E2)的变化Fig.4 Gonadosomatic index and plasma 17-estradiol levelsvariation of Alosa sapidissima
4 总结与讨论
4.1 美洲鲥鱼的产卵类型及卵母细胞发育特征
鱼类繁殖的周期性活动可以分为3种类型:完全同步型,部分同步型和不同步型。完全同步型,卵巢内的卵母细胞都处于形同的发育阶段;部分同步型,卵巢内至少由两种处于不同发育阶段的卵母细胞群组成,它们在一年内通常只产卵一次,生殖季节相当短;不同步型,卵巢内含有各个发育阶段的卵母细胞,一年内产卵多次,生殖季节相当长,如金鱼、鳉鱼等[8]。研究结果表明,美洲鲥鱼卵母细胞的发育呈部分同步型。不同发育阶段的卵巢中含有多种时相的卵母细胞,并且在排卵后的卵巢中,除了排卵后残留的空滤泡膜外,仍然含有一定数量的、发育正常的3、4时相卵母细胞,这与欧洲鳎(Solea solea)[9]、半滑舌鳎(Cynoglossus semilaevis)[10]、条斑星鲽(Veras permoseri)[11]的产卵特征一致。当亲鱼营养积累充足且养殖环境理想的状态下,在短时间内存在再次排卵的可能,因此美洲鲥鱼应该属于一年产卵一次的部分同步型,也被称为非同步分批多次产卵类型。
鱼类卵子的发生要经过增殖、生长和成熟这几个时期。卵母细胞的发育要经过原生质生长、卵黄的发生积累等过程,而卵黄发生期的主要特征是卵母细胞胞质中合成卵黄颗粒。本研究发现,美洲鲥鱼卵母细胞发育过程中,首先在质膜边缘出现皮质液泡,进入大生长期后开始出现卵黄颗粒,其后卵黄颗粒数量和体积迅速增加,逐渐充满整个核外空间。此外,在卵母细胞生长发育的过程中发现有部分卵母细胞不能最终地完成其整个发育过程而出现萎缩的现象,主要表现为各层卵膜分离并逐渐破损溶解,细胞质收缩,细胞内产生大量的空泡,萎缩的卵子最终会被分解吸收。产生萎缩的原因可能是复杂的,主要的原因之一是卵巢在发育的过程中缺乏必需的营养,使第3时相的卵母细胞向第4时相过渡时,卵黄的形成受到阻碍,甚至使第2时相的卵母细胞向第3时相转变也受到抑制。在此过程中卵黄颗粒胶液化,卵膜发生皱褶,最后断裂而消失[12]。
鱼类的卵膜来源于卵母细胞和滤泡细胞,或由两者相互作用而形成,其结构从二层到五层不等,而厚度也不相同,浮性卵卵膜薄,卵周隙大;沉性卵卵膜厚,卵周隙小,表现出结构与环境相适应的特点[13]。美洲鲥鱼小生长期的卵膜为单层结构,细胞外包围一层滤泡细胞。随着卵细胞发育,滤泡细胞逐渐由单层发展为2层扁平状细胞层,后来发展成内层细胞一般呈立方状,外层细胞一般呈扁平状。在第3时相卵母细胞早期未见放射带形成,当卵母细胞发育到3时相晚期时,出现由卵细胞膜向外形成放射带结构。至第4时相卵母细胞中、后期时,放射带厚度明显增加,出现明暗相间的放射纹。放射带的保护卵母细胞发育、保持胚胎良好的通气性和调节渗透压等生理机能充分显示出来[14,15]。
4.2 性腺指数、肝脏指数和肥满度与卵巢发育的关系
性腺指数GSI的快速变化可直接反应出在产卵调控过程中亲鱼性腺的快速生长和发育。与高体鰤(Serioladumerili)[16]和花鲈(Lateolabraxjaponicas)[17]相似,美洲鲥鱼GSI在产卵期快速升高,Ⅴ期卵巢时达到峰值,在非生殖期保持较低的水平,表明性腺对环境因子调控应答机制较好。
肝脏指数HSI可反应鱼体内储存能量的多少,其变化可反映出亲鱼的摄食情况和肝脏卵黄蛋白原合成的动态变化[18],因此HSI是评价鱼类性腺发育的重要数量指标。本研究表明美洲鲥鱼HSI在卵巢发育至Ⅳ期达到峰值,但随后下降。亲鱼在产卵期前摄食水平较高而提高能量储备,在卵黄发生期,鱼体储能被肝脏用于卵黄蛋白原合成和运输[19],因此HSI在卵巢发育前期呈上升的态势。随着卵巢的发育、膨大,越来越侵占胃肠等其他内脏空间,当接近Ⅴ期排卵期时鲥鱼摄食量已大幅下降,而此时卵黄物质仍在加速积累,肝脏储能被快速消耗,因此出现鲥鱼HSI在卵巢发育后期下降的趋势。暗纹东方鲀在性腺发育中就存在性腺指数愈大,肝脏指数愈小的现象,即随着成熟度的提高,卵巢逐渐加大而肝脏逐渐减小[20]。
鱼类肥满度CF常用于比较鱼类的生长情况,也可作为不良环境状况的指标。生长是鱼类长期摄食、吸收和消耗能量过程的综合反映。生长缓慢则意味着没有足够的能量用于繁殖,可造成个体健康的下降和繁殖力降低。本研究中美洲鲥鱼卵巢发育过程中CF基本持平略呈上升趋势,与其他鱼类研究结果比较并没有广泛的共性,可能是由于鱼类生殖策略的差异导致生殖耗能的差异所致[10]。
4.3 血浆雌二醇水平与卵巢发育的关系
美洲鲥鱼血浆E2检测过程中,卵巢发育Ⅱ期时,亲鱼处于生长和营养积累阶段,检测的激素处于低水平。随后亲鱼性腺处于快速发育期,E2检测值也表现为急剧上升,从外观观察亲鱼腹部出现膨胀、变硬再变软最终至排卵的现象。因为美洲鲥鱼在人工受精后立即死亡,所以没有检测到排卵后血浆E2水平。美洲鲥鱼血液E2水平在Ⅲ期后持续升高,Ⅴ期时达到峰值,其变化规律与GSI相同。
5 结语
本研究通过对美洲鲥鱼卵巢发育周期组织学观察发现,美洲鲥鱼属于非同步分批产卵类型;根据卵巢外部形状大小及色泽等的不同,可将美洲鲥鱼卵巢发育过程分为6个时期;根据卵母细胞的形态结构、卵黄物质的积累和滤泡细胞的变化,将卵子发生划分为6个时相。通过对美洲鲥鱼形态学和电化学发光免疫等技术方法检测发现,在卵巢发育周期肝脏指数HSI先上升后下降在卵巢Ⅳ期达到峰值而肥满度CF基本呈上升趋势,但差异都不显著;性腺指数GSI与血浆中雌二醇E2水平在产卵期快速升高,卵巢Ⅴ期时达到峰值,显著高于发育前水平,表现出与性腺发育协同一致的变化规律。
[1] 邱顺林,刘 琳.长江鲥鱼繁殖保护的初步研究[J].淡水渔业,1986(6):5-8.
[2] 邱顺林,黄木桂,陈大庆.长江鲥鱼资源现状和衰退原因的研究[J].淡水渔业,1998,28(1):18-21.
[3] Jordan D S,Evermann B W.The Fishes of North and M iddle America:A Descriptive Catalogue of the Species of Fish-like Vertebrates Found in the Waters of North America,North of the Isthmus of Panama(Volume 1)[M].U.S.:Government Printing Office,1896.
[4] 刘青华,贾艳菊,高永利,等.美国鲥鱼的生物学特性与集约化养殖管理[J].渔业现代化,2006,1:26-34.
[5] 张根玉,朱雅珠,张海明,等.美国鲥鱼人工繁殖技术研究[J].水产科技情报,2008,35(5):221-223.
[6] 洪孝友.美洲鲥早期发育的形态学及组织学观察[D].上海:上海海洋大学,2011.
[7] 张呈祥,徐钢春,徐 跑,等.美洲鲥仔、稚、幼鱼的形态发育与生长特征[J].中国水产科学,2010,17(6):1227-1234.
[8] 林浩然.鱼类生理学[M].广东:广东高等教育出版社,2007,155-213.
[9] Witthames PR,Greer W M.Determinacy of fecundity and at resia in sole(Solea solea)from the Channel,the North Sea and the Irish Sea[J].Aquatic Living Resources,1995,8(1):91-109.
[10] 柳学周,徐永江,刘乃真,等.半滑舌鳎卵巢发育的组织学和形态数量特征研究[J].渔业科学进展,2009,30(6):25-35.
[11] 倪 娜,柳学周,徐永江,等.条斑星鲽卵巢发育规律和性类固醇激素周年变化研究[J].渔业科学进展,2011,32(3):16-25.
[12] 董玉兰,王树迎.泰山螭霖鱼卵巢年周期中卵母细胞发育及其性腺类固醇激素作用[J].中国农业科学,2006,39(6):1264-1271.
[13] 刘文彬,张轩杰.黄颡鱼的卵巢发育和周年变化[J].湖南师范大学自然科学学报,2003,26(2):73-78.
[14] 龚启祥,曹克驹,曾 崤.香鱼卵巢发育的组织学研究[J].水产学报,1982,6(3):222-234.
[15] 张耀光,谢小军.南方鲶卵巢滤泡细胞和卵膜生成的组织学研究[J].动物学研究,1995,16(2):166-172.
[16] Micale V,Maricchiolo G,Genovese L.The reproductive biology of the amberjack,Seriola dumerilii(Risso 1810).I.Oocyte development in captivity[J].Aquaculture Research,1999,30(5):349-355.
[17] Lee W K,Yang SW.Relationship between ovarian development and serum levels of gonadal steroid hormones and induction of oocyte maturation and ovulation in the cultured femaleKorean spotted sea bassLateolabrax maculatus(Jeom-nongeo)[J].Aquaculture,2002,207(1):169-183.
[18] Tyler C R,Sumpter JP,Witthames PR.The dynamics of oocyte grow th during vitellogenesis in the rainbow trout(Oncorhynchus mykiss)[J].Biology of Reproduction,1990,43(2):202-209.
[19] Johnson L L,Casillas E,M yers M S,et al.Patterns of oocyte development and related changes in plasma 17-β-estradiol,vitellogenin,and plasma chemistry in English soleParophrys vetulusGirard[J].Journal of Experimental Marine Biology and Ecology,1991,152(2):161-185.
[20] 韦 众,鲍传和.不同水体河鲀丰满度、性腺和肝脏指数的比较[J].安徽农业大学学报,1999,26(4):427-431.

