“蓝绿色”的氢氧化铜*——九年级化学教育教学叙事
廉 娇 祖 华
(1 抚顺市第五十中学 辽宁 抚顺 113008;2 抚顺市新抚区教师进修学校 辽宁 抚顺 113000)
一、案例产生背景
义务教育教科书九年级上册化学教材(人民教育出版社2012 年版)P21 实验1-6,是第一章课题3《走进化学实验室》中的一个演示实验,由于本节课介绍的实验仪器较多,讲授法可视性差,为了激发学生学习化学的兴趣, 我们学校将本节课的演示实验改为学生分组实验,同时可以最大化地观察到各种仪器的细节。
二、案例主题
本实验的内容是:用10mL 量筒量取2mL 氢氧化钠溶液,倒入试管中,然后用滴管向该试管中滴加硫酸铜溶液,观察有什么现象发生。 用试管夹夹住该试管(夹在距试管口约1/3 处),按图所示的正确加热方法加热,观察现象。 (本实验的目的是练习液体药品的取用和液体的加热方法。 )[1]
三、教学细节
实验台上有准备好的各种加热仪器,还有提前配制好的氢氧化钠溶液和硫酸铜溶液 (各溶液质量分数未知)。 所有小组的学生都做出实验中的沉淀了,然后对生成的沉淀进行加热。
加热时,有的同学举手问:“老师,蓝色沉淀变成黑色了,对吗? ”我点点头,表现出赞许的表情。
还有的同学举手问:“老师,我这个试管里的固体怎么不变黑呢?我这个现象对不对呀?”我观察了一下沉淀的颜色,发现沉淀呈蓝绿色,而且沉淀加热后始终没有变化。 我对这个现象也很好奇,但我对学生说:“实验的结果没有对与错, 你们可以讨论一下各自的实验方法。记住,留心实验中异常,你或许是未来的诺贝尔化学奖获得者。
学生对此提出了质疑,但由于自身知识水平有限不能解决这个问题。 于是我想对这种奇特的现象作以研究,希望能够对今后的教学有所帮助。
四、资料背景
经查阅资料了解[2-3],氢氧化钠与硫酸铜反应,会生成蓝色沉淀氢氧化铜[Cu(OH)2],还可能生成一种蓝绿色沉淀——碱式硫酸铜(Cu4(OH)6SO4),生成该物质的方程式为:4CuSO4+6NaOH═Cu4(OH)6SO4↓+3Na2SO4,查阅其理化性质[4]:
碱式硫酸铜:
英文名称:Cupric Sulfate,Basic
分子式: CuSO4·3Cu(OH)2
分子量: 452.29
性状:绿色单斜晶体,在水中溶解度极小,能溶于稀酸和氨水。
制法: 由硫酸铜和氢氧化钙或氢氧化钠反应制得。(需控制浓度)
加热后会产生氧化铜、二氧化硫和水。
氢氧化铜稍显两性,在浓碱中生成[Cu(OH)4]2-离子。
五、分析研究
那么在什么情况下会生成这种物质呢? 资料上没有介绍。 以下是探究碱式硫酸铜的产生条件的实验过程:
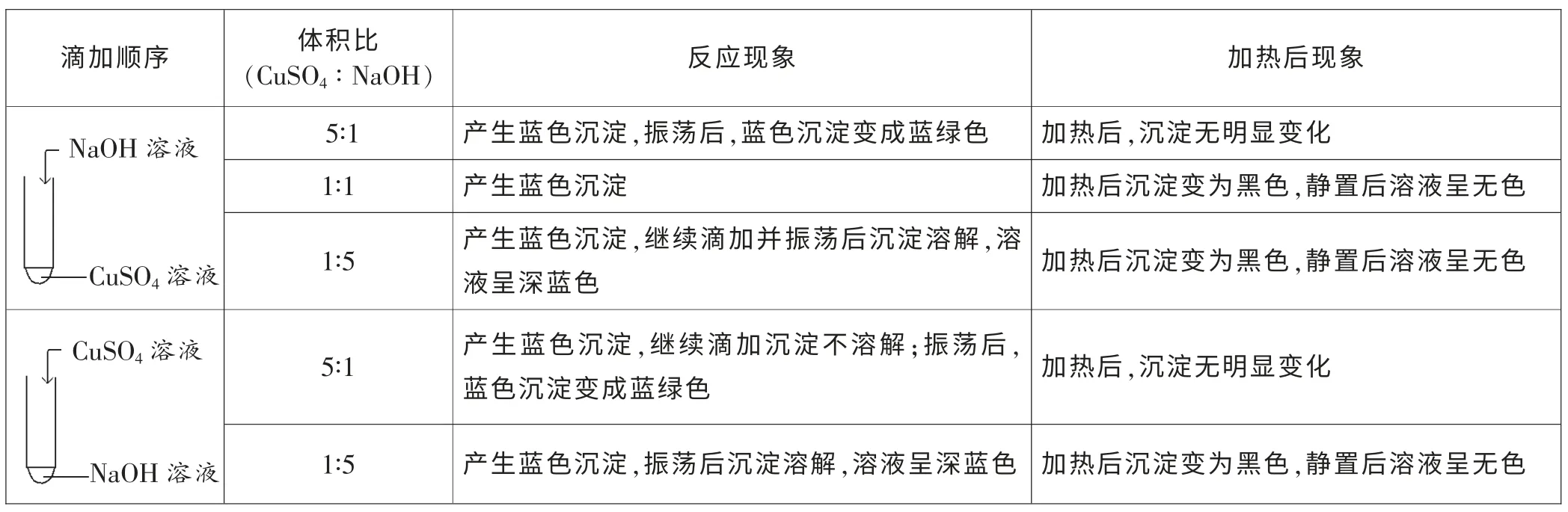
称取硫酸铜固体40g 加水至250mL 配成1mol/L 的硫酸铜溶液, 另外称取10g 氢氧化钠固体加水至250mL配成1mol/L 的氢氧化钠溶液[5]。
六、实验结果
硫酸铜溶液过量时,沉淀呈蓝绿色,并且加热时沉淀不溶解;氢氧化钠与硫酸铜恰好反应时,生成氢氧化铜沉淀,加热时沉淀由蓝色变为黑色;氢氧化钠过量时,沉淀溶解,加热后变成黑色固体。
实验现象与溶液滴加顺序无关。
七、结果分析
硫酸铜溶液呈酸性,硫酸铜溶液过量时,碱式硫酸铜在酸性条件下加热无明显变化; 氢氧化钠过量时,溶液呈碱性,加热时均能够看到产生黑色固体。
本实验的预期现象:滴加硫酸铜溶液后产生蓝色沉淀,加热该试管,沉淀由蓝色变为黑色。 出现特殊现象的原因是学生对物质反应没有量的概念,而两种物质溶液反应现象与量有直接影响关系。
八、建议
教材中针对两种物质溶液反应时,最好标注配制两种溶液的质量分数,或在教参中注明。 (本人配制CuSO4溶液物质的量浓度为1mol/L,质量分数约为14%;NaOH溶液物质的量浓度为1mol/L,质量分数约为4%,仅作参考)。
其次要标明滴加硫酸铜溶液的滴数,3-5 滴即可,建议教材说明硫酸铜溶液的用量, 以防学生任意用量,导致其他现象产生,给学生留下错误的印象。
[1] 人教社化学室. 义务教育教科书·化学(上册)[M].北京:人民教育出版社,2012:21
[2] 北师大等.无机化学(上册)[M].北京:高等教育出版社,1986:44
[3] 蔡云波,刘俊博.关于硫酸铜与氢氧化钙溶液反应产物的讨论[J].中学化学教学参考,2009,(1~2):39-40
[4] 百 度 百 科. 碱 式 硫 酸 铜. http:/ /baike.baidu.com/view/487213.htm
[5] 李颖,刘怀乐.对2005 年高考理综(Ⅲ)第27 题的实证分析[J].化学教育,2005,26(8):55-56

