野生观赏植物短梗大参种子萌发特性的研究
沈素贞,梁文斌,宋 雷
(中南林业科技大学,湖南 长沙 410004)
野生观赏植物短梗大参种子萌发特性的研究
沈素贞,梁文斌,宋 雷
(中南林业科技大学,湖南 长沙 410004)
以短梗大参种子为试验材料,通过光照、温度、基质、生长调节剂、沙藏处理,研究不同条件对其种子萌发特性的影响。结果表明:周期性光照条件下比全黑暗条件下萌发率高、萌发速度快;不同温度对种子萌发影响显著(p<0.05),15 ℃时萌发率最高,超过35 ℃时不萌发;不同基质对种子萌发率也有明显的影响,萌发率由高到低的基质依次为琼脂(27%)、滤纸(24%)、黄泥(15%)、沙子(13%)、珍珠岩(7%);萘乙酸和水杨酸对种子的萌发率无明显作用,赤霉素对种子的萌发率影响显著(p<0.05),且最适浓度为50 mg·L-1;沙藏处理可显著(p<0.05)促进种子萌发,萌发指数相比非沙藏增加3.4倍、萌发率提高2.0倍、开始萌发时间提前10 d、根长增加85.93%。
野生观赏植物; 短梗大参;种子;萌发特性
短梗大参Macropanax rosthornii为五加科Araliaceae大参属Macropanax灌木或小乔木, 主要分布在我国甘肃南部、四川西部和西南部以及湖南、湖北、江西等地。短梗大参枝叶繁茂,常绿,树型美观;其掌状复叶叶形独特,小叶5~7;花5~10朵,白色,排成伞形花序,复集成圆锥花序[1]。该植物花形大,花期长,具有较高的观赏价值。在华中和华南地区可过冬,非常适合作城市公园、风景区、居民小区等园林绿化树种,也可作为客厅、酒店、办公楼等场所的室内观赏树种。因此,短梗大参作为一种待开发利用的优良野生观赏植物,其应用前景将十分广阔。
由于短梗大参自然分布区域比较狭窄,野生资源储存量少,开发与利用程度也低。随着对短梗大参的研究和开发的深入,需要大量种源,因而人工栽培势在必行。在引种栽培中发现短梗大参种子存在发芽率低、出苗不整齐等问题,因此,如何有效提高该植物的萌发率是当前该植物引种栽培所面临的重要问题,然而,目前对其种子萌发特性的研究尚未见报道。本文将对短梗大参在不同条件下萌发情况进行比较研究,旨在提高其种子萌发率,探索人工栽培的有效途径,为短梗大参的苗木繁育和引种驯化提供参考。
1 材料与方法
1.1 试验材料
试验用种子于2011年12月采自湖南省永顺县短梗大参产地。
1.2 研究方法
1.2.1 种子形态及生活力测定
随机选取50粒饱满种子在体视镜下观察其形态,并用游标卡尺测量其长度与宽度,计算其平均值;千粒重采用百粒法,即随机选取600粒种子平均分成6组,用0.000 1 g电子天平称量其重量,计算平均值;种子生活力采用四氮唑( TTC )法测定[2]。
1.2.2 光照处理
以3层湿润滤纸作为基质,在25℃下,进行周期性光照(1500 lx,13.5 h·d-1)与全黑暗对照试验。每处理3次重复,每重复50粒种子。
1.2.3 温度处理
设置15℃、20℃、25℃、30℃、35℃ 5个温度梯度,在周期性光照(1500 lx,13.5 h·d-1)和以3层湿润滤纸为基质的培养条件下进行种子萌发试验。试验共设5个处理,每处理3个重复,每重复50粒种子。
1.2.4 基质处理
设置滤纸、珍珠岩、黄泥、沙子、琼脂5种基质,在 25℃、周期性光照(1500 lx,13.5 h·d-1)条件下进行萌发试验。试验共设5个处理,每处理3次重复,每重复50粒种子。
1.2.5 生长调节剂处理
试验采用二因素随机区组设计。生长调节剂种类为A因素,采用3种生长调节剂,分别为萘乙酸(NAA)、赤霉素(GA3)、水杨酸(PAS);生长调节剂浓度为B因素,设6个水平,分别为 0 mg·L-1、10 mg·L-1、50 mg·L-1、100 mg·L-1、200 mg·L-1、400 mg·L-1。25℃、周期性光照(1500 lx,13.5 h·d-1)条件下,以滤纸为基质进行萌发试验。试验共设18个处理(见表1),每处理3次重复,每重复50粒种子。

表1 生长调节剂处理试验设计Table 1 Design of hormone treatments
1.2.6 沙藏处理
将采集的种子在0~4 ℃下进行低温沙藏处理50 d,以不沙藏作为对照。在25 ℃、周期性光照(1500 lx,13.5 h·d-1)、以3层湿润滤纸为基质的条件下进行萌发试验。每处理3次重复,每重复50粒种子。
1.3 测定指标
测定种子的萌发率与萌发指数参考文献[3]。计算公式如下:

公式(2)中Gt表示第t天发芽数,Dt表示相应发芽天数。
试验过程中加去离子水数次以保持滤纸湿润,胚根伸出种皮2 mm 视为萌发[4],每天统计萌发数量。
1.4 数据处理
采用软件SPSS 19.0进行单因素方差分析(One-way ANOVA)和多重比较。
2 结果与分析
2.1 种子形态及生活力测定
短梗大参花期7~ 9月,果期10~12月[1]。其成熟果皮紫黑色,种子棕褐色,外部形态呈卵圆形,经测量其平均长度为4.28 mm,平均宽度为2.56 mm,长宽比为1.67;千粒重为10.36 g;经TTC法测定,种子平均生活力为79.3%。
2.2 光照对短梗大参种子萌发特性的影响
光照对短梗大参种子萌发特性的影响结果见表2。周期性光照条件下与完全黑暗条件下种子的萌发率分别为24.70%与17.70%,经统计检验分析两者无明显差异(p>0.05)。但在周期性光照条件下萌发种子的下胚轴粗壮且为淡绿色,而黑暗条件下萌发种子的下胚轴细弱且为淡黄色。

表2 光照对短梗大参种子萌发特性的影响Table 2 Effects of light time on seed germination characteristics of M. rosthornii
2.3 温度对短梗大参种子萌发特性的影响
温度对短梗大参种子萌发特性的影响结果如表3和图1所示。
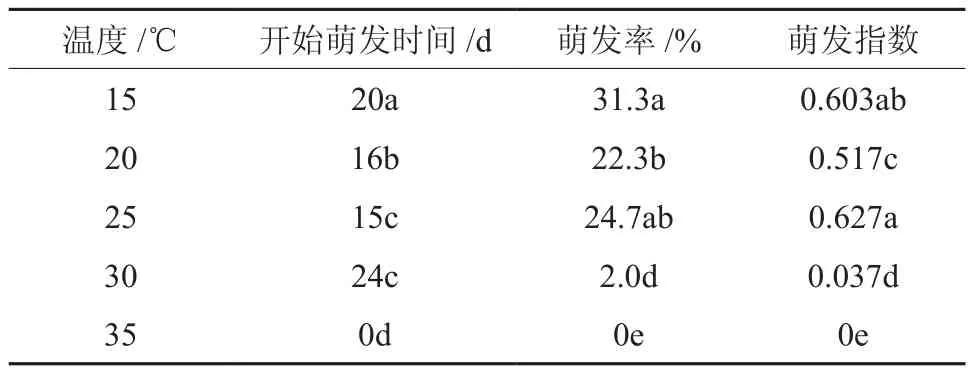
表3 温度对短梗大参种子萌发特性的影响†Table 3 Effects of different temperature treatments on seed germination characteristics of M. rosthornii

图1 不同温度下短梗大参种子逐日萌发进程Fig. 1 Daily seed germination course of M. rosthornii under different temperatures
由表3可知,在15℃~30℃条件下短梗大参均可萌发,但以15℃~25℃温度下为佳, 萌发率均达到了20 % 以上,与30℃相比差异显著(p<0.05);在35℃条件下未见种子萌发。
从图1中可以看出不同温度下短梗大参种子萌发的进程,在25℃条件下,种子萌发最早,在第15天时有4%的种子萌发,其次是20℃,在第16天有2%种子萌发,随着萌发时间的推移,种子逐日萌发百分数增加,萌发速率较均匀,至第25天萌发百分数达到最高,在25℃为24%,20℃为22%;在15℃条件下,种子萌发较晚,从第20天开始萌发,萌发百分数为2%,但萌发速率较快,从第23天至第24天萌发速率突然大幅度上升,萌发百分数由8%到28%,然后基本趋于稳定;30℃条件下,种子萌发最晚,第24天开始萌发,萌发百分数也低,仅为2%;在35℃条件下,未发现有种子萌发。
结合表3和图1可以发现短梗大参种子在15℃条件下萌发率最高;在25℃条件下最先萌发,萌发指数最大;通过以上分析可是,短梗大参适合在较低温度下萌发,最适萌发温度为15℃~25℃,短梗大参不适宜在较高温度条件下萌发。
2.4 不同基质对短梗大参种子萌发特性的影响
基质对种子萌发有重要影响,基质对短梗大参种子萌发特性的影响结果如图2所示。从图2中可以看出,不同基质间种子萌发率有显著差异(p<0.05)。由图2-a可知:琼脂和滤纸与其他基质间的发芽率存在显著差异,琼脂的发芽率最高,为27%,滤纸次之,为24 %;黄泥和沙子的萌发率较低,同为14 %左右;珍珠岩的萌发率最低,仅为7 %。由图2-b可知:滤纸、黄泥、沙子、琼脂的开始萌发时间相差不大,均在种子着床14 d开始萌发;珍珠岩萌发最慢,大约在种子着床17 d才开始萌发。从以上的分析可以看出,短梗大参种子萌发的基质以琼脂和滤纸为佳。
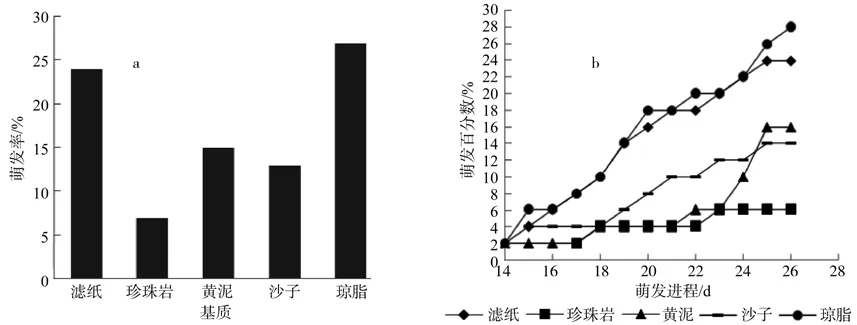
图2 不同基质对短梗大参种子萌发特性的影响Fig. 2 Effects of different substrates on seed germination characteristics of M. rosthornii
2.5 生长调节剂对短梗大参种子萌发特性的影响
生长调节剂对短梗大参种子萌发特性的影响结果如表4所示,并对其进行方差分析,结果见表5。

表4 不同生长调节剂种类和浓度对种子萌发的影响Table 4 Effects of different types hormone and different hormone concentrations on seed germination of M. rosthornii

表5 生长调节剂处理对萌发率影响的二因素分析Table 5 Two-factors analysis of hormone effect on germination rate
由表4和表5可知:
(1)不同的生长调节剂处理对种子萌发率的影响显著(p<0.05)。赤霉素处理萌发率最高,平均为27.53%,高于对照;萘乙酸和水杨酸处理结果相差不大,分别为15.5%和16.7%,均低于对照。由此可见:生长调节剂对种子萌发的作用不同,赤霉素可以促进种子萌发;萘乙酸和水杨酸促进种子萌发效果不显著。
(2)赤霉素的不同浓度处理,其萌发率差异显著(p<0.05)。赤霉素浓度在10 mg·L-1和50 mg·L-1时种子的萌发率显著高于对照,其中50 mg·L-1时的萌发率最高(41.3%);100 mg·L-1时种子的萌发率低于对照;200~400 mg·L-1时,种子的萌发率略高于对照。萘乙酸与水杨酸的不同浓度处理对短梗大参种子的萌发无明显促进作用。
2.6 沙藏对短梗大参种子萌发特性的影响
沙藏对短梗大参种子萌发特性的影响结果如表6所示。从表6可以看出,沙藏对种子的萌发特性影响显著(p<0.05):与非沙藏相比,沙藏处理后种子的萌发指数增加2.2,即增加了3.4倍;萌发率由24.0%增加至72.0%,提高了2.0倍;开始萌发时间提前10 d;根长增加14.54 mm,即增加85.93%。

表6 沙藏对种子萌发的影响†Table 6 Effects of different sand storage methods on seed germination
3 讨 论
3.1 光照、温度、基质对短梗大参种子萌发的影响
种子萌发需要充足的水分、适宜的温度和足够的氧气等环境条件。本试验结果表明,温度、光照、基质均能影响短梗大参种子的萌发,其中温度与基质影响显著。
根据964种野生植物种子对光反应的研究结果,约70%的种子照光促进萌发,27%的种子照光抑制萌发,尚有3%的种子不受光照的影响[5]。本研究发现光照虽不是短梗大参种子萌发的必需因素,但在适当光照条件下短梗大参种子的萌发率高,胚轴生长状况也较好。这与张俊等[6]研究刺楸种子萌发对光照的响应情况类似,这可能与光照可促进叶绿素的合成,进而进行光合作用,提供少量营养有关,同时也为幼苗的生长提供能量,有利于萌发后幼苗的生长。短梗大参种子萌发对光照的响应,说明其生态适应能力较强。
温度是影响短梗大参种子萌发的因素之一。短梗大参在15℃~30℃条件下均可萌发,以15℃~25℃ 温度下为佳,但到30℃萌发率显著降低,温度达到35℃时,种子不能萌发,这可能与高温抑制了种子中对温度敏感的酶的活力有关。种子在萌发过程中进行着活跃的代谢反应,在一定温度范围内,随温度的升高种子萌发进程加快,但过低和过高的温度都会降低膜的透性、膜结合的活性和酶变性而影响种子的萌发[7-8]。因而短梗大参种子的播种期以3月份为佳,与同属五加科的八角金盘的播种期一致[9]。本研究还发现,在15℃条件下,短梗大参种子萌发率比较高,这与刘财富等[10]对五加科刺揪种子的萌发温度研究结果相一致,种子萌发的最适宜温度与原产地和物种有密切关系[11]。但15℃短梗大参种子萌发的所需时间较长,这可能与低温条件下种子吸水困难,内部大分子贮藏物质的降解与转化所需时间较长有关。短梗大参种子的萌发对温度的这种响应模式,可保证大部分种子在适宜的季节萌发,有利于幼苗的存活。对它自身的生长环境具有积极意义,因此探明其萌发的适宜温度,对今后短梗大参的栽培、引种有重要作用。
在不同的基质条件下,短梗大参种子的萌发率变化显著:琼脂(27%)>滤纸(24%)>黄泥(15%)>沙子(13%)>珍珠岩(7%)。这可能是由于黄泥跟沙子透气性差导致氧气不足,而珍珠岩的保水性差无法满足萌发所需条件。在实地调查中也发现野生短梗大参分布区域狭窄,在腐殖质丰富、土壤肥沃,坡度较缓的地方生长良好。本试验研究结果与陈白冰等[12]关于不同栽培基质对短梗大参幼苗生长影响的研究一致,他认为,短梗大参幼苗生长的最佳基质需具备丰富的养分、基质整体的透气性和优良的保水保肥性。短梗大参种子萌发对不同基质的反应也表明,其萌发需要充足的氧气、一定的湿度和适当的营养物质才能达到更好的萌发效果。人工育种时为保证其萌发率及幼苗成活率应注意土壤透气性、湿度、肥力等问题。
短梗大参种子萌发的适宜温度为15℃~25℃,且在15℃条件下萌发率最高但萌发时间较长,因此在春季可以提早播种,以3月中上旬为佳,可提高其萌发率,较宽萌发温度也说明短梗大参生态适应性强,适合引种驯化;短梗大参种子的萌发及幼苗的生长都受到基质的影响,因此播种时需选用土粒细碎、肥沃的土壤,播种前应进行翻耕,并用喷灌喷足水,为种子萌发提供良好的环境;光照虽不是短梗大参种子萌发的必需因素,但适宜的光照对其萌发及幼苗生长都有积极意义,因此大田播种时不能深藏,应在较浅的土层,播种时覆盖土层1~2 cm 即可。
3.2 生长调节剂对短梗大参种子萌发的影响
本试验表明,外源生长调节剂对短梗大参萌发有较大的影响,其中种子经50 mg·L-1的赤霉素处理后,其萌发率可由24%提高至41.3%。这是由于种子的自身遗传因素,含激素水平较低,当适量加入外源生长调节剂时,生长调节剂与受体结合引起信号的传导,导致特定基因的表达,提高种子的活力[13]。本研究也表明,赤霉素处理可明显提高短梗大参种子的萌发率。赤霉素促进种子萌发所需浓度因物种不同也有很大差异,400 mg·L-1GA3可有效提高白刺种子萌发率[14],促进报春花种子萌发的最佳GA3浓度为10~20 mg·L-1[15],同属五加科的刺五加种子在GA3浓度为2.75 mg·L-1时,萌发率最高[16]。本试验则表明50 mg·L-1赤霉素处理的短梗大参种子萌发率最高。有关水杨酸和萘乙酸对种子萌发影响的研究较少,但张林静认为低浓度 (0. 01 mmol·L-1,0. 05 mmol·L-1)萘乙酸(NAA)和 中 浓 度 (0.01 mmol·L-1~ 0.10 mmol·L-1)水杨酸(SA)可促进山茱萸种子的萌发[17],而本研究则发现,萘乙酸与水杨酸对短梗大参种子的萌发并无促进作用。外源激素对种子萌发的影响因物种的不同而存在很大的差异,可能是由于不同物种的种子本身休眠程度、基因类型以及萌发机制不同引起。
3.3 低温沙藏对短梗大参种子萌发的影响
沙藏可提高种子萌发率,已经在刺五加、刺楸、东北刺人参[6,18-19]等其他五加科种子萌发试验中取得良好的效果。本试验发现,低温沙藏后短梗大参种子的萌发率由24%提高至72%。沙藏显著提高了短梗大参种子的萌发率,且能达到齐苗,壮苗的目的。沙藏可促进种子萌发大致可概括为大分子的贮藏物质进行降解,转化为可溶性的各种可供胚的代谢、生长过程所利用的物质[20]。王占红对黄精沙种子藏研究也表明,沙藏后种子可溶性蛋白和可溶性糖含量增加,脂肪与淀粉含量降低,也说明沙藏提高了种子内酶的活性,促使大分子物质降解和新物质的合成,为新组织形成和胚萌发提供必要的物质基础,有利于种子萌发[21]。沙藏能显著提高短梗大参种子的萌发率这个现象还有待于从生理生化变化以及各物质之间的内在联系等方面进行深入的研究。
4 结 论
(1) 光照不是短梗大参种子萌发的必需因素,但相比黑暗,周期性光照使种子的萌发率稍高、萌发速度较快。
(2) 温度显著影响短梗大参种子的萌发,15℃时萌发率最高但萌发时间较长;最适宜的萌发温度为15℃~25℃;当温度超过35℃时不萌发。
(3) 不同基质对种子萌发率有明显的影响,萌发率由高到低的基质依次为琼脂、滤纸、黄泥、沙子、珍珠岩。
(4) 赤霉素处理显著促进种子的萌发,在浓度为50 mg·L-1时种子萌发率最高,而萘乙酸与水杨酸则无明显促进作用。
(5) 沙藏可以显著提高种子的萌发率、缩短萌发时间及增加根的长度。
[1] 中科院中国植物志编委会.中国植物志(第五十四卷)[M].北京: 科学出版社,1978.
[2] 李合生,孙 群,赵世杰.植物生理生化试验原理和技术[M].北京: 高等教育出版社,2000.
[3] 亚吉东,李树珍,申仕康,等.荠菜种子萌发特性[J].种子,2009, 28 (1): 37-40.
[4] 陈志欣,郑 丽,兰芹英,等.‘勐海大叶茶’种子萌发特性[J].植物分类与资源学报,2012,34 (1): 63-68.
[5] 郑光华.种子生理研究[M].北京:科学出版社,2004.
[6] 张 俊,徐光余,何进义.刺楸繁育途径的研究[J]. 农技服务,2008,25(7):137-139.
[7] Gul B,Weber D J. Effects of salinity, light and temperature on germination in Allenrolfea occidentalis [J].Canadian Journal of Botany, 1999, 77:240-246.
[8] Gulzar S, KhanM A. Seed germination of halophytic grass Aeluropus lag opoides [J]. Annals of Botany, 2001, 87: 319-324.
[9] 毛世忠,周太久.八角金盘播种试验研究[J].黑龙江农业科学,2008,(6):91-92.
[10] 刘财富,庞家清,张云江,等.刺揪种子的发芽温度[J].吉林林业科技,1998,(4):24-25.
[11] 张 勇,薛林贵,高天鹏,等.荒漠植物种子萌发研究进展[J].中国沙漠,2005,25(1):107-112.
[12] 陈白冰,梁文斌,聂东伶,等.不同栽培基质对短梗大参幼苗生长的影响[J].经济林研究,2011,29(3):40-44 .
[13] 王 毅.半夏种子萌发特性研究[D].兰州:甘肃农业大学学位论文, 2006.
[14] 王瑞萍.白刺属两种植物的种子萌发特性及幼苗耐盐性的研究[D].呼和浩特:内蒙古大学学位论文,2010.
[15] 吴之坤,张长芹,程治英.不同培养基质及条件对三种报春花种子萌发及幼苗生长的影响[J].种子,2005,24(4):1-5.
[16] 顾地周,高捍东.刺五加种子快速萌发条件研究[J].种子,2010, 29(10): 67-69.
[17] 张林静,原跃军,王诚刚,等.水杨酸和萘乙酸对山茱萸种子萌发的生理学影响[J].山西师范大学学报,2006,20(4):75-79.
[18] 邢朝斌,沈海龙,黄 剑,等.不同温度、时间层积处理对刺五加种子发芽的影响[J].辽宁林业科技,2006,(5):9-11.
[19] 刘继生,罗广军,李明哲.东北刺人参种子繁殖关键技术[J].多种经营,2007,(11):33.
[20] 郑光华.种子生理研究[M].北京:科学出版社,2004:316.
[21] 王占红,蒋 花,王 瑾,等.不同沙藏处理对黄精种子内贮藏物质及萌发的影响[J].种子,2012,31(2):91-93.
Study on seed germination characteristics of wild ornamental Macropanax rosthornii
SHEN Su-zhen, LIANG Wen-bin, SONG Lei
(Central South University of Forestry &Technology, Changsha 41004, Hunan, China)
The experiments were conducted to investigate the effects of different lights, temperatures, substrates, growth regulators and stratifcation treatments of on seed germination of Macropanax rosthornii. The results show that the germination rate and germination velocity were higher under the periodic light conditions than in dark. Different temperatures influenced seed germination signifcantly(p< 0.05); the seed germination rate was highest at 15 ℃ but the seed can not germinate above 35 ℃ ; the substrates were also important factors that affected the seed germination signifcantly and from high to low of germination rate were agar(27%), flter paper(24%),soil(15%), sand(13%), perlite(7%); The effects of NAA and salicylic acid on germination rate of M. rosthornii seeds were not notable,GA3 had a signifcant effect on germination of seed(p < 0.05), and its optimal concentration was 50 mg·L-1; the treatments of stratifcation effected seed germination signifcantly(p<0.05); the sand storage increased the seed germination index by 3.4 times,the germination rate increased by 2.0 times, the time of germination advanced by 10 days and the root length increased by 85.93% as compared with those in the non-sand storage.
wild ornamental plant; Macropanax rosthornii; seed; germination characteristics
S727.3;S684
A
1673-923X(2013)08-0057-06
2013-01-16
湖南省教育厅科学研究重点项目(11A130)
沈素贞(1989-),女,河南平顶山人,硕士,从事植物学研究
梁文斌,副教授,主要从事植物学研究;E-mail:topeasie@163.com
[本文编校:吴 彬]

