杜仲MVA途径相关基因的鉴定及荧光定量PCR引物筛选
叶生晶 ,乌云塔娜 ,田大伦 ,许靖诗
(1. 中南林业科技大学 生命科学与技术学院,湖南 长沙 410004;2. 南方林业生态应用技术国家工程实验室,湖南 长沙 410004;3. 中南林业科技大学 林学院,湖南 长沙 410004;4. 经济林育种与栽培国家林业局重点实验室,湖南 长沙 410004)
杜仲MVA途径相关基因的鉴定及荧光定量PCR引物筛选
叶生晶1,2,乌云塔娜3,4,田大伦1,2,许靖诗3,4
(1. 中南林业科技大学 生命科学与技术学院,湖南 长沙 410004;2. 南方林业生态应用技术国家工程实验室,湖南 长沙 410004;3. 中南林业科技大学 林学院,湖南 长沙 410004;4. 经济林育种与栽培国家林业局重点实验室,湖南 长沙 410004)
杜仲富含萜类物质,MVA途径是萜类物质合成的重要途径之一。从杜仲果实转录组数据KEGG中杜仲MVA途径共被注释30条Unigene,根据NCBI中的BLAST比较,分别鉴定了乙酰COA酰基转移酶,羟甲基戊二酰辅酶a合成酶,羟甲基戊二酰辅酶a还原酶,甲羟戊酸激酶,磷酸甲羟戊酸激酶,二磷酸甲羟戊酸脱羧酶基因,被注释7条,3条,11条,2条,2条,5条。表达差异分析表明,以上基因中分别为5条,3条,4条,1条,5条为幼果和成熟果实差异表达基因。对差异表达基因序列进行软件设计、引物特异性分析和实验验证,最终筛选出10对适合杜仲MVA途径SYBR GreenI荧光定量PCR的引物,为MVA途径基因表达差异研究及萜类物质积累的分子机理研究提供重要依据。
杜仲;萜类合成MVA途径;荧光定量PCR;引物筛选
杜仲是我国特有的名贵树种。杜仲果皮、树叶、树皮等组织均含有丰富的杜仲胶,是杜仲次生代谢途径产生的萜类高分子化合物[1]。早在1892年,法国人Ernest发现杜仲胶的化学成分是萜类反式聚异戊二烯[2]。Lynen等提出了萜类合成是由位于细胞质的甲羟戊酸(Mevalonate, MVA)途径完成[3-4]。MVA途径的下游产物法呢基二磷酸(FPP)是植物体内甾体、皂甙、倍半萜、橡胶等许多萜类衍生物质的合成前体,这些物质在植物的生长发育或抗病过程中具有重要作用[5]。甲羟戊酸(MVA)是经过3个分子的乙酰辅酶A的缩合反应,经由乙酰辅酶A和3-羟基-3-甲基戊二酰辅酶A而合成的,再经过磷酸化和脱羧反应后形成异戊烯基焦磷酸(IPP)。这一途径主要存在与细胞质中,又称为细胞质途径。MVA途径的所有酶都已从动物和植物系统分离出来进行深入研究。Jiang等[6](2006)从杜仲橡胶中克隆到杜仲MVA途径的重要酶羟甲基戊二酰CoA还原酶(HMGR)的一个基因EuHMGR。
实时荧光定量PCR技术是当前最新的确定基因表达的方法,它自问世以来在基础科学研究、临床诊断疾病研究及药物研发等领域取得了较大的成绩。虽然在植物研究方面应用起步较晚,但是就其技术原理来说,在植物研究中具有广泛的应用前景[7]。实时定量PCR不仅能实现对核酸快速、灵敏、高效特异检测,还可以对目的基因的起始量进行精确定量。Czechowski等[8]使用 Real- timePCR 研究1 400多个拟南芥转录因子在根组织和茎组织的特异表达情况,认为荧光定量PCR是研究转录因子的优势方法;张中保等[9]应用实时荧光定量PCR对玉米在水分胁迫下诱导基因的表达模式进行分析,结果与cDNA Macroarray的结果一致;王小花等[10]利用荧光定量PCR检测大豆转基因成分,结果在6个含豆类的制品中检测出燕麦饼干为转基因食品。代晓燕等[11]在烟草Nt-syr1基因实时荧光定量PCR检测中发现,烟株打顶后1 h,Nt-syr1基因在叶片中的表达量约是同时期不打顶出来的480倍。
目前常用的荧光定量PCR检测模式主要有两种:荧光染料检测和荧光水解探针检测。常用的染料为SYBR Green I。荧光染料法的优点(1)检测方法简便,(2)检测成本低。不足之处是荧光染料能与所有DNA双链结合,在PCR过程中,引物二聚体,单链二级结构以及错误扩增产物等都会增加荧光值,从而影响定量结果[12]。因此,SYBR Green I荧光定量PCR方法中的引物设计是影响实验结果的重要因素。
本研究以杜仲转录组测序得到的MVA萜类物质合成途径的Unigene为模板,设计筛选适合SYBR Green I荧光定量PCR的引物。
1 材料与方法
1.1 实验材料
1.1.1 植物材料
植物材料选取河南省郑州市国家林业局泡桐开发研究中心提供的‘华仲6号’杜仲成熟果,采样后用液氮运输,然后放入超低温冰箱-80℃保存。
1.1.2 实验试剂
主要有:Omega公司RNA提取试剂盒、天跟公司Quant cDNA第一链合成试剂盒、β-巯基乙醇、乙二胺四乙酸二钠、无水乙醇、硼酸、丙烯酰胺、甲叉双丙烯酰胺、过硫酸铵、四甲基乙二胺、溴酚蓝、Tris、HCl、NaOH、DNAMarker。
1.1.3 仪器设备
主要仪器有:冰箱、液氮罐、高压灭菌锅、天平、烧杯、玻璃棒、研钵、离心机、离心管、恒温水浴锅、涡旋振荡器、移液枪、电泳仪水平电泳槽、稳压直流电泳仪、PCR仪、凝胶成像系统。
1.2 实验方法
1.2.1 引物设计
以转录组测序得到的杜仲果实萜类物质合成MVA途径的30条Unigene为模板,根据根据SYBR Green I荧光定量PCR引物要求,用Primer 5软件设计设计荧光定量PCR引物。荧光定量PCR引物设计主要要求:(1)产物不能形成二级结构;(2)引物长度一般在18~30个碱基之间,上下游引物不能相差太大;(3)G+C含量在40%~60%之间,45~55%最佳;(4)碱基要随机分布,尽量均匀。引物3’端碱基不能有多于3个连续的G和C;(5)做荧光定量产物长度80~150 bp最好,最长是300 bp;(6)提高退火温度可以增加PCR反应的特异性。
1.2.2 Primer-Blast及合成
将设计好的引物在NCBI的Blast上进行引物特异性检测。Primer-BLAST界面有BLAST的功能。方法如下:(1)在“PCR Template”的文本框中输入模板序列。(2)在Primer Parameters区填入引物,并选择好验证的目标数据库。重要的一步是在specifcity check区,选择验证引物的物种,其他默认。就可以检测出目前数据库中被测引物的特异性。检测出来的特异性引物由南京金斯瑞公司合成。
1.2.3 总RNA的提取及反转录
总RNA提取按OMEGA公司的植物RNA提取试剂盒说明书进行,提取的总RNA用1.5%的琼脂糖凝胶电泳检测。并且按照天跟公司的Quant cDNA第一链合成试剂盒说明书,将样品总RNA反转录合成cDNA第一链。将获得的cDNA第一链保存在-20℃的冰箱备用。
1.2.4 普通PCR扩增
用Primer-Blast选出的引物进行普通降落PCR扩增。退火温度从65℃降至50℃,每5个循环降3℃。反应总体系为 25 μL,模板 cDNA2 μL,2×Taq PCR MasterMix8 μL,引物 1 μL,加 ddH2O 至 25 μL。
1.2.5 电泳检测
PCR扩增完成后,用8%的聚丙烯酰胺凝胶电泳进行检查。(1)清洗玻璃板,将平板和凹板在自来水下清洗干净,再用蒸馏水冲洗。等玻璃板晾干后,将板四边对齐放入灌胶架固定,准备灌胶;(2)灌胶,依次在烧杯中加入6 mL ddH2O,2 mL5×TBE,2 mL 40%丙烯酰胺母液,100 μL 过硫酸铵和 80 μL TEMED(四甲基乙二胺),混匀后立即将混合液用移液枪沿凹板上方斜边均匀地灌入平板,使胶液与平板上沿成一条直线,迅速将梳子(10孔)插入胶液,尽量避免有气泡出现,凝固1小时;(3)点样,待胶凝固后,拔出梳子,将玻璃板固定到垂直电泳槽内,电泳槽加入1×TBE缓冲液至淹没平板。用移液枪将maker(2 μL)和样品(3 μL)依次加入点样孔中;(4)电泳检测,
盖好电泳槽盖并连接好电源线,在110 V电压条件下电泳60 min。电泳结束后,撬开玻璃板,在胶下方切除一个小角做标记,然后用溴酚蓝染色60 min。最后用BIO_RAD凝胶成像系统照相做分析。
2 结果与分析
2.1 杜仲转录组MVA相关Unigene基因的确定
从杜仲幼果和成熟果实的转录组数据中发现,MVA途径共有30条Unigene被注释(如表1)。其中ACOT基因有7条,与烟草、胡黄连、油茶、伊乐假单胞菌的ACOT基因相似性达到81%~94%,命名为杜仲的ACOT基因,记为EuACOT1-7;HMGS基因有3条,与喜树、烟草属观赏烟的HMGS基因相似性达到61%~89%,命名为杜仲的HMGS基因, 记为EuHMGS1-3;HMGR基因有11条,与喜树、马铃薯、烟草等植物的HMGR基因相似性达到53%~99%,命名为杜仲的HMGR基因, 记为EuHMGR1-11;MK基因有2条,与橡胶树、拟南芥的MK基因相似性达到78%~83%,命名为杜仲的MK基因, 记为EuMK1和EuMK2;PMK基因有2条,与橡胶树、烟草属观赏烟的MK基因相似性达到77%~83%,命名为杜仲的PMK基因, 记为EuPMK1和EuPMK2;MDP基因有5条Unigene与橡胶树、烟草属观赏烟等植物的MDP基因相似性达到82%~95%,命名为杜仲的MDP基因, 记为EuMDP1-5。
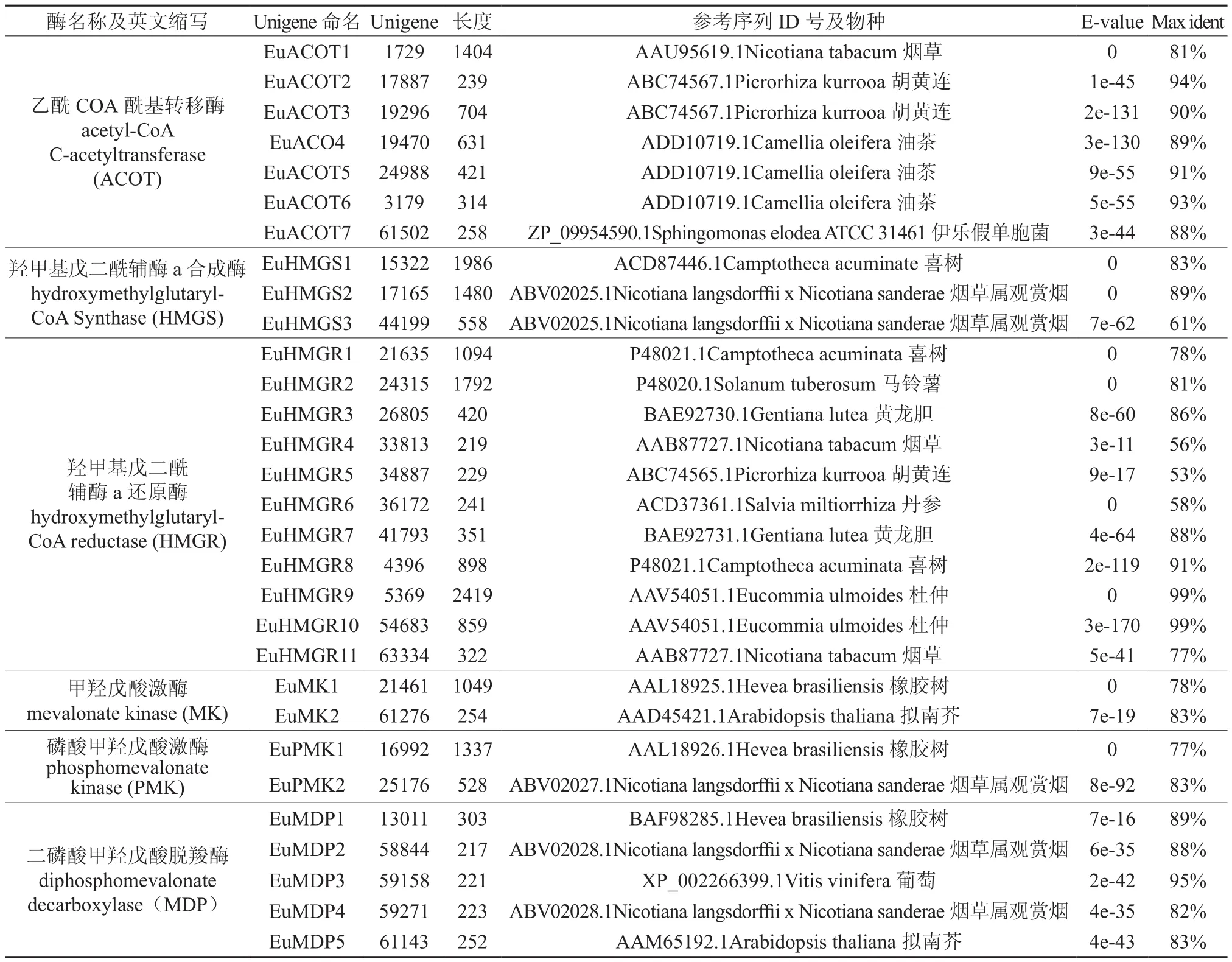
表1 MVA合成途径中相关酶基因和对应Unigene相似度信息Table 1 Information of similarity between gene and Unigene in MVA acid synthesis pathway
2.2 杜仲MVA途径相关基因表达量差异
从MVA途径各基因的表达量看出(如图1~图7),ACOT家族的成员EuACOT7基因在幼果中不表达,其它成员在幼果和成熟果实均有表达,且在幼果中的表达量大于成熟果实;HMGS家族各成员在幼果和成熟果实中均有表达,且在幼果中的表达量大于成熟果实;HMGR家族的EuHMGR4、EuHMGR5在成熟果中不表达,EuHMGR10在幼果中的不表达,且EuHMGR1、EuHMGR8、EuHMGR9在成熟果实中的表达量大于 幼 果,EuHMGR2、EuHMGR3、 EuHMGR6、EuHMGR7、EuHMGR11在幼果中的表达量大于成熟果实;MK家族各成员在幼果和成熟果均有表达,且在幼果中的表达量大于成熟果实;PMK家族各成员在幼果和成熟果均有表达,且在幼果中的表达量大于成熟果实;MDP家族各成员在幼果和成熟果均有表达,且在幼果中的表达量大于成熟果实。

图1 EuACOT家族各基因表达量Fig. 1 Gene expression of EuACOT family

图2 EuHMGS家族各基因表达量Fig. 2 Gene expression of EuHMGS family

图3 EuHMGR家族各基因表达量Fig. 3 Gene expression of EuHMGR family

图4 EuMK家族各基因表达量Fig. 4 Gene expression of EuMK family

图5 EuPMK家族各基因表达量Fig. 5 Gene expression of EuPMK family
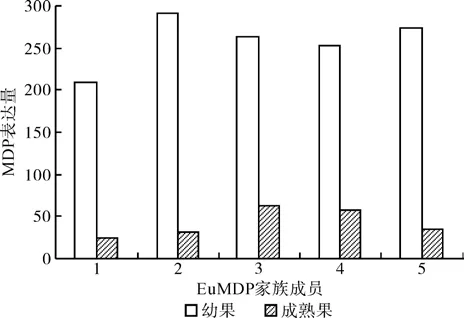
图6 EuMDP家族各基因表达量Fig. 6 Gene expression of EuMDP family
杜仲幼果和成熟果实MVA途径基因的表达量差异见表2。从表中可看出, EuACOT7和EuHMGR10在幼果中的表达量为0,说明在成熟果实中特异表达;EuHMGR4和EuHMGR5在成熟果中的表达量为0,说明在幼果中特异表达。而其它基因在幼果和成熟果实中均有表达,且ACTO家族除EuACOT1、 EuACOT7其余所有的成员在幼果和成熟果实中的表达量存在显著差异;HMGS家族所有成员在幼果和成熟果实中的表达量均存在显著差异;HMGR家族的EuHMGR1、EuHMGR2、 EuHMGR8、EuHMGR10在幼果和成熟果实中的表达量存在显著差异;MK家族各成员在幼果和成熟果实中的表达量均存在显著差异;PMK家族的EuPMK1在幼果和成熟果实中的表达量均存在显著差异;MDP家族所有成员在幼果和成熟果实中的表达量均存在显著差异。因此,除在幼果或成熟果表达量为0,表达量在幼果和成熟果实无显著差异的基因,即EuACOT7、EuHMGR10、EuHMGR4、EuHMGR5、EuACOT1、EuHMGR2、EuHMGR6、EuHMGR7、EuHMGR9、EuHMGR11、EuPMK2, 对 其 余 19条基因根据其序列设计荧光定量PCR引物。
2.3 MVA途径相关基因荧光定量PCR特异引物筛选
用Primer 5软件共设计引物450条,根据荧光定量PCR引物设计要求,根据引物长度、扩增产物长度、碱基分布等条件从中筛选出符合荧光定量PCR的引物共108条。将这108条引物在NCBI上进行引物Blast,结果ACOT家族 的EuACOT5;HMGR家 族 的EuHMGR2、EuHMGR8引物均无特异性,得到其余16条基因的引物是有特异性的引物。

表2 MVA途径相关基因在杜仲幼果和成熟果中的表达多样性Table 2 Diversity of expression of genes related in MVA of young fruit and fruits

图7 聚丙烯凝胶电泳结果Fig.7 Results of polypropylene gel electrophoresis
将合成的16对引物进行聚丙烯凝胶电泳检测(如图7)结果表明,有10个条带2、3、5、7、9、12、13、14、15、16扩增条带单一,条带清晰,且扩增产物在75~250 bp之间,故有10对引物可用于荧光定量PCR的引物。分别为ACOT家族的EuACOT3;HMGS家族的EuHMGS2、EuHMGS3;MK家 族 的EuMK1;PMK家 族 的EuPMK1;MDP 家 族 的 EuMDP1、EuMDP2、EuMDP3、EuMDP4、EuMDP5。因此有5个基因ACOT、HMGS、MK、PMK、MDP的10对引物可以用于杜仲MVA途径的SYBR Green I荧光定量PCR,其引物序列、TM值及产物长度如表3。

表3 荧光定量PCR的引物Table 3 Primers of fluorescence quantitative PCR
3 讨 论
SYBR Green I荧光定量PCR对引物的设计要求很高,荧光染料SYBR Green I可以与任何DNA双链结合产生荧光信号,因此引物设计是影响荧光定量PCR实验成功与否的关键[12]。
以往的引物设计都是在Genbank或者文献中中查找基因序列来设计引物,影响PCR实验结果的外在因素繁多而复杂[13]。而本研究是在转录组测序的条件下的引物特异性筛查是确保实验成功的关键之一。
本研究在杜仲萜类物质合成MVA途径的6个基因中只得到5个基因的可用于SYBR Green I荧光定量PCR的引物,HMGR由于Unigene表达量、Unigene自身序列大小以及引物特异性问题,未得到适合SYBR Green I荧光定量PCR的引物,后续研究可以用其他方法设计引物,使MVA途径的6个基因的荧光定量PCR引物数据完整。
实时荧光定量PCR可用于植物基因差异表达的分析研究,比较不同基因型,不同发育阶段或生长条件下的细胞或个体在基因表达上的差异,是研究分子调控机制的重要组成部分[14-15]。MVA途径的下游产物法呢基二磷酸(FPP)是植物体内甾体、皂甙、倍半萜、橡胶等许多萜类衍生物质的合成前体[7]。因此,可以用本研究得到荧光定量PCR引物做萜类物质合成MVA途径各基因的表达差异分析,从而揭示杜仲胶合成基因调控机制。
[1] 严瑞芳. 杜仲胶研究进展及发展前景[J].化学进展,1995,7(1):65-71.
[2] F. Ernest Weiss B.Sc., F.L.S. The Caoutchouc-containing Cells of Eucommia ulmoides, Oliver. Transactions of the Linnean Society of London.and Seriers:Bontany[J]. 1982,3(8):243-254.
[3] Lynen F, Efferer H, Henning U, et al. Farnesyl-pyrophosphat and 3-Methyl-Δ3-butenyl-1-pyropho-sphat, die biologischen Vorstufen des Squalens. Zur Biosynthese der Terpene, III [J].Angewandte Chemie, 1958, 70(24):738-742.
[4] Chaykin S, Law J, Phillips A H, et al. Phosphorylated Intermediates in the Synthesis of Squalene[J]. Proc. N. A. S,1958,44(10):998-1004.
[5] 周明兵,肖月华,朱冬雪,等.杜仲胶合成相关基因EuFPS的克隆及序列分析[J].分子植物育种,2003,1(1) :61-71.
[6] Jiang J, Kai G, Cao X, et al. Molecularcloning of a HMGCoA reductase gene from Eucommia ulmoides Oliver[J]. Biosci Rep,2006, 26(2): 171-181.
[7] 徐小刚,刘雅婷.实时荧光定量PCR在植物病害中的应用[J].中国农学通报,2009,25(7):52-56.
[8] Czechowaki T. Real- time RT- PCR profiling of over 1 400 Arabidopsistranscription factors:unprecedented sensitivity reveals novel root and shoot-specific genes[J].Plant J, 2004,38(2): 366-379.
[9] 张中保,李会勇,石云素,等.应用实时荧光定量PCR分析玉米水分胁迫诱导基因的表达模式[J].植物遗传资源学报,2004, 8(4):421-425.
[10] 王小花,李建祥,王国卿,等.SYBR Green实时荧光定量PCR检测大豆转基因成分[J].食品科学,2009,30(8):171-176.
[11] 代晓燕,苏以荣,魏文学,等.在烟草Nt-syr1基因实时荧光定量PCR检测[J].中国烟草科学,2008,29(3):20-28.
[12] 马月萍,戴思兰,马艳蓉.荧光定量 PCR 技术在植物研究中的应用[J].生物技术通报,2011,34(7):37-45.
[13] 申志勇. PCR引物特异性评估体系及多重PCR引物设计系统的构建与应用[D].中国人民解放军军事医学科学院,2009.
[14] 李铁柱, 杜红岩, 刘慧敏, 等. 杜仲幼果和成熟果实转录组数据组装及基因功能注释[J]. 中南林业科技大学学报, 2012,32(10): 9-17.
[15] 李铁柱, 杜红岩, 刘慧敏, 等. 杜仲果实和叶片转录组数据组装及基因功能注释[J]. 中南林业科技大学学报, 2012, 32(11):122-130.
Related gene identifcation of MVA pathway and primers screening of real-time PCR in Eucommia ulmoides
YE Sheng-jing1,2, WUYUN Ta-na3,4, TIAN Da-lun1,2, XU Jing-shi3,4
(1. School of Life Science and Technology, Central South University of Forestry and Technology, Changsha 410004, Hunan, China;2. National Engineering Lab. for Applied Technology of Forestry & Ecology in South China, Changsha 410004, Hunan, China;3.School of Forestry, Central South University of Forestry and Technology, Changsha 410004, Hunan, China;4. Key Lab of Non-wood Forest Product of Forestry Ministry, Changsha 410004, Hunan, China)
Eucommia ulmoides Oliv. is a famous Chinese endemic medicinal tree being rich of terpenoids, and MVA pathway is one important way of terpenoids synthesis. From KEGG, the transcriptome data of eucommia fruit, the MVA pathway has been annotated 30 Unigene; according to BLAST comparison in NCBI, acetyl-CoA C-acetyltransferase, hydroxymethylglutaryl-CoA synthase,hydroxymethylglutaryl-CoA reductase, mevalonate kinase, phosphomevalonate kinase, and diphosphomevalonate decarboxylase were identifed and respectively annotated 7, 3, 11, 2, 2, 5 genes. The differences analysis of gene expression showed that of the six enzymes’ annotated genes, there respectively were 5, 3, 4, 1, 5 genes which were the differentially expressed genes of the young fruit and mature fruit. We conducted The software design for the sequences of differentially expressed genes, analysis for specifc primers and experiment validation were conducted, and ultimately 10 suitable primers for SYBR GreenI real-time PCR in MVA pathway of E.ulmoides were selected. The results provide an important basis for researching the gene expression differences with MVA pathway and the molecular mechanism of terpenoid accumulation.
Eucommia ulmoides; MVA pathway of terpenoids synthesis;real-time PCR; primer screening
S727.3
A
1673-923X(2013)08-0050-07
2012-10-16
林业公益性行业科研专项(201004029)
叶生晶(1986-),男,甘肃武威人,硕士研究生,研究方向为城市生态学;E-mail:jingjing2581@163.com
乌云塔娜(1975-),女,内蒙古通辽人,教授,博士,主要从事经济林育种与栽培的研究;E-mail:tanatana@sina.com
[本文编校:吴 彬]

