基于双生子样本的婴儿乙肝疫苗低/无免疫应答的围生期相关因素分析
曹 芳 蔡文萍 严 恺 李 艳 许睿玮 陈少科 赵 倩 魏 欣 石小翔 严卫丽,6
·论著·
基于双生子样本的婴儿乙肝疫苗低/无免疫应答的围生期相关因素分析
曹 芳1蔡文萍2严 恺1李 艳3许睿玮1陈少科1赵 倩1魏 欣4石小翔5严卫丽1,6
目的 探讨围生期环境因素如喂养方式、生命早期营养状况等对婴儿乙肝疫苗低/无免疫应答的影响,为研究乙肝疫苗免疫失败机制提供依据。方法 采用病例对照研究设计,纳入来自5家协作医院儿童保健科参加常规体检的1周岁的双生子和无关个体组成两个独立样本,排除无关个体样本中低出生体重儿及两样本中乙肝表面抗原(HBsAg)阳性及母亲有乙肝病史的研究对象。通过病案调查及现场访谈,收集研究对象的父母健康状况、母亲孕产史、婴儿出生状况及1岁以内体检信息等可能的暴露因素资料。在分析乙肝疫苗低/无免疫应答的相关影响因素时,双生子样本采用XTGEE广义估计模型,无关个体样本采用Logistic回归模型和Tobit回归模型进行分析。结果 纳入分析的双生子样本为370人,无关个体样本为300人。19.2%(71例)双生子和11.7%(35例)无关个体在接种乙肝疫苗后发生低/无免疫应答。在双生子样本中,父亲吸烟(OR=4.50, 95%CI:2.52~8.03)和低出生体重(OR=2.55, 95%CI:1.33~4.87)可能增加乙肝疫苗低/无免疫应答风险, Apgar评分高和0~1周岁体重增长量大可能降低乙肝疫苗低/无免疫应答的风险。但在出生体重正常的无关个体样本中未发现上述因素与乙肝疫苗低/无免疫应答的相关性。结论 按照0-1-6方案接种乙肝疫苗后, 低出生体重、父亲吸烟、Apgar评分和0~1周岁体重增长量与婴儿发生乙肝疫苗低/无免疫应答相关。
乙肝疫苗; 低/无免疫应答; 婴儿; 病例对照研究
乙型病毒型肝炎(简称乙肝)是由HBV引发的一种严重影响人类健康的全球性传染病[1,2]。中国属HBV高地方性流行地区。在中国法定报告的传染病中,多年来乙肝的发病数和发病率一直高居前列,是现阶段最为突出的公共卫生问题之一[3]。目前,尚无治愈乙肝的特效药,因此接种乙肝疫苗成为预防和控制HBV感染的有效措施[4~6]。1992年卫生部将乙肝疫苗纳入儿童计划免疫管理,并颁布了《全国乙肝疫苗免疫接种实施方案》;2002年经国务院批准将乙肝疫苗纳入儿童计划免疫。这些策略的实施使乙肝防治工作取得了一定效果。2006年全国乙肝血清流行病学调查表明,一般人群HBV携带率已由1995年的9.75%降至2006年的7.18%[2]。
有研究报道,5%~10%的人群在接种乙肝疫苗后呈现低/无免疫应答,成为HBV感染的高危人群[7, 8]。双生子研究表明乙肝疫苗低/无免疫应答的遗传度达0.60~0.77[9, 10],尽管在乙肝疫苗接种后与免疫应答相关的遗传因素起主要作用,但是非共享环境因素的作用也同样不容忽视。多项研究表明,与乙肝疫苗低/无免疫应答相关的危险因素包括:男性[9]、肥胖、吸烟[7, 9, 11]、酗酒及晚期肝病[8]等。此外,营养不良、恶性肿瘤、肝肾移植、血液透析、糖尿病、艾滋病等或使用免疫抑制剂,均可降低机体对乙肝疫苗的免疫应答[12]。既往分析乙肝疫苗免疫应答影响因素的研究多基于成年人及早产儿[13, 14],很少有研究以正常出生体重的婴儿为研究对象。本研究以双生子和无关个体婴儿为研究对象,旨在分析围生期环境因素如喂养方式、生命早期营养状况等对婴儿乙肝疫苗低/无免疫应答(乙肝表面抗体状态的数量性状)的影响,为探讨乙肝疫苗免疫失败机制提供依据。
1 方法
1.1 抽样人群和调查方法 本研究以新疆维吾尔自治区5所协作医院儿童保健科作为流行病学调查现场,包括乌鲁木齐市儿童医院、乌鲁木齐市妇幼保健院、新疆医科大学第一附属医院、兰州军区乌鲁木齐市总医院和新疆维吾尔自治区人民医院。流行病学现场调查工作从2010年3月开始,于2012年3月截止。采用病例对照研究设计,选取5所协作医院2009年3月1日至2011年3月1日出生并进行常规体检的双生子和无关个体,其中无关个体作为危险因素的验证样本。通过现场访谈填写问卷,收集研究对象人口学信息、父母相关信息、0~1周岁体检记录等资料。
1.2 纳入标准 同时满足以下条件者纳入本研究:①按国家乙肝疫苗免疫接种方案(0-1-6方案)接种乙肝疫苗的双生子和无关个体;②接种的疫苗为同厂家、同批次生产,接种剂量相同;③双生子样本族别为汉族或维吾尔族,为进一步分析和研究有关遗传因素,无关个体样本仅纳入汉族;④1周岁(±1个月)时同意采集静脉血检测抗-HBs定量值;⑤母亲孕期体检记录完整;⑥婴儿有完整的出生时信息及0~1周岁体检记录。
1.3 排除标准 两样本满足以下任何条件之一者被排除:①患有诊断明确的先天性或感染性疾病者;②有出生缺陷者;③母亲孕期有HBV感染;④婴儿HBsAg阳性;⑤为了进一步验证低出生体重对乙肝疫苗免疫应答的影响,无关个体样本剔除低出生体重儿(出生体重<2 500 g)。
1.4 研究变量 ①乙肝血清学标记物包括:抗-HBs定量值和5项定性指标,均在研究对象接种第3针乙肝疫苗(0-1-6方案)6个月后(即12月龄)采集2 mL静脉血检测。采用ELISA试剂盒(Auszyme Monoclonal, AUSAB, Corzyme; Abbott Laboratories, 美国)检测HBsAg、抗-HBs、抗-HBc等定性指标。抗-HBs定量检测采用酶联荧光免疫分析法(ELFA)测定。采用Architect i1000 试剂盒(Abbott, Delkenheim, 德国),原理是通过已由HRPO标记的鼠抗人IgG包被的待测HBsAg样品,通过计算机辅助的荧光分析仪获得结果。②为全面分析围生期暴露因素对婴儿乙肝疫苗低/无免疫应答的影响,本研究通过填写问卷形式,系统收集研究对象及父母的社会人口学信息和围生期相关信息:a.一般信息:性别、出生日期、民族、父母亲健康状况、父母亲现病史、既往史、家族史和吸烟饮酒史等;b.母亲孕产期状况:末次月经时间、孕产史、血型、孕期体重增长量、孕产期特殊用药情况和分娩方式等;c.分娩信息:新生儿出生体重、Agpar评分、出生缺陷和孕周;d.婴儿喂养和生长发育相关信息:出生后喂养史,1、3、6个月和1周岁的体检记录等;计算婴儿0~1周岁体重增长量(kg)反映婴儿的生长发育状况。
1.5 乙肝疫苗低/无免疫应答的定义和分组 本研究定义按照0-1-6方案接种第3针乙肝疫苗后6个月(即12月龄),表面抗体抗-HBs峰值水平<10 mIU·mL-1为无免疫应答,10~100 mIU·mL-1为弱免疫应答;本研究的乙肝疫苗低/无免疫应答是两者之和。≥100 mIU·mL-1为正常免疫应答。根据乙肝血清学检测结果,双生子样本和无关个体样本分别分为正常免疫应答组和低/无免疫应答组。
1.6 质量控制 ①研究中采用自行设计的调查问卷1份,问卷由本研究项目组专家多次集体讨论,结合各流行病学调查现场的预调查结果修订定稿;②每个协作现场均由统一培训的医护人员通过现场访谈的形式填写问卷;③研究对象的体格检查,按照1995年中国九市7岁以下儿童体格发育调查研究所采用的标准[15],均由保健科医师测量相关指标;④所有现场均采用非抗凝管(Becton Dickinson, Franklin Lakes,美国)采集研究对象2 mL静脉血,血样由5所协作医院检验科的专业医师采集,严格遵守样本采集操作规范;⑤乙肝血清学定性和定量指标在新疆医科大学第一附属医院中心实验室完成,均接受严格质量控制;⑥问卷回收时经固定调查员检查,所有数据使用Access 2003数据库软件双人双遍录入,进行逻辑核对,核实无误后,进入数据分析。
1.7 统计学方法 采用Stata 11.0软件(Stata Corp., College Station, TX)进行一般统计学描述。P<0.05为差异有统计学意义。将研究对象的抗-HBs定量结果转换为二分类资料:0表示正常免疫应答,1表示低/无免疫应答。在双生子样本中,采用XTGEE广义估计模型分析乙肝疫苗免疫应答的相关影响因素,该模型可调整双生子对内表型的相关性。进入模型的自变量包括上述采集的围生期暴露因素,其中母亲孕期体重增长量、Apgar评分和0~1周岁体重增长量为连续变量,其余为分类变量。为验证双生子样本的阳性结果,在相互独立的无关个体样本中分别采用多元Logistic回归模型和 Tobit回归模型分析可能影响疫苗免疫应答的因素。在两个模型中,通过计算各暴露因素对应的OR值及其95%CI来反映暴露因素和结局变量之间的关联强度。
2 结果
2.1 一般特征 双生子样本,纳入双生子225对(450人),排除母亲有HBV感染史55人和婴幼儿HBsAg阳性25人,纳入数据分析的为370人(图1);无关个体样本,纳入无关个体328人,排除非汉族5人及低出生体重儿23人,纳入数据分析的为300人(图1)。两样本的一般特征见表1。

图1 双生子和无关个体样本纳入和排除流程
Fig 1 Flow chart of twins and singletons selection process

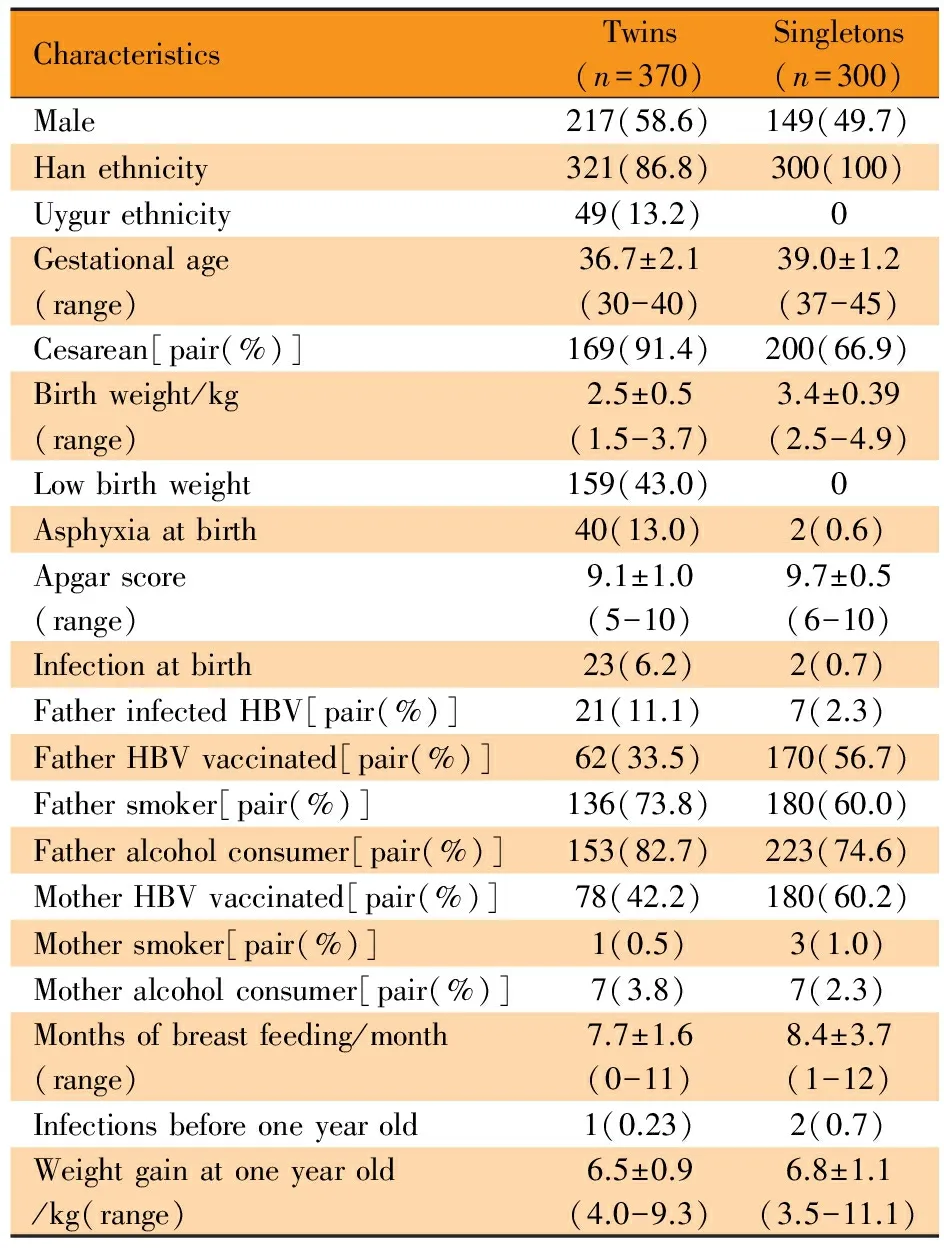
CharacteristicsTwins(n=370)Singletons(n=300)Male217(58.6)149(49.7)Hanethnicity321(86.8)300(100)Uygurethnicity49(13.2)0Gestationalage(range)36.7±2.1(30-40)39.0±1.2(37-45)Cesarean[pair(%)]169(91.4)200(66.9)Birthweight/kg(range)2.5±0.5(1.5-3.7)3.4±0.39(2.5-4.9)Lowbirthweight159(43.0)0Asphyxiaatbirth40(13.0)2(0.6)Apgarscore(range)9.1±1.0(5-10)9.7±0.5(6-10)Infectionatbirth23(6.2)2(0.7)FatherinfectedHBV[pair(%)]21(11.1)7(2.3)FatherHBVvaccinated[pair(%)]62(33.5)170(56.7)Fathersmoker[pair(%)]136(73.8)180(60.0)Fatheralcoholconsumer[pair(%)]153(82.7)223(74.6)MotherHBVvaccinated[pair(%)]78(42.2)180(60.2)Mothersmoker[pair(%)]1(0.5)3(1.0)Motheralcoholconsumer[pair(%)]7(3.8)7(2.3)Monthsofbreastfeeding/month(range)7.7±1.6(0-11)8.4±3.7(1-12)Infectionsbeforeoneyearold1(0.23)2(0.7)Weightgainatoneyearold/kg(range)6.5±0.9(4.0-9.3)6.8±1.1(3.5-11.1)
2.2 乙肝疫苗低/无免疫应答相关围生期暴露因素的单因素分析 表2显示,双生子样本中,在出生体重、Apgar评分、孕周、出生时窒息、0~1周岁体重增长量、母乳喂养、父母吸烟饮酒史和父母HBV感染史等方面,正常免疫应答组和低/无免疫应答组间差异均有统计学意义(均P≤0.016),但无关个体样本中上述暴露因素在正常免疫应答组和低/无免疫应答组间差异均无统计学意义(均P>0.05)。
2.3 乙肝疫苗低/无免疫应答相关围生期暴露因素的多因素分析 表3显示,有4个暴露因素与乙肝疫苗低/无免疫应答相关,其中低出生体重儿(出生体重<2 500 g)、父亲有吸烟史的研究对象发生乙肝疫苗低/无免疫应答的危险性均高于正常出生体重儿(出生体重≥2 500 g)、父亲不吸烟者,OR分别为2.55(95%CI:1.33~4.87)和4.5(95%CI:2.52~8.03); 0~1周岁婴儿体重每增长1 kg,乙肝疫苗低/无免疫应答的风险降低42%(95%CI:0.28~0.63);Apgar评分每增加1分,乙肝疫苗低/无免疫应答的风险降低54%(95%CI:0.40~0.71)。在无关个体样本中采用多元Logistic逐步回归模型和Tobit回归模型验证双生子样本中的阳性结果,均没有有效的多因素方程可以收敛,双生子中4个显著的围生期危险因素与结局的关联均未能得到重复。

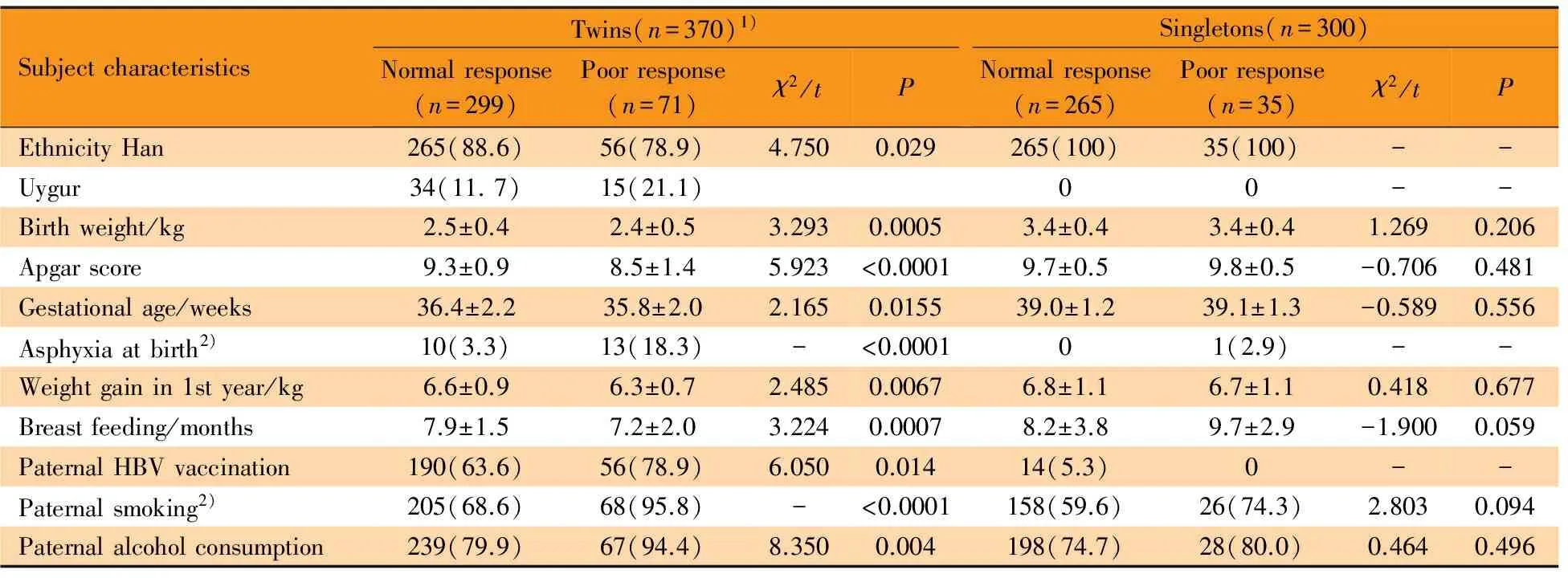
SubjectcharacteristicsTwins(n=370)1)Normalresponse(n=299)Poorresponse(n=71)χ2/tPSingletons(n=300)Normalresponse(n=265)Poorresponse(n=35)χ2/tPEthnicityHan265(88.6)56(78.9)4.7500.029265(100)35(100)--Uygur34(11.7)15(21.1)00--Birthweight/kg2.5±0.42.4±0.53.2930.00053.4±0.43.4±0.41.2690.206Apgarscore9.3±0.98.5±1.45.923<0.00019.7±0.59.8±0.5-0.7060.481Gestationalage/weeks36.4±2.235.8±2.02.1650.015539.0±1.239.1±1.3-0.5890.556Asphyxiaatbirth2)10(3.3)13(18.3)-<0.000101(2.9)--Weightgainin1styear/kg6.6±0.96.3±0.72.4850.00676.8±1.16.7±1.10.4180.677Breastfeeding/months7.9±1.57.2±2.03.2240.00078.2±3.89.7±2.9-1.9000.059PaternalHBVvaccination190(63.6)56(78.9)6.0500.01414(5.3)0--Paternalsmoking2)205(68.6)68(95.8)-<0.0001158(59.6)26(74.3)2.8030.094Paternalalcoholconsumption239(79.9)67(94.4)8.3500.004198(74.7)28(80.0)0.4640.496
Notes 1) univariate analysis was applied in twins without adjustment of within-twin relatedness; 2) Fisher exact test was performed
表3 乙肝疫苗低/无免疫应答相关围生期暴露因素的多因素分析
Tab 3 Multivariate analysis of perinatal risk factors to poor response to HBV vaccination in twins
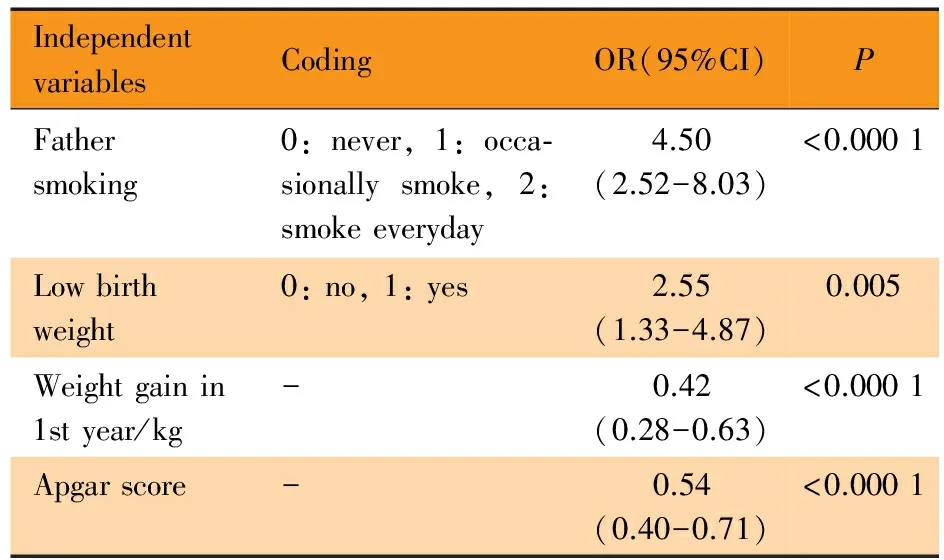
IndependentvariablesCodingOR(95%CI)PFathersmoking0:never,1:occa⁃sionallysmoke,2:smokeeveryday4.50(2.52-8.03)<0.0001Lowbirthweight0:no,1:yes2.55(1.33-4.87)0.005Weightgainin1styear/kg-0.42(0.28-0.63)<0.0001Apgarscore-0.54(0.40-0.71)<0.0001
Notes Waldχ2(8) = 55.0,P<0.000 1. XTGEE program was used to adjust within-pair relatedness
3 讨论
婴儿接种乙肝疫苗是人群预防HBV感染最常用的方法。 WHO中89%(171/193)的成员国家已将乙肝疫苗纳入计划免疫程序。 然而, 针对不同人群的研究报道显示仍有5%~10%的人接种乙肝疫苗后呈现低/无免疫应答。多项研究结果提示疫苗免疫应答机制复杂,是遗传和环境因素共同作用的结果。已发现的可能影响乙肝疫苗免疫应答的因素包括疫苗因素[16~20](如疫苗种类、接种剂量、接种部位等)和宿主因素[7, 8, 21, 22](如性别、年龄、疾病及嗜好等),但是上述暴露因素具体作用机制尚不明确。对乙肝疫苗低/无免疫应答者进行全面调查,分析与乙肝疫苗免疫应答相关的遗传因素和非共享环境因素,对于降低乙肝疫苗低/无免疫应答率,提高疫苗保护率意义重大。
本研究首次在双生子样本中报道父亲吸烟可能对子代乙肝疫苗免疫应答产生不利影响,而在同期收集的正常出生体重的无关个体样本中,阳性结果未得到重复。原因可能是两样本研究对象的围生期环境因素暴露及人群特征上存在差异,如两样本中父亲吸烟率相近(73.8%和60.0%);0~1周岁的平均体重增长量相似(6.5 kg和6.8 kg);不同的特征是低出生体重率(43.0%和0)。由此推测在围生期因素中,低出生体重可能是影响婴儿乙肝疫苗免疫应答的主要危险因素,而其他环境因素(如父亲吸烟和0~1周岁体重增长量等)对乙肝疫苗免疫应答的影响对低出生体重有依赖性。
本研究设计的创新之处:①结局变量的高度同质性。抗-HBs检测均在研究对象年满1周岁时进行,并以研究对象按照统一方法完成相同乙肝疫苗的接种为前提。抗-HBs水平在接种第3针乙肝疫苗后的2.5个月(70~80 d)达到峰值[23],此时为测量抗-HBs水平的最佳时期,但本研究中所有研究对象均在1岁时至研究现场(5所协作医院的儿童保健科)接受统一检测,因此抗-HBs从高峰水平衰减的周期相同,且接种后的6个月体内抗体水平趋于稳定。此外,在质量控制方面,所有研究对象均接种相同剂量、相同厂家生产的乙肝疫苗,在检测抗-HBs水平时,实验室按照严格的质量控制标准进行检验操作。②在双生子样本分析提示了包括低出生体重在内的4个与乙肝疫苗低/无免疫应答有关的因素,在出生体重均为正常的无关个体样本中未发现其他3个危险因素的作用达到显著性,结合两个样本的结果,推测低出生体重可能是影响乙肝疫苗低/无免疫应答的主要围生期危险因素。③包括父母健康状况和婴儿在内的围生期环境因素均在本研究中得以广泛研究。
本研究的不足之处:①母亲孕期垂直传播是导致婴幼儿HBV感染的一个重要因素。研究对象出生时未检测HBsAg,导致本研究很难排除由隐匿性HBV感染导致的乙肝疫苗低/无免疫应答者。然而,为避免研究中出现可能的隐匿性HBV感染,在分析数据之前排除了1周岁时HBsAg阳性及母亲有HBV感染史的研究对象。②研究中父亲吸烟的相关信息有限,吸烟暴露的量化数据并未收集,因此研究对象父亲吸烟与乙肝疫苗低/无免疫应答的关系尚需深入研究。
4 结论
低出生体重可能是影响婴儿乙肝疫苗免疫应答的一个主要危险因素。在本研究双生子样本中得出的与乙肝疫苗低/无免疫应答有关的危险因素,可通过更好的初级卫生保健和预防策略得以控制。在充分了解遗传因素对乙肝疫苗低/无免疫应答作用机制前,需社会和家庭的共同努力来降低人群乙肝疫苗低/无免疫应答率。
[1]Tao R, Li J, Xin J, et al. Methylation profile of single hepatocytes derived from hepatitis B virus-related hepatocellular carcinoma. PLoS One, 2011, 6(5): e19862
[2]Zhuang H(庄辉). Epidemiology of viral hepatitis. China Continuing Medical Education(中国继续医学教育), 2010, 2(3):1-5
[3]卫生部.2010 年全国乙型病毒性肝炎防治规划. 2006
[4]Beasley RP, Chin-Yun Lee G, Roan CH, et al. Prevention of perinatally transmitted hepatitis B virus infections with hepatitis B immune globulin and hepatitis B vaccine. The Lancet, 1983, 322(8359): 1099-1102
[5]Arevalo JA, Washington AE. Cost-effectiveness of prenatal screening and immunization for hepatitis B virus. JAMA, 1988, 259(3): 365-369
[6]Van Damme P, Kane M, Meheus A. Integration of hepatitis B vaccination into national immunisation programmes. Viral Hepatitis Prevention Board. BMJ, 1997, 314(7086): 1033-1036
[7]Roome AJ, Walsh SJ, Cartter ML, et al. Hepatitis B vaccine responsiveness in connecticut public safety personnel. JAMA, 1993, 270(24): 2931-2934
[8]Rosman M, Alan S, Basu M, et al. Efficacy of a high and accelerated dose of hepatitis B vaccine in alcoholic patients: A randomized clinical trialfn1fn1this research was supported by dhhs grant aa-07275, the department of veterans affairs, the kingsbridge research foundation, and smithkline beecham pharmaceuticals. Am J Med, 1997, 103(3): 217-222
[9]Höhler T, Reuss E, Evers N, et al. Differential genetic determination of immune responsiveness to hepatitis B surface antigen and to hepatitis a virus: A vaccination study in twins. The Lancet, 2002, 360(9338): 991-995
[10]Newport M, Goetghebuer T, Weiss H, et al. Genetic regulation of immune responses to vaccines in early life. Genes Immun, 2004, 5(2): 122-129
[11]Wood AJJ, Lemon SM, Thomas DL. Vaccines to prevent viral hepatitis. N Engl J Med, 1997,336(3):196-204
[12]Landrum ML, Hullsiek KH, Ganesan A, et al. Hepatitis B vaccine responses in a large us military cohort of hiv-infected individuals: Another benefit of HAART in those with preserved cd4 count. Vaccine, 2009, 27(34): 4731-4738
[13]Losonsky GA, Wasserman SS, Stephens I, et al. Hepatitis B vaccination of premature infants: A reassessment of current recommendations for delayed immunization. Pediatrics, 1999, 103(2): e14
[14]Lau YL, Tam AYC, Ng K, et al. Response of preterm infants to hepatitis B vaccine. J Pediatr,1992,121(6):962-965
[15]Li H(李辉), Yan GF, Zhang X. A survey on the physical growth of children under 7 years in the urban and suburban rural areas of nine cities of China in 1995. Natl Med J China(中华医学杂志), 1998, 79(3):187-191
[16]Cheng DS, Hsu HM, Bennett CL, et al. A program for eradication of hepatitis B from taiwan by a 10-year, four-dose vaccination program. Cancer Causes Control, 1996,7(3):305-311
[17]Liu YL(刘颖琳), Liu XZ, Kuang JQ. Comparing immunogenicity and efficacy of two hepatitis B vaccines in newborn infants of hepatitis B surface antigen (+)/hepatitis B e antigen (+) carrier mothers. Chin J Obstet Gynecol(中华妇产科杂志), 1999, 34(8): 470-472
[18]Gao J(高洁), Chen CS, Gong XH, et al. Study on the immune effects of different doses and types of genetic engineering hepatitis B vaccines. Chinese Journal of Vaccines and Vmmunization(中国计划免疫), 2000, 6(3): 135-137
[19]Cheng SQ(程书权), Luo ZH. 影响乙肝疫苗免疫效果的有关因素. Chinese Journal of Practical Internal Medicine(中国实用内科杂志), 1992,12(9):479-481
[20]Yagura M, Kamitsukasa H, Harada H, et al. Comparative studies on immunogenicity of chinese hamster ovary cell derived HB vaccine and plasma derived HB vaccine. Kansenshogaku Zasshi, 1991, 65(5): 577-585
[21]Wang NP(汪能平), Cao TY. 成年人乙型肝炎疫苗接种问题初探. Chin J Prevent Med(中华预防医学杂志), 1991, 25(3): 161
[22]Huang BM(黄宝明), Chen QZ, Zhang YC. 幼儿普种乙肝疫苗后抗-hbs 水平的动态分析. Chin J Prevent Med(中华预防医学杂志), 1992, 26(1): 61
[23]Honorati MC, Palareti A, Dolzani P, et al.A mathematical model predicting anti-hepatitis B virus surface antigen (HBs) decay after vaccination against hepatitis B.Clin Exp Immunol,1999,116(1):121-126
The analysis of perinatal environmental factors associated with poor antibody response to infant hepatitis B vaccination based on the twin samples
CAOFang1,CAIWen-ping2,YANKai1,LIYan3,XURui-wei1,CHENShao-ke1,ZHAOQian1,WEIXin4,SHIXiao-xiang5,YANWei-li1,6
(1DepartmentofEpidemiologyandStatistics,XinjiangMedicalUniversity,Urumqi830011;2Children′sHospitalofUrumqiCity,Urumqi830002;3MaternalandChildCareServiceCentreofUrumqiCity,Urumqi830000;4ThefirstTeachingHospitalofXinjiangMedicalUniversity,Urumqi830054;5XinjiangGeneralHospitalofXinjiangMilitaryCommand,Urumqi830000;6Children′sHospitalofFudanUniversity,Shanghai201102,China)
YAN Wei-li, E-mail:yanwl@fudan.edu.cn
ObjectiveTo investigate the overall contribution of perinatal environmental effects on poor response to HBV vaccination in Chinese infants.MethodsCase-control study was used, one-year-old healthy twins and unrelated singletons were recruited from child care settings of 5 hospitals. Parental characteristics, neonates′ condition at birth, postnatal infant feeding history, and growth during the 1st year of life were investigated by interview and medical record review. HBV related markers were examined for infants at one year of age. The role of environmental factors on poor vaccination response (anti-HBs<100 mIU·mL-1) was analyzed using XTGEE programs for twins and logistic and tobit regression programs in singletons.ResultsOverall, 71(19.2%)of 370 twins and 35 (11.7%) of 300 singletons had poor responses to HBV vaccine. In twins, paternal smoking and low birth weight were associated with an increased risk of poor response to HBV vaccination (OR=4.50, 95%CI: 2.52-8.03 and OR= 2.55, 95%CI: 1.33-4.87, respectively). Higher Apgar score and gaining more body weight in the 1st year of life reduced this risk. No environmental factors were related to poor response to vaccination in the singleton samples.Conclusions After three HBV vaccinations, low birth weight, father smoking, Apgar scores and weight gain in 1st year were associated with poor antibody response to infant hepatitis B vaccination.
Hepatitis B vaccine; Poor response; Infant; Case-control study
国家自然科学基金项目:30960329
1 新疆医科大学公共卫生学院流行病学与卫生统计学教研室 乌鲁木齐,830054;2 新疆维吾尔自治区乌鲁木齐市儿童医院 乌鲁木齐,830002;3 新疆维吾尔自治区乌鲁木齐市妇幼保健院 乌鲁木齐,830000;4 新疆医科大学第一附属医院 乌鲁木齐,830054; 5 兰州军区乌鲁木齐总医院 乌鲁木齐,830000;6 复旦大学附属儿科医院临床流行病学研究室 上海,201102
严卫丽,E-mail:yanwl@fudan.edu.cn
10.3969/j.issn.1673-5501.2013.01.008
2012-10-12
2012-12-21)
丁俊杰)

