氟唑活化酯诱导玉米抗锈病的探讨
张蕊蕊,胡伟群,朱卫刚,陈 杰,李建高
(1.国家南方农药创制中心浙江基地 浙江省化工研究院,浙江杭州 310023;2.南通泰禾化工有限公司,江苏 南通 226000)
玉米起源于美洲,作为粮食种植于中美洲、南北美洲已经有上千年的历史。玉米锈病在世界种植区内均有发生[1],主要包括普通玉米锈病 (Puccinia sorghi Schw),南方玉米锈病 (Puccinia.polysora Underw)和热带玉米锈病 (Physopella zeae(Mains)Cumm.and Ramochar)3种。其中,普通玉米锈病主要在中国黄淮海以及新疆玉米种植区发生[2-3],南方玉米锈病主要发生在中国南方地区[4],热带玉米锈病在中国海南以及台湾地区时有发生[5]。
目前防治玉米锈病的方法主要通过种植抗病品种及适当的化学防治。生产上常使用三唑类和有机硫类杀菌剂对之进行防治。植物病害防治的另一种重要途径是利用生物或者非生物的植物诱导抗病激活剂,通过激活植物体自身的免疫系统来抵抗植物病害的侵袭。植物抗病激活剂自身没有杀菌活性,但可诱导植物自身产生系统抗病性。植物抗病激活剂具有广谱性且不诱导植物产生抗药性。迄今为止,已经商品化的植物抗病激活剂有活化酯(BTH)、烯丙苯噻唑、有效霉素A和tiadinil等[6]。
氟唑活化酯是由华东理工大学创制开发的新型化合物,属于植物抗病激活类诱导剂[7]。此类活化酯衍生物可用于诱导植物次级代谢产物紫杉类化合物;同时,研究发现该类化合物可诱导植物产生抗性反应,包括促进活性氧迸发以及激活苯丙氨酸解氨酶 (PAL)等[8]。通过研究施药次数、施药浓度及接种天数对氟唑活化酯防治玉米锈病的影响,并对其诱导的生理机制进行了初步探索,以期为氟唑活化酯的合理应用提供理论依据。
1 材料和方法
1.1 材料
供试药剂为5%氟唑活化酯乳油,上海泰禾化工有限公司提供;供试菌种为普通玉米锈病Puccinia sorghi Schw,浙化院生测安评中心活体继代培养;供试植物为玉米品种农大108。
1.2 方法
1.2.1 不同处理对诱导玉米锈病生物活性的影响
将供试药剂配制成 6.25,12.50,25.00,50.00 mg·L-1浓度的药液备用,以清水处理为空白对照,设2次用药与1次用药2个处理,重复3次。
2次用药是在植株2叶1心期施药1次,采用叶面喷雾施药,将供试药剂均匀喷施到苗龄一致的植株叶面,以喷湿不滴水为宜。每隔5 d喷雾1次,共施药2次。分别于第2次药后3,5,7,9 d喷雾接种孢子浓度为10万个·mL-1左右的玉米锈病孢子悬浮液。接种后的试材自然风干,然后移至人工气候室 (25℃,相对湿度70%),8 d后视空白对照发病情况进行分级调查,按病指计算防效。
1次用药时只施1次药,时间与2次用药时的第1次施药同时进行,分别于施药后3,5,7,9 d接种玉米锈病。接种后的试材自然风干,然后移至人工气候室,8 d后视空白对照发病情况进行分级调查,按病指计算防效。
参照李复宁[9]对小麦条锈病严重度的研究,将玉米锈病分为以下6级:0级,无病症;1级,叶片整个发病面积5%及以下;2级,叶片整个发病面积达10% ~20%;3级,叶片整个发病面积达30%~40%;4级,叶片整个发病面积达50%~60%及以下;5级,叶片整个发病面积达80%~100%,叶片枯死。
1.2.2 氟唑活化酯诱导植株体内POD和PAL活性
用50.00 mg·L-1氟唑活化酯处理2叶1心期玉米植株,于喷药后3,5,7,9,14 d测定植株体内POD、PAL活性,以未喷施的植株为空白对照,每处理重复3次。
1.3 酶活测定
PAL的提取及测定参照薛应龙[10]的方法稍加改进:称取4 g叶片,冰浴后加10 mL含有5 mmol·L-1β-巯基乙醇的pH值 8.8的硼酸盐缓冲液、0.5 g聚乙烯吡咯烷酮及少量石英砂研磨匀浆。在4℃条件下,10 000 g离心15 min,上清液用于PAL的测定。酶液反应体系为:0.1 mL PAL提取液,3.9 mL 0.05 mol·L-1pH值8.8的硼酸缓冲液,1 mL 0.02 mol·L-1苯丙氨酸,40℃保温1 h,而后用0.2 mL的6 mol·L-1HCl终止反应。测光密度值D290,以未经诱导的植株为对照。
POD的提取及测定参照李合生[11]的方法稍加改进:称取 4 g叶片,冰浴后加 15mL 0.05 mol·L-1pH值8.8的磷酸缓冲液和少量石英砂研磨匀浆。在4℃条件下,10 000 g离心15 min,上清液用于POD的测定。用愈创木酚和H2O2比色法测定,依次加以下反应液:2.91 mL的0.05 mmol·L-1磷酸缓冲液 (pH 值8.8),1 mL的0.05 mol·L-1愈创木酚,0.1 mL上述酶液,1 mL的 2%H2O2,34℃保温3 min,迅速稀释1倍,测定测光密度D470,每隔1 min记录1次,共记录5次。
1.4 数据处理
百分比数据先进行反正弦平方根转换,应用DPS数据处理系统进行三因素方差分析,采用LSD法进行多重比较[12]。
2 结果与分析
2.1 不同处理对植株病情指数和防效的影响
通过表1可以看出,随着药剂浓度的增加,病情指数有降低的趋势。在1~2次用药情况下,药后5 d接种的病情指数要低于药后3 d接种的病情指数。药后7 d接种的病情指数稍高于药后5 d接种的病情指数。1次药后3 d接种的病情指数略微高于2次药后3 d接种的病情指数,前者对玉米锈病的防效略微低于2次用药后的药剂防效。上述结果可知,随着药剂浓度增加,病情指数显著降低,药剂防效显著升高;随着用药次数增加,防效有所增加,但是1次与2次施药处理间没有显著性差异。
通过三因素互作方差分析表2可以看出,药剂浓度及接种天数对病情指数及药剂防效的影响均达到了显著水平。施药次数及接种天数的互作对病情指数及药剂防效的影响也达到了显著水平。施药次数对病情指数及药剂防效的影响不显著。
2.2 氟唑活化酯对植株体内酶活性的诱导
由图1可知,当施用氟唑活化酯5 d之后,植株体内的POD活性显著升高,与未施用的活性差异显著。施用7 d之后,植株体内POD活性有了极显著升高。施用9 d之后,植株体内POD活性下降,且与未施用的植株之间没有显著性差异。施用14 d之后,植株体内POD活性下降,且与未经施用的植株之间没有显著性的差异。
由图2可知,与未经施用氟唑活化酯的植株相比,施用之后5~14 d的植株体内的PAL活性都有了显著性升高。
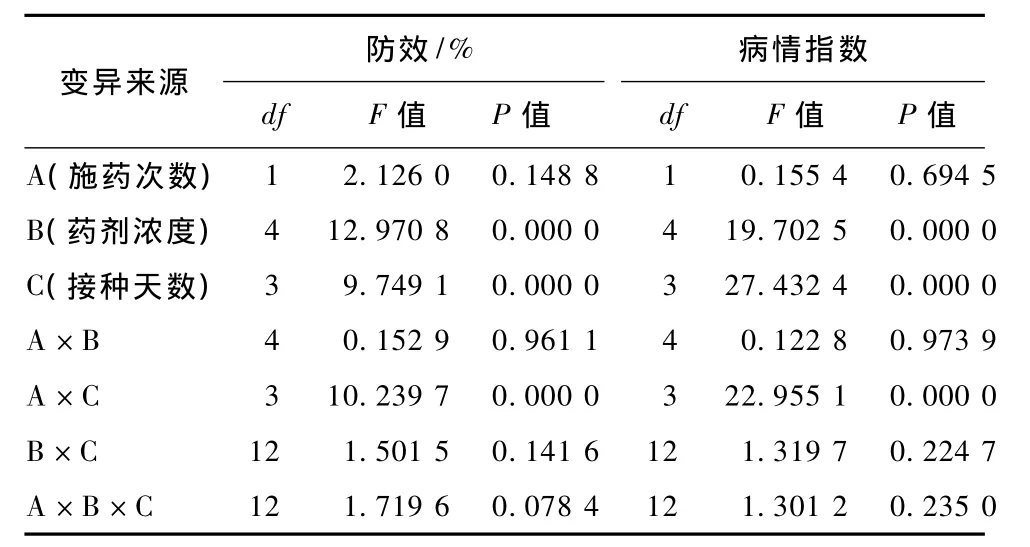
表2 三因素互作方差分析
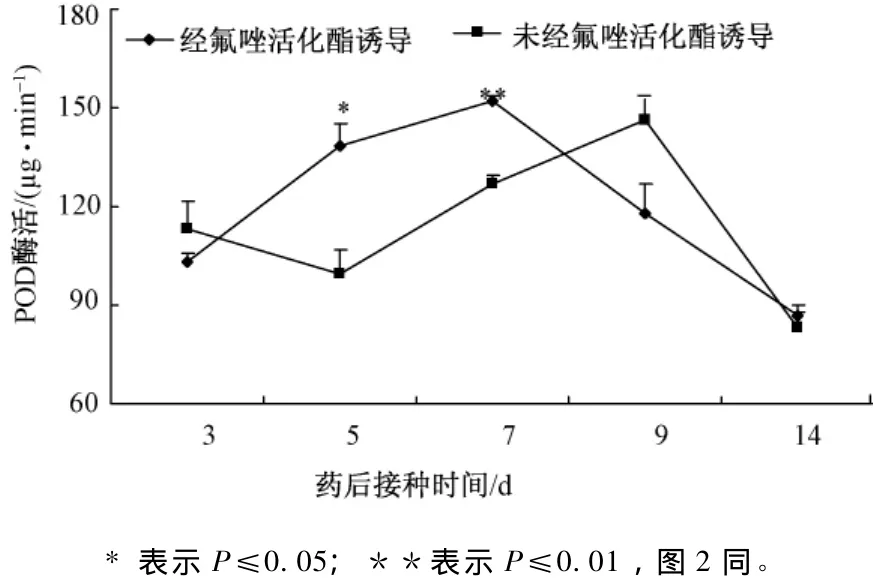
图1 氟唑活化酯处理对植株体内POD活性的影响
施用5 d之后,植株体内的PAL活性有了极显著的升高;施用7 d之后植株体内的PAL活性有所下降,但与未施用的植株的差异达到极显著水平;施用9 d之后,植株体内PAL活性下降,但与未施用的植株之间差异极显著。14 d之后PAL酶活有略微的上升,与对照之间差异显著。
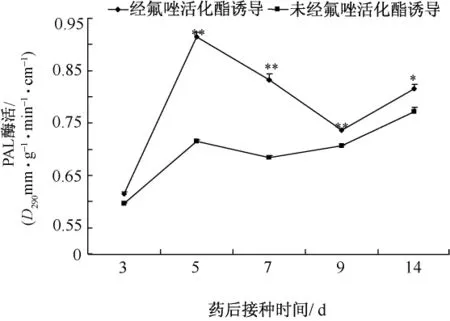
图2 氟唑活化酯处理后植株体内PAL活性变化
3 小结与讨论
Sharma等[13]研究表明,植株病情指数会随着施用BTH次数的升高而降低。本研究表明,施药次数对植株病情指数的影响不明显,可能是由于试验作物不一。前者试验中的作物为双子叶植物豆类,本试验中供试作物为单子叶植物玉米。与前者进行的田间试验不同,本试验在可控温控湿的人工气候室中进行。田间与室内试验条件的差异可能导致了最终试验结果的差异。
本研究表明,施药浓度对病情指数的影响达到了显著水平。随着施药浓度的升高,植株病情降低。但在黄瓜上的预试验表明,在100 mg·L-1条件下,氟唑活化酯对黄瓜植株产生轻微要害,当浓度达到200 mg·L-1时,对黄瓜植株产生叶片焦枯、皱缩等严重药害症状。因此在氟唑活化酯施用时,选择合适的浓度是必要的。
接种天数对病情指数的影响也达到了显著水平。研究表明,施用抗病激活剂类药剂之后,单子叶植物可以获得终身获得抗性[14-15]。李喜娥等[16]研究发现,BTH类抗病激活剂能够影响植株叶片的光合作用特性,能够提高植株叶片的净光合速率、叶绿素含量等并能够降低叶片受侵染后产生的光合作用下降等症状。因此在植株发病前较早施用氟唑活化酯,使植株可能较早获得终身抗性,配合抗病品种的种植,可增强植株抵抗病虫害的能力。
李玉红等[17]研究表明,BTH类抗病激活剂能够显著诱导植株发病前期引起植株体内H2O2的积累,且能够增加植株发病后期消除过量H2O2的能力。Xu等[8]研究发现,BTH衍生物可以诱导植株产生抗病反应,能够促进植物体内的活性氧的迸发以及激活苯丙氨酸解氨酶。本研究表明,植株施用氟唑活化酯3~5 d之后,其体内的 POD、PAL活性有了极大的提高,与对照相比达到了显著水平。一般来说,2次施药之后植株体内2种酶的活性会再次升高。氟唑活化酯可以诱导植物体内 POD、PAL活性的升高,是氟唑活化酯的诱导机制之一。
Sharma等[13]研究结果还表明,增加施药次数能够显著增加作物产量;更有研究表明,施用BTH类抗病激活剂能够提高果实品质和产量[18]。本试验中由于条件限制并未进行收获后的产量评价。建议对于氟唑活化酯这种新化合物继续进行田试研究。
综合考虑不同施药次数、药剂浓度及接种天数对玉米锈病病情指数及药剂防效的影响及施药之后植株体内相关酶活的变化,氟唑活化酯在药后5 d出现诱导抗性高峰,且随着用药次数增加,防效有所升高。结合田间农民用药习惯,建议氟唑活化酯施药方式为施药2次,间隔5 d。在病害发生前期施用,结合抗病品种的种植,培育无病壮苗,对病害进行预防性控制是关键。
[1] Nattrass R M.Occurrence of Puccinia polysora Underw.in East Africa [J].Nature,1953,171:527.
[2] 马德成,叶梅,魏建华,等.新疆玉米锈病发生初报 [J].新疆农业科技,2008(2):42.
[3] 马清礼.玉米锈病的发生与防治 [J].安徽农学通报,2006,12(10):147.
[4] 王超,陈月娣,赵小燕.嘧菌酯等药剂对玉米锈病后期病害的防治试验 [J].浙江农业科学,2011(6):1353-1354.
[5] Hou H H,Tseng J M,Sun M H.Occurrence of corn rusts[Puccinia sorghi,Puccinia polysora] in Taiwan [J].Plant Disease Reporter,1978,62:183-186.
[6] 张一宾.植物抗性诱导机理、抗病激活剂及其研发方向[J].世界农药,2008,30(5):1-5.
[7] ZhuW P,Zhao Z J,Xu Y F.Derivatives of benzothiadiazole-7-carboxylates:synthesis and biological activity [J].Monatshefte für Chemie,2008,139:1067-1071.
[8] Xu Y F,Zhao Z J,Qian X H,et al.Novel,Unnatural benzo-1,2,3-thiadiazole-7-carboxylate elicitors of taxoid biosynthesis[J].Agricultural and Food Chemistry,2006,54:8793-8798.
[9] 李复宁.小麦条锈病严重度分级标准的研究简报 [J].植物保护,1991,17(2):30.
[10] 薛应龙.植物生理学实验手册 [M].上海:上海科技出版社,1985:191-192.
[11] 李合生,孙群,赵世杰,等.植物生理生化实验原理和技术[M].北京:高等教育出版社,2000:164-167.
[12] 唐启义,冯明光.DPS数据处理系统 [M].北京:科学出版社,2010:102-105.
[13] Sharma K D,Sharma V,Singh R,et al.Control of chickpea blight disease caused by Didymella rabiei by mixing resisitence inducer and contact fugucide[J].Crop Protection,2011,30:1519-1522.
[14] Dann E K,Deverall B J.Effectiveness of systemic resistance in bean against foliar and soilborne pathogens as induced by biological and chemical means [J].Plant Pathology,1995,44:458-466.
[15] Dann E,Diers B,Byrum J,et al.Effect of treating soybean with 2,6-dichloroisonicotinic acid(INA)and benzothiadiazole(BTH)on seed yields and the level of disease caused by Sclerotinia sclerotiorum in field and greenhouse studies[J].European Journal of Plant Pathology,1998,104:271-278.
[16] 李玉红,程智慧,陈鹏,等.苯丙噻二唑 (BTH)诱导黄瓜幼苗对霜霉病抗性的研究 [J].园艺学报,2006,33(2):278-282.
[17] 李喜娥,陈年来,王春林,等.BTH和SA处理及白粉病原菌接种对甜瓜叶片光合特性的影响 [J].西北植物学报,2007,27(8):1643-1649.
[18] 刘敏.南山甜桃采前 BTH处理对采后储藏品质的影响[J].安徽农业科学,2010,38(34):19570-19571.

