灰树花黄腐病综合防治技术探讨
鲍文辉
(浙江省丽水市农业科学研究院,浙江 丽水 323000)
随着灰树花栽培年限的增加,生产上的一些制约因素逐渐显露出来,其中黄腐病就是个瓶颈问题,如不进行有效防治,将大幅降低灰树花产量和品质,严重阻碍灰树花产业发展。农民也称黄腐病为黄菌病,一旦发现,1~2 d内就可将一朵灰树花子实体包食殆尽,最后成为一堆黄酱状物。据调查,浙江庆元该病发现于21世纪初,约有10年的发病历史,近年来危害加重,发生普遍,主产区发病率达100%,严重发病的地块产量损失高达70%~80%。目前对该病尚无系统研究报道和有效的防治措施[1-5]。2009年以来,对该病进行了包括侵染途径、发病条件及以农业防治为核心的防治技术等多项试验研究,现就防治技术研究结果叙述如下。
1 材料与方法
1.1 试验材料
以灰树花为试验材料,以灰树花黄腐病为研究对象,通过不同方法试验,研究影响病害的发生条件和防治措施。
防治药剂的选择与应用。灰树花黄腐病发生危害快速及直接侵害子实体的特性,规定了药物防治的必要性,按照高效,低毒或无毒,无污染的选择药剂要求,我们查阅现有资料,开展初步筛选试验,从20多种农药中,筛选出硫酸铜制剂和生态氧制剂 (其中硫酸铜制剂定名为黄菌灵I,生态氧制剂定名为黄菌灵Ⅱ)进行深入试验研究。
1.2 试验方法
1.2.1 采用综合栽培技术
通过不同轮作方式、不同畦高栽培及其他辅助措施,研究对灰树花黄腐病的发生影响。
1.2.2 土壤中施用黄菌灵I
设3个黄菌灵I浓度0.50%,1.00%,1.50%及清水 (对照)共4个处理,不设重复。选择被包食的子实体为营养源的在地表直径约50 cm的菌体为试验对象,将菌体外缘划出相等的4个区,在各区菌体前端以外的土壤分别浇施清水和3个黄菌灵I浓度0.50%,1.00%,1.50%药剂,土壤浇施药液量2 kg·m-2,共施1次。
1.2.3 黄菌灵I处理子实体
设3个黄菌灵I浓度0.50%,1.00%,1.50%及清水 (对照)共4个处理,不设重复。取中间染病而两头健康的子实体共3份,在染病与健康交接处划线标记,然后分别1头滴醮清水,另1头滴醮不同浓度的黄菌灵I,共3组,分别置于培养皿中保湿培养,经2,15和39 h分别观察病菌扩展情况。
设5个黄菌灵I浓度0.05%,0.10%,0.20%,0.30%,0.50%及清水 (对照)共6个处理,不设重复。在同一子实体上切取病斑大小,病征及子实体组织大小相近的6个子实体部分,分别用清水,0.05%,0.10%,0.20%,0.30%和0.50%的黄菌灵I浸渍,置于培养皿中保湿培养,12,24,36,48,60和72 h后跟踪观察子实体病害发生情况。
1.2.4 黄菌灵I在原基及幼小子实体上应用
设3个黄菌灵I浓度0.05%,0.25%,0.50%和清水 (对照)共4个处理,不设重复。在同一地段选择子实体原基即将形成 (处于白色突起或个别转灰色)的相同生育阶段4处和幼小子实体 (直径3~5 cm,尚未开片)4朵,分别浇洒清水和0.05%,0.25%,0.50%的黄菌灵I,浇施量4 kg·m-2。
1.2.5 黄菌灵I对菌丝生长影响
配制马铃薯葡萄糖琼脂 (PDA)培养基。各处理是在PDA培养基中加入相应浓度的黄菌灵药液,设 A(加 0.05%黄菌灵 I的 PDA),B(加0.10%黄菌灵 I的 PDA),C(加0.15%黄菌灵 I的PDA)和对照 (PDA),共4种试管培养基,经高压灭菌后,接入母种,每处理接种3个。供试品种为灰树花-51,黑木耳-新科 1和香菇-庆科 20。置24~26℃下培养观察。
1.2.6 黄菌灵Ⅱ对子实体杀菌效果
设4个黄菌灵Ⅱ浓度0.05%,0.10%,0.20%,0.30%和清水 (对照)共5个处理,3次重复。取3朵发病子实体,在同一子实体上切取病斑大小,病征及子实体组织大小相近的5个子实体部分,分别用毛笔蘸上清水和0.05%,0.10%,0.20%,0.30%的黄菌灵Ⅱ,然后分别置于培养皿中保湿培养,12,24,36和48 h后跟踪观察子实体病害发生情况。
2 结果与分析
2.1 不同栽培技术对病害发生的影响
2.1.1 轮作与连作
经现场考察和对40位菇农的调查表明,在相同栽培背景下,连作田块发病明显重于轮作,连作年限越长,这种差异越明显。在轮作时,水旱轮作比旱旱轮作发病轻。可见,轮作可以降低病原密度,减轻病害发生;水淹田块,可通过水生缺氧环境杀灭菌体及大量孢子,更有效减少病原,减轻病害。
2.1.2 畦高
对2个菇棚分别进行20~25 cm(常规)和40~50 cm不同畦高处理试验,畦高20~25 cm的田块发病42朵,而畦高40~50 cm的没有病害发生。这表明通过深沟高畦处理,确保菌棒周围不积水,使土壤相对湿度保持在70%左右,畦面处于湿而不渍的良好状态,可有效防止黄菌病的发生。
2.1.3 其他农艺措施
推迟菌棒覆土时间,且覆土出菇期间偏干管理,同时搞好环境卫生等措施有利于减轻黄腐病侵害。
2.2 黄菌灵I在土壤上的阻菌效果
土壤经黄菌灵I浇施18 h后观察,黄腐病菌停留在处理前的状态,没有继续扩展;清水对照处理黄腐病病菌往前伸长了40~45 cm。结果表明,黄菌灵浇施土壤能有效阻止病菌生长,且以0.50%黄菌灵I处理最为经济。
2.3 黄菌灵I在子实体上的抑菌效果
2.3.1 阻菌效果
0.50 %,1.00%,1.50%黄菌灵I处理后分别经2,15和39 h培养观察,3个浓度药剂处理均能彻底阻止菌斑蔓延;但清水处理的菌斑迅速蔓延,醮后2 h子实体伸长 1.2~2.2 cm,伸长速度达0.50~1.00 cm·h-1;滴醮后15 h向子实体外扇形延伸,滴醮后39 h无滴醮的子实体全部被包食。
2.3.2 杀菌效果
由表1可知,清水处理的病斑继续扩展,至36 h时子实体已被病菌全面覆盖,至48 h时子实体已烂成棕褐色的酱状;黄菌灵I浸药处理的病斑在逐步缩小,72 h后仍保持子实体组织在处理前的状态,各浓度之间差异不明显。结果表明,0.20%~0.30%的黄菌灵I对子实体上的黄腐病病菌已具有杀灭作用。
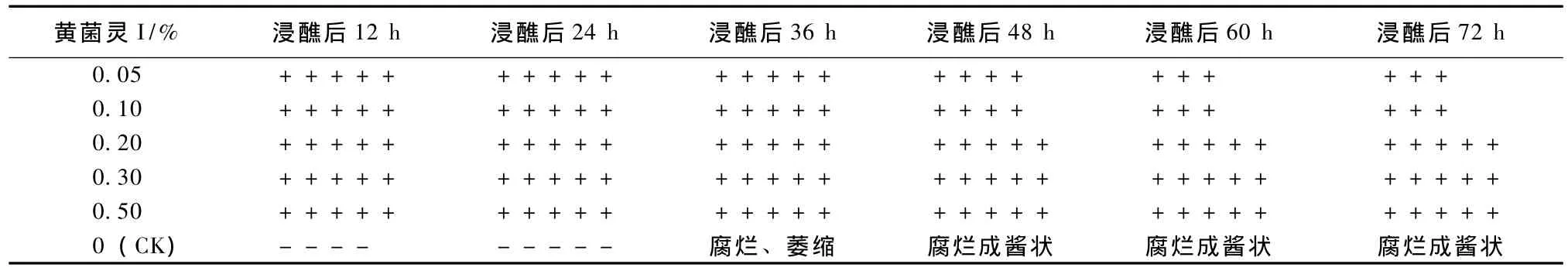
表1 不同浓度黄菌灵I浸醮灰树花子实体对病斑发生的影响
2.4 黄菌灵I对灰树花原基及幼小子实体生育的
影响
经6 d连续观察,经黄菌灵 I的0.05%,0.25%,0.50%不同浓度处理后,灰树花原基照常分化,幼小子实体生长速度与对照没有差别,未见对原基及幼小子实体产生影响。因此,0.50%以下黄菌灵I用于出菇初期 (始菇期)土壤消毒灭菌对于主栽灰树花子实体的生育是安全的。
2.5 黄菌灵I对灰树花菌丝生长的影响
由表2可知,连续12 d观察,与对照相比,A,B处理的灰树花菌落伸长速度略慢10% ~15%(试验过程因加0.15%黄菌灵I试管不凝固,所以缺少了C处理结果),菌丝密度相近。所以,小于0.10%浓度的黄菌灵I PDA培养基对灰树花菌丝生长的影响较小,是安全的。故黄菌灵I添入培养料中处理,浓度应控制在0.10%以下。
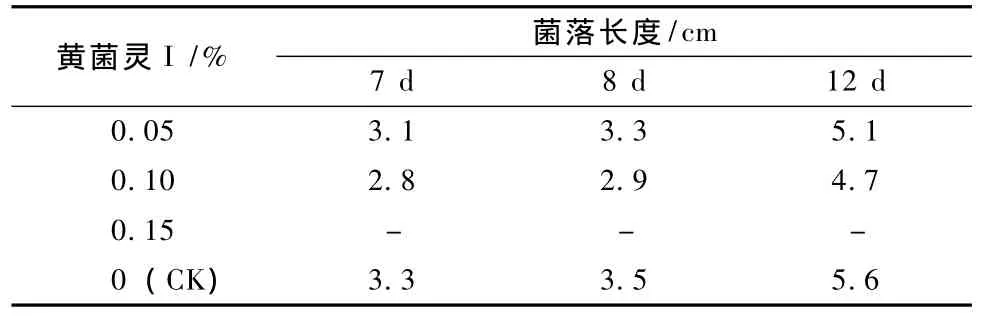
表2 PDA加入不同浓度黄菌灵I对菌丝生长的影响
2.6 黄菌灵Ⅱ在子实体上的杀菌效果
由表3可知,对照蘸水处理及蘸0.05%,0.10%的黄菌灵Ⅱ处理的,病斑继续扩展,至24 h菌体覆盖到样品1/2以上,至36 h子实体已被病菌全面覆盖,至48 h子实体已烂成棕褐色酱状。经0.20%和0.30%黄菌灵Ⅱ蘸药处理的,病斑逐步缩小,至24 h病菌体已消失,48 h后仍保持子实体组织在处理前的状态,2个浓度之间差异不明显。表明0.20%以上的黄菌灵Ⅱ对子实体上的黄腐病病菌具有杀灭作用。
3 小结
通过场地清洁、水旱轮作、推迟菌棒排置覆土时间、深沟高畦高棚、土壤消毒、浅覆土等农艺措施,能有效减轻或预防灰树花黄腐病。
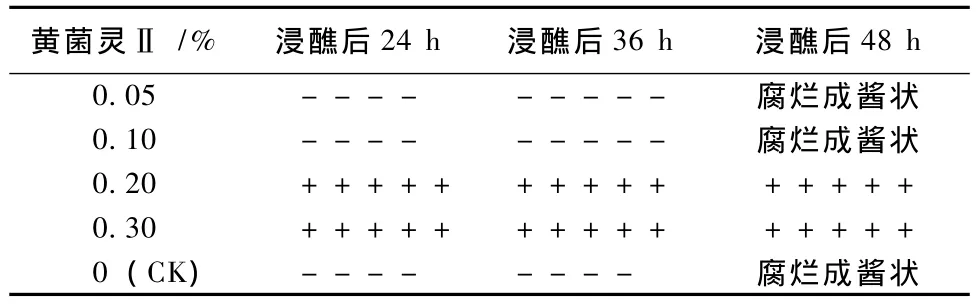
表3 不同浓度黄菌灵Ⅱ浸醮灰树花子实体病斑的效果
在不同时期分别采用2种药剂处理均能有效预防和治疗灰树花黄腐病。预防处理为0.05%~0.10%黄菌灵I拌料处理或0.20%黄菌灵I土壤浇施消毒,治疗处理为0.20%黄菌灵Ⅱ直接喷施病斑灭菌。黄菌灵I和Ⅱ在100多万袋灰树花上生产应用示范,防治效果均佳,可在生产上推广应用。
[1] 鲍文辉.袋栽灰树花两季出菇栽培技术 [J].食用菌,2000,128(增1):34.
[2] 巫仁高,王爱仙,刘福阳.南方灰树花高产栽培管理技术[J].福建农业科技,2012(3/4):69-70.
[3] 阮海东,陈秀娟.灰树花筒栽技术要点 [J].中国农学通报,2010,26(增1):90-91.
[4] 袁书钦,杭海龙,武金钟.灰树花栽培技术图说 [M].郑州:河南科学技术出版社,2009.
[5] 王爱武.食用菌灰树花病虫害的发生与防治 [J].农业科技通讯,2002(1):33.

