硫酸亚铁铵的制备反应条件与绿色化研究
钟国清,周齐文,夏 安
(1.西南科技大学材料科学与工程学院,四川绵阳 621010;2.西南石油局油田工程服务公司,四川绵阳 621000)
在化学实验教学中加强绿色化学教育,对传统的化学实验内容和课程体系进行绿色化改革,推行绿色化学实验是大势所趋[1-4]。把绿色化学的理念融合于大学化学教学,在化学实验中减少环境污染,增强广大师生环保意识,使绿色化学成为化学教育的重要组成部分,是化学实验课程改革的新课题[5-7]。硫酸亚铁铵的制备几乎是学习化学课程的学生必做的一个经典的综合性实验,因为做该实验不仅可了解复盐的一般特征和制备方法,比如氧化还原、杂质去除、提高产率和纯度、防止副反应发生及绿色化学教育等有关化学原理的应用,还能综合训练学生称量、水浴加热、蒸发、浓缩、结晶、干燥、倾析、常压过滤、减压过滤、目视比色、滴定分析等一系列化学基本操作[8]。但现行制备方法中,存在着污染严重、试剂用量大、产品质量不高、实验时间长和经费花销大、不同文献之间的有些说法相互矛盾等问题。我们对硫酸亚铁铵的制备实验进行了既有利于训练基本操作又符合绿色化学理念的减量化与绿色化改造,并探讨了制备的工艺条件。
1 实验
1.1 仪器与试剂
仪器和器具:电热恒温水浴、电磁加热搅拌器、台秤、电子分析天平、量筒(10 mL、50 mL)、烧杯(250 mL)、锥形瓶(50mL、250mL)、蒸发皿、表面皿、真空泵、漏斗、吸滤瓶、布氏漏斗、移液管(5mL、10mL)、比色管(25mL)、酸式滴定管(25mL)等。
试剂:铁粉或铁屑、2 mol/L H2SO4、2 mol/L HCl、1 mol/L NaOH、95%乙醇、Fe3+标准溶液(含Fe3+0.100mg/mL)、0.01mol/L KMnO4标准溶液、硫酸铵(A.R.)、Na2C2O4(A.R.)等。
1.2 实验原理
硫酸亚铁铵是由等物质的量的硫酸亚铁和硫酸铵形成的,俗称莫尔盐,它是透明浅绿色单斜晶体,比一般的亚铁盐稳定,在空气中不易被氧化,溶于水,不溶于乙醇,在定量分析中常用来配制亚铁离子的标准溶液。翟丽萍等[9]直接采用FeSO4与(NH4)2SO4反应来制备硫酸亚铁铵晶体;刘少华等[10]用铁与CuSO4发生置换反应得到FeSO4,再与(NH4)2SO4反应制备硫酸亚铁铵。一般制备方法是将铁与稀硫酸按照一定摩尔比在适当温度下反应,制得硫酸亚铁溶液。反应式:

然后用硫酸亚铁溶液与硫酸铵按适当摩尔比混合,利用复盐的溶解度比组成它的简单盐的溶解度小的特性,经适当加热浓缩结晶而制得硫酸亚铁铵产品。

1.3 实验步骤
往盛有1.0g铁粉或铁屑的50mL锥形瓶中加入2mol/L H2SO4溶液11 mL,小烧杯中装入稀NaOH溶液,按图1装好仪器,用水浴加热使铁与稀硫酸反应至基本不再冒出气泡为止;趁热用普通漏斗过滤,并用少量蒸馏水洗涤残渣,滤液承接于干净的蒸发皿中;按浓度比n[(NH4)2SO4]∶n(Fe)=1∶1的比例称取(NH4)2SO4,并加入到盛有上面制得的FeSO4溶液的蒸发皿中;混合均匀并在水浴上加热搅拌,使(NH4)2SO4全部溶解,在搅拌下蒸发浓缩至溶液表面刚出现薄层晶膜为止;从水浴锅上取下蒸发皿,静置、冷却,即有硫酸亚铁铵晶体析出;冷至室温后,减压过滤,最后用少量的乙醇洗去晶体表面所附着的水分;将晶体取出,晾干、称质量,计算产率。硫酸亚铁铵产品的质量指标按化学试剂六水合硫酸亚铁铵国家标准(GB/T 661—2011)进行测定。
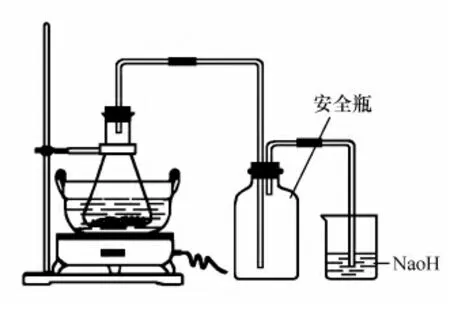
图1 硫酸亚铁的制备装置
2 实验结果与讨论
2.1 实验绿色化与减量化改造效果
传统制备方法的实验装置为敞开式,因废铁屑含有碳、硫、磷、硅等杂质,和硫酸反应时生成H2S、PH3等刺鼻、呛人的有毒气体,并伴随着大量H2逸出,导致实验室弥漫着强烈的刺激性气味,直接危害师生的身体健康。即便在通风橱中进行,整个实验室还是能闻到臭味。同时,传统的硫酸亚铁铵制备方法试剂用量大,多数文献采用的铁屑或铁粉为2~4g[4,11-13],有的用量更多,反应时间长,环境污染严重,并且产品质量不高。马超平等[14]研究了硫酸亚铁铵制备的微型实验,陈彦玲等[15]也开展了硫酸亚铁铵制备方法微型化的研究,尽管符合绿色化学的要求,但是在非常规仪器中进行,不利于对学生进行基本操作训练。选用废弃铁屑为原料,可降低实验成本,实现了废物利用,有利于培养学生的绿色化学理念。
通过对本实验的改进,把整个实验装置封闭起来,因铁屑不纯而产生的H2S、PH3等有毒气体被NaOH溶液吸收(也可用除油污的碱液来洗气)。图1中的安全瓶起到防止碱液倒吸作用。当然也可以在导气管末端连接一倒扣的漏斗,以便吸收产生的毒气而去掉安全瓶。由于实验装置是封闭的,反应过程中水分蒸发很少,可不补充蒸馏水,这也给实验操作带来方便。改进装置后虽不在通风橱内进行实验,也闻不到臭味。在保证培养学生基本操作的前提下,我们采用小剂量实验,既可节约药品消耗,又可减少对环境的污染,从而使实验中各种试剂用量更加合理。改进后的实验在保证产品产率和纯度的前提下,缩短了反应时间,NaOH 溶液用于除去反应中产生的副产品,避免有毒气体的泄漏,保护了实验环境。
2.2 制备工艺条件优化及结果
在铁与稀硫酸反应制备硫酸亚铁溶液时,常常出现所得的溶液不是浅绿色溶液,而易出现黄绿色溶液,说明Fe2+发生了明显的氧化。一些文献[16-19]是将铁与过量的稀H2SO4反应制得FeSO4溶液。与此相反,有些文献[8,20-22]指出,在制备FeSO4溶液时应使铁过量,但文献[23]说应控制铁过量,文中用的是2g铁粉与3mol/L H2SO4溶液15mL反应,显然是硫酸过量,彼此矛盾。因此,探索最佳制备工艺方法与工艺条件,澄清文献中的有关矛盾,对提高实验教学质量和学生的环保意识都具有重要的现实意义,并可推动绿色化学的发展。对于硫酸亚铁铵晶体的颜色,在现行实验教材中也有多种说法,如浅蓝绿色、浅绿色、浅蓝色[24]等,以至于有的高校在普通化学实验期末试题中出现相关试题而无法评分的现象。尽管对硫酸亚铁铵制备实验改进的文献报道不少,其内容大同小异,但对这些关键而矛盾的问题还未见文献给予澄清说明。
2.2.1 铁与稀硫酸的摩尔比的优化结果
铁过量或稀硫酸过量的出发点都是为了防止Fe2+的氧化。当铁过量时,尽管Fe3+可以被还原为Fe2+,但稀硫酸消耗完而溶液的pH 高于2后,Fe2+很容易被氧化,溶液出现明显的黄色。而稀硫酸适当过量时,铁反应完全、几乎没有气泡时,溶液保持适当的酸度(pH =1~2),硫酸亚铁溶液较为稳定,并呈浅绿色。铁过量,而溶液酸度也较高,此时说何者过量应该不妥,因为反应还没有进行完全。
固定铁粉1.00g、反应温度90 ℃、硫酸铵2.37g,改变2mol/L H2SO4溶液体积,探讨铁与硫酸的摩尔比对硫酸亚铁铵产品纯度和产率的影响,反应至无气泡约需50min左右,实验结果见表1。从表1可知,硫酸用量不足时溶液呈黄绿色,产品中Fe3+较多,纯度也不高;当铁与硫酸的摩尔比在1.0∶1.1~1.0∶1.3时对硫酸亚铁铵的产率和纯度没有多大影响。综合考虑,我们选用其摩尔比n(Fe)∶n(H2SO4)=1.0∶1.2。
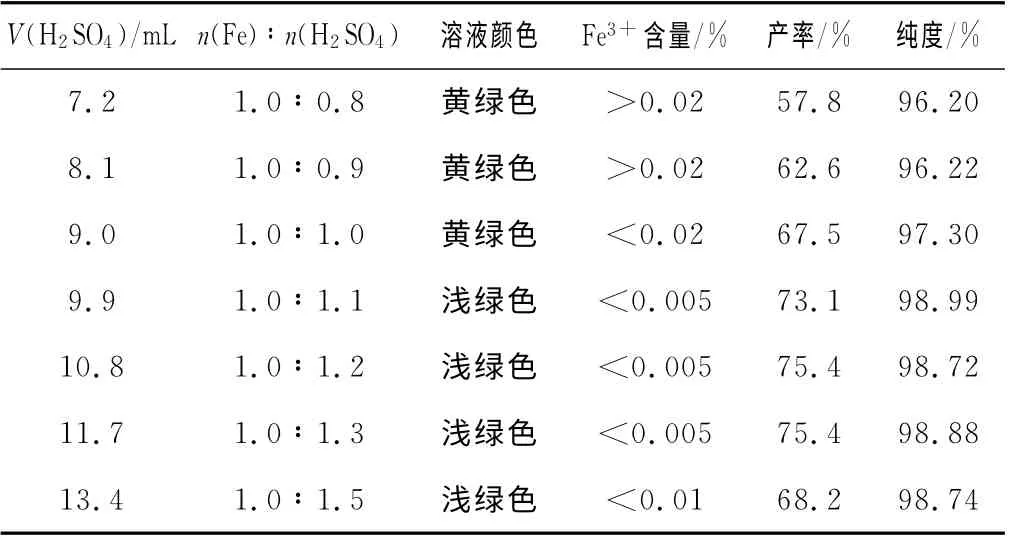
表1 铁与硫酸的摩尔对硫酸亚铁铵纯度和产率的影响
2.2.2 硫酸溶液浓度的优化结果
硫酸溶液的浓度要适当,若浓度过低则反应速度慢;若浓度过高,一方面溶液的体积少,生成的硫酸亚铁容易结晶析出,另一方面其氧化性也会增加,易产生Fe3+、SO2,使溶液出现黄色[13]。实验表明,硫酸溶液的浓度控制在1~3 mol/L 之间较好,本实验中选用2mol/L的H2SO4溶液。
2.2.3 反应温度的优化结果
反应温度是影响反应速度的重要因素,温度低则反应速度较慢,升高温度反应速度加快。由于是教学实验,需要在一定时间内完成,反应时间不能太长。固定铁粉1.00g、铁与稀硫酸的摩尔比为1.0∶1.2、硫酸铵2.37g,探讨铁与稀硫酸的反应温度对硫酸亚铁铵产品纯度和产率的影响,实验结果见表2。从表2可知,铁与硫酸反应的温度在70~100℃范围内,对硫酸亚铁铵的产率和纯度没有多大影响。综合考虑,我们选用反应温度为100 ℃。
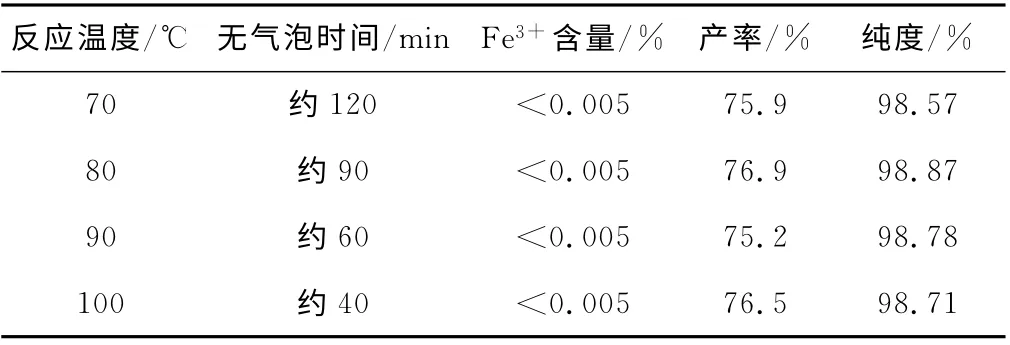
表2 铁与硫酸反应温度对硫酸亚铁铵纯度和产率的影响
2.2.4 硫酸铵的用量的优化结果
固定铁粉1.00 g、铁与稀硫酸的摩尔比为1.0∶1.2、反应温度100℃,探讨硫酸铵的用量对硫酸亚铁铵产品纯度和产率的影响,实验结果见表3。从表3可知,硫酸铵用量不足时,因硫酸亚铁的溶解度与产物的溶解度差别不大,易与产物一起结晶析出,而后被空气中的氧气氧化,使产物的纯度降低而Fe3+含量偏高;因硫酸铵的溶解度与产物的溶解度相差较大,故硫酸铵可适当过量,但用量过多时,也会或多或少与产物一起结晶析出,从而使硫酸亚铁铵的纯度降低。因此,硫酸铵用量以n(Fe)∶n[(NH4)2SO4]=1.0∶1.0计算值加入为宜。同时,硫酸亚铁溶液与硫酸铵混合后,溶液酸度要保持pH 在1~2,否则溶液易变为黄色。
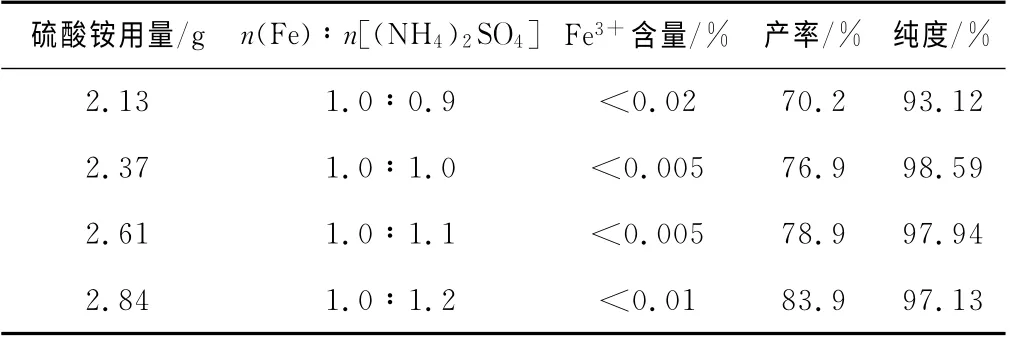
表3 硫酸铵用量对硫酸亚铁铵纯度和产率的影响
3 结论
通过对硫酸亚铁铵制备实验内容的“减量化、绿色化”改进研究,得到其制备工艺条件为n(Fe)∶n(H2SO4)=1.0∶1.2、n(Fe)∶n[(NH4)2SO4]=1.0∶1.0,1.0g铁屑用2mol/L的H2SO4溶液在100℃反应40min左右时,所得产品为浅绿色晶体,产率达76%以上,纯度98.5%以上,Fe3+含量低于0.005%。改进后的实验澄清了文献中的有关矛盾说法,在常规仪器中完成实验教学,在保证产品质量达到Ⅰ级标准的前提下,试剂用量比传统实验减少50%以上,实验时间缩短三分之一以上,可大幅度降低实验消耗、节省实验经费,减少环境污染,增强广大师生环保意识,推动绿色化学的发展。
(
)
[1]钟国清.化学实验教学的绿色化改革与实践[J].实验技术与管理,2006,23(12):18-19.
[2]钟国清.无机及分析化学实验[M].北京:科学出版社,2011.
[3]徐常龙,曹小华,刘新强,等.绿色化学实验设计初探[J].实验技术与管理,2009,26(11):137-139.
[4]汪丰云,王小龙.硫酸亚铁铵制备的绿色化设计[J].大学化学,2006,21(1):51-53.
[5]杨毅,练必荣,程声娟.无机实验合成产物再利用开放教学的探讨[J].实验技术与管理,2010,27(6):143-146.
[6]吴茂英,肖楚民,韩峭峰,等.无机化学实验微型化的新尝试及其教学效果[J].实验技术与管理,2008,25(3):16-19.
[7]钟婵娟,谢宝华,曹小华,等.化学实验“绿色化”四法[J].实验技术与管理,2010,27(3):140-141.
[8]姜述芹,马荔,梁竹梅,等.硫酸亚铁铵制备实验的改进探索[J].实验室研究与探索,2005,24(7):18-20.
[9]翟丽萍,孟杰,裴力民,等.硫酸亚铁铵制备工艺的研究[J].精细与专用化学品,2011,19(3):16-19.
[10]刘少华,田博士.硫酸亚铁铵制备实验的绿色化改进[J].广州化工,2011,39(12):162-163.
[11]崔爱莉.基础无机化学实验[M].北京:高等教育出版社,2007:62-64.
[12]王嗣祖,韩莉,奂东兰,等.改进教材中硫酸亚铁铵的制备方法[J].阴山学刊,2011,25(2):38-40.
[13]曾琦斐.硫酸亚铁铵的制备方法研究[J].化学工程与装备,2011(4):23-25.
[14]马超平,卢旭晓,邓绍强,等.硫酸亚铁按制备的微型实验[J].湛江师范学院学报,2003,24(3):103-106.
[15]陈彦玲,徐林林,林世威.硫酸亚铁铵制备方法微型化的研究[J].长春师范学院学报:自然科学版,2011,30(1):73-75.
[16]浙江大学普通化学教研组.普通化学实验[M].3版.北京:高等教育出版社,1996:66-68.
[17]耿金灵,王岩,殷海燕.硫酸亚铁铵的纯度和组成的测定[J].实验技术与管理,2009,26(5):33-36.
[18]苗兰兰,毕小平,葛新,等.高校化学实验:硫酸亚铁铵的制备工艺[J].山西医科大学学报,2003,34(2):167-168.
[19]娄军芳,倪弘昕.硫酸亚铁铵的绿色制备[J].广州化工,2011,39(24):164-165.
[20]南京大学《无机及分析化学实验》编写组.无机及分析化学实验[M].4版.北京:高等教育出版社,2006:70-72.
[21]周宁怀.微型无机化学实验[M].北京:科学出版社,2000:33-35.
[22]周井炎.基础化学实验:上册.[M].2版.武汉:华中科技大学出版社,2008:15-16.
[23]王锐.对硫酸亚铁按制备实验的探讨[J].邯郸农业高等专科学校学报,2005,22(1):16-18.
[24]浙江大学化学系.新编普通化学实验[M].北京:科学出版社,2005:39-42.

