水合物法分离烟道气中CO2 的实验及模拟研究
刘爱贤, 赵光华, 阿不都热合木, 廖志新, 郭绪强
(中国石油大学(北京)重质油国家重点实验室,北京102249)
以CO2为主的温室气体排放是造成温室效应的主要原因,其中煤、石油、天然气等化石燃料燃烧所排放的CO2约占总排放量的2/3[1]。在合成氨工业中,以天然气为原料的氮肥厂生产的液氨相对富余,而CO2少,达不到CO2和NH3的平衡,为了提高尿素的产能,需要补充部分CO2。目前,通常的解决措施是从燃气锅炉的烟道气中回收CO2作为尿素的补充原料气。这样,一方面能够提高经济效益,另一方面能够降低温室气体排放量。
常 规 的CO2分 离 方 法 有:吸 收 法[2-3]、吸 附法[4-5]、深冷法、膜分离法[6-7]等。这些方法在分离烟道气中CO2时既存在相应的优势也存在一定缺陷,如化学吸收法存在吸收剂对设备的腐蚀问题;深冷分离法的能耗较高,而且通常对高浓度CO2分离比较有利;膜分离过程中对膜材料的分离性能要求高,膜的使用要求高等。水合物法作为一种新的分离技术近年来受到国内外的广泛关注,该方法不存在设备腐蚀问题,也不需要昂贵的材料,工艺相对简单。詹昊等[8]曾对添加剂对水合物法回收烟道气中的CO2进行了总结。合成氨工业所排放的烟气中约含摩尔分数为10%的CO2,另外还含有摩尔分数为2%~3% 的O2,N2为平衡气体。由于O2和N2生成水合物的相平衡条件比较接近[9],为便于计算和实验处理,可近似把烟道气看成CO2+N2的混合气体。由于CO2比N2更容易生成水合物,CO2可以在水合物相中富集,从而实现烟道气中CO2的分离。2000年,S.P.Kang和H.Lee等[10-11]研究发现CO2(摩尔分数为17.0%)+N2在273K、7 MPa下能够在纯水中生成水合物。2007 年,P.Linga等[12]研究了CO2(摩尔分数为16.9%)+N2在273.7K,10 MPa下纯水中分离实验,CO2的回收率为42%,分离因子为13.2。尽管水合分离过程能够实现,但存在操作压力过高,水合物生成速率过低等问题。
CO2+N2混合气体生成水合物的难易程度取决于CO2/N2的相 对浓度[13-14],由于合成氨工业所排放的烟道气中CO2的浓度较低,生成条件比较苛刻,所以笔者利用四氢呋喃(THF)作为促进剂进行了水合物法分离CO2+N2混合气体的实验研究,讨论了压力对两相组成以及分离性能的影响,并采用气-水合物两相闪蒸模型计算平衡气相以及水合物相CO2的摩尔组成。
1 实验部分
1.1 实验装置及原料
实验装置的主体部分为高压半可视反应釜,反应釜的容积为220mL,耐压为20.0MPa,釜内气体水合物的生成与分解现象通过LG100H 型冷光源进行观察。高压反应釜中的压力由手动加压泵调节。此高压釜内体系的温度由一个安装在高压釜壁上的温度传感器进行测量。反应釜的压力由数字压力计进行测量。实验所用CO2/N2混合气体由北京市北温气体制造厂提供,其中CO2的摩尔分数为9.06%,THF纯度为99.9%,去离子水为实验室自制。
1.2 实验方法
用去离子水将反应釜清洗干净,将配制好的摩尔分数为6.0% THF溶液润洗反应釜3次,用真空泵将系统抽真空,按气液体积比40 吸入THF 溶液。启动空气浴,设定其温度,当反应釜温度达到设定值,并稳定后,通入实验气体至设定压力。然后开启搅拌,并在反应过程中维持搅拌速度基本恒定。反应开始后,注意观察釜内压力,当压力降低时,转动加压泵推动活塞移动,以保持釜内压力恒定,一般4~6h后反应即达到平衡(判断标准为釜内气相压力在30min内不再变化),关闭进气阀,对平衡后的气相取样进行色谱分析。相同的温度、压力条件下至少取样2次,分析结果偏差符合要求则认为气相取样结束。然后降低体系温度至268.15K,以保证生成的水合物稳定存在[15-16]。打开出气阀,将原来的平衡气相全部排空。之后关闭出气阀后升温,使生成的固体水合物全部化解,取化解气进行色谱分析确定水合物相的气体组成。
1.3 CO2 的回收率和分离因子
CO2的回收率可由式(1)进行计算:

CO2的分离因子可由式(2)进行计算:
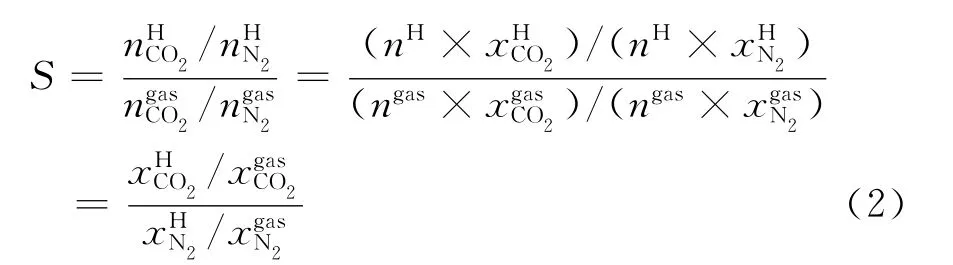
2 结果与讨论
2.1 压力对两相组分的影响
图1为摩尔分数为6.0% THF体系中,温度为278.15~281.15K 时,平衡气相和水合物相中CO2的摩尔组成随压力的变化关系。从图1 中可以看出,平衡气相和水合物相中CO2的摩尔分数均随着压力的增大而逐渐降低。在278.15K、0.8 MPa条件下,经过一个平衡级的分离CO2在水合物相能够富集到摩尔分数为22.37%的CO2,说明水合物法可以很好地实现CO2的捕集。
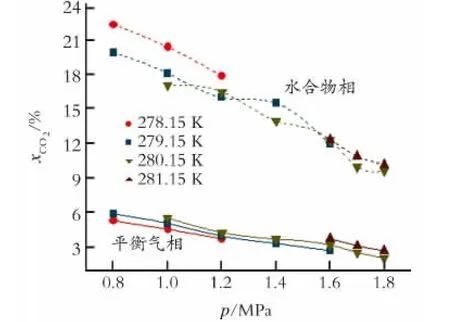
图1 平衡气相和水合物相中CO2 组成随压力的变化Fig.1 Concentration of CO2at different pressure
由于THF在纯水体系生成Ⅱ型水合物,THF分子只占据Ⅱ型水合物的大孔,气体分子占据Ⅱ型水合物的小孔。在相同的温度条件下,压力越大,CO2进入水合物相的推动力增强,使得平衡气相中CO2的含量降低。在相同气液体积比和同一温度下,压力越大,N2的分压也越大,当CO2优先进入水合物相后,随着CO2分压降低,N2的分压也可能增大到N2相平衡压力之上,使得N2进入水合物相的能力增强,这样较小的N2分子在水合物小孔中的存在会影响较大分子CO2在孔穴的填充[12],也就会造成水合物相中CO2的含量降低。总体来说,平衡气相和水合物相CO2的含量均降低是水合反应推动力以及两种气体分子在孔穴相互竞争的结果。
2.2 压力对分离性能的影响
图2和图3分别是CO2的回收率和分离因子随压力的变化。从图2和图3中可以看出,在实验范围内CO2的分离因子在3.5~5.5,CO2的回收率在28%~49%。
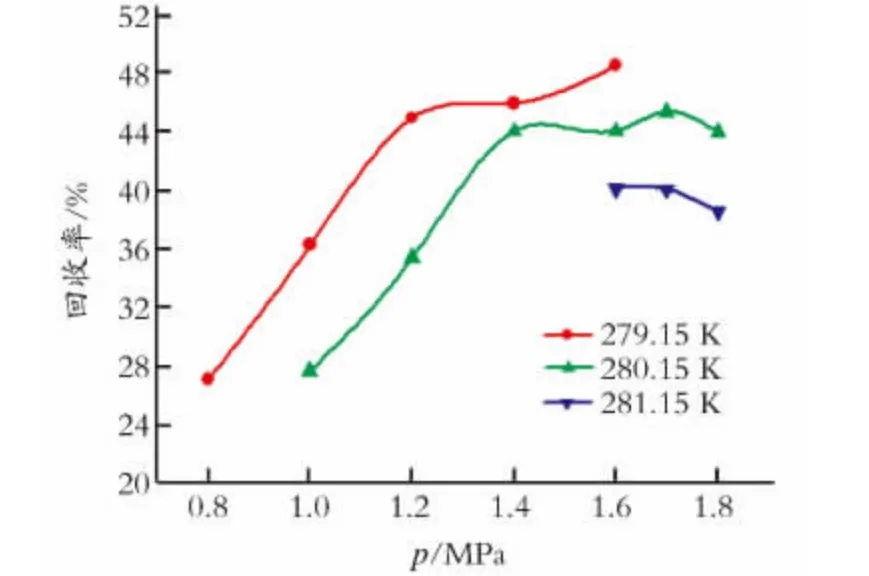
图2 CO2 的回收率随压力变化Fig.2 Recovery of CO2at different pressure
从图2中可以看出,在279.15K、1.6 MPa下CO2的回收率能够达到48.55%。在不同温度下,变化趋势基本一致。因为系统压力越大,水合反应推动力越大,气体进入水合物相的能力增强,更多的气体进入水合物相,但同时N2进入水合物相的能力也相应地增强,这样,受水合反应推动力以及两种气体相互竞争的结果,造成了不同温度下CO2的回收率随压力的变化规律存在一定的差异。
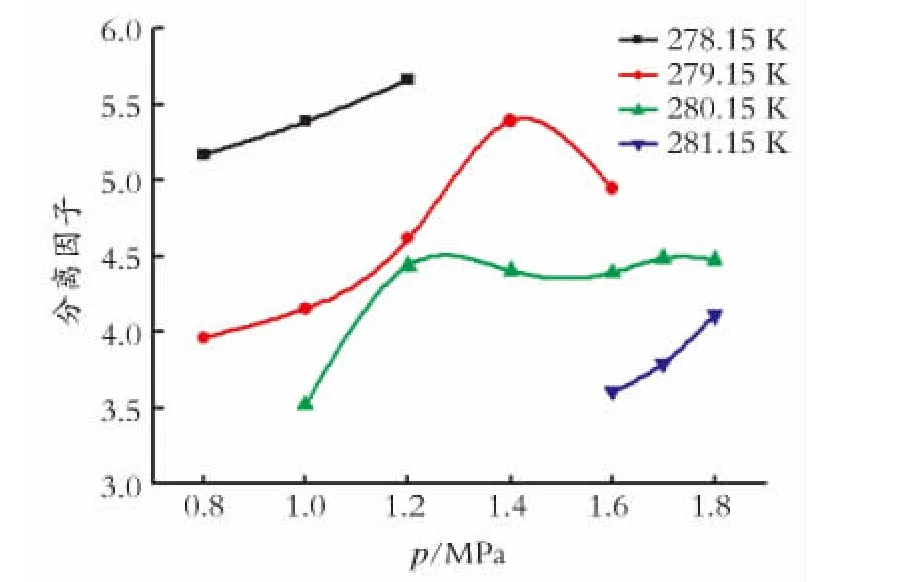
图3 CO2 的分离因子随压力变化Fig.3 Separation factor of CO2at different pressure
从图3中可以看出,在278.15K、1.2 MPa时CO2的分离因子能够达到5.66。在279.15 K 和280.15K,CO2的分离因子呈现先增加后降低的趋势。主要由于压力越大,水合反应速度加大,THF自身与水迅速反应,生成的水合物较为致密,水合物中的小孔填充率较低,不利于CO2进入水合物相,从而导致了以上结果的出现。
3 气-水合物两相闪蒸计算
由于混合气体中CO2的摩尔分数为9.06%,含量较低,气-水合物两相闪蒸计算过程忽略CO2在水中的溶解度。同样,也忽略气相中水蒸气的含量,认为水完全转化为水合物,只对气体干基组成进行计算。
总物料平衡和组分物料平衡的表达式为:
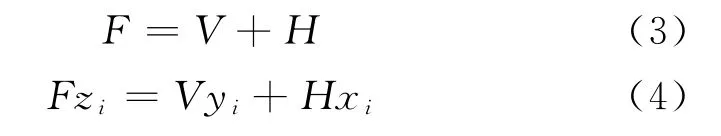
式中,F、V、H 分别代表进料气的物质的量、平衡时气相和水合物相的物质的量。zi、yi、xi分别代表进料气相、平衡气相和水合物相中组分i的摩尔分数。定义e为气化分率,则式(4)可以写成:
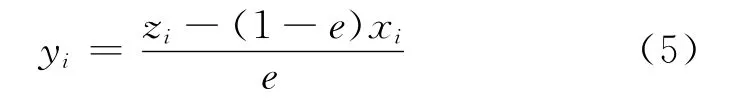
基于Chen-Guo模型[9],水合物相中组分i的摩尔分数为:
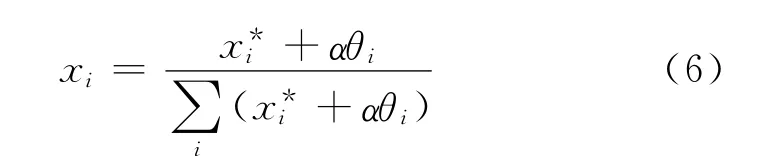
式中,x*i为气体i形成的基础水合物在混合基础水合物中所占的摩尔分数。α 为水合物的结构参数,对于CO2-N2-THF体系,α=2(Ⅱ型)。θi为气体i在连接孔中的填充率。
气-水合物两相闪蒸过程中,含水量的多少将直接影响水合物相的组成和相分率。用W 表示进料气-液体系中水的摩尔分数,则进料含水量与气化分率e关系为:
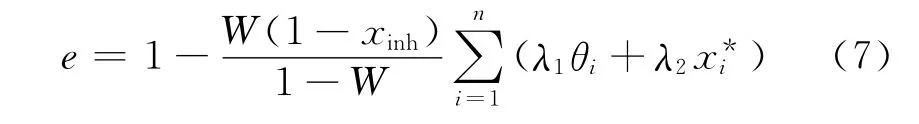
式中,xinh为液相中THF 的摩尔分数,λ1和λ2为水合物结构参数,对于CO2-N2-THF 体系,λ1=2/17,λ2=1/17(Ⅱ型)。
采用气-水合物两相闪蒸模型计算平衡气相与水合物相组成的具体计算步骤如下:
①输入温度T、压力p、进料气相组成zi以及含水量W,由PT 状态方程计算进料气相中各组分的逸度[16];
② 由Wilson 活度模型计算水的活度以及THF的逸度fTHF[17];
③由Chen-Guo模型计算组分i在水合物相中的填充率θ、∑iθi以及纯基础水合物i在当前温度下的平衡蒸汽逸度f0i,以及基础水合物的组成x*i;
④由式(6)计算水合物相的组成xi,由式(7)计算气化分率e;
⑤由式(5)计算平衡气相组成yi,以T、p 和yi为已知条件重新计算气相组分i 的逸度fVi,进而求出水合物相中组分i的填充率θi和基础水合物的组成x*i;
⑥分别由式(6)和式(7)重新计算新的水合物相组成xi和新的气化分率e′;
⑦比较e′和e 之间的相对误差是否小于允许值(本计算中设定汽化分率的变化小于0.000 1),若不小于允许值则重复步骤(5)和(6),直至满足允许值为止;
⑧输出气化分率e,平衡气相组成yi和水合物相组成xi;
根据上述计算过程,对实验条件下CO2-N2-THF体系水合分离实验进行了相平衡模拟计算,并与实验值进行对比,结果如表1所示。
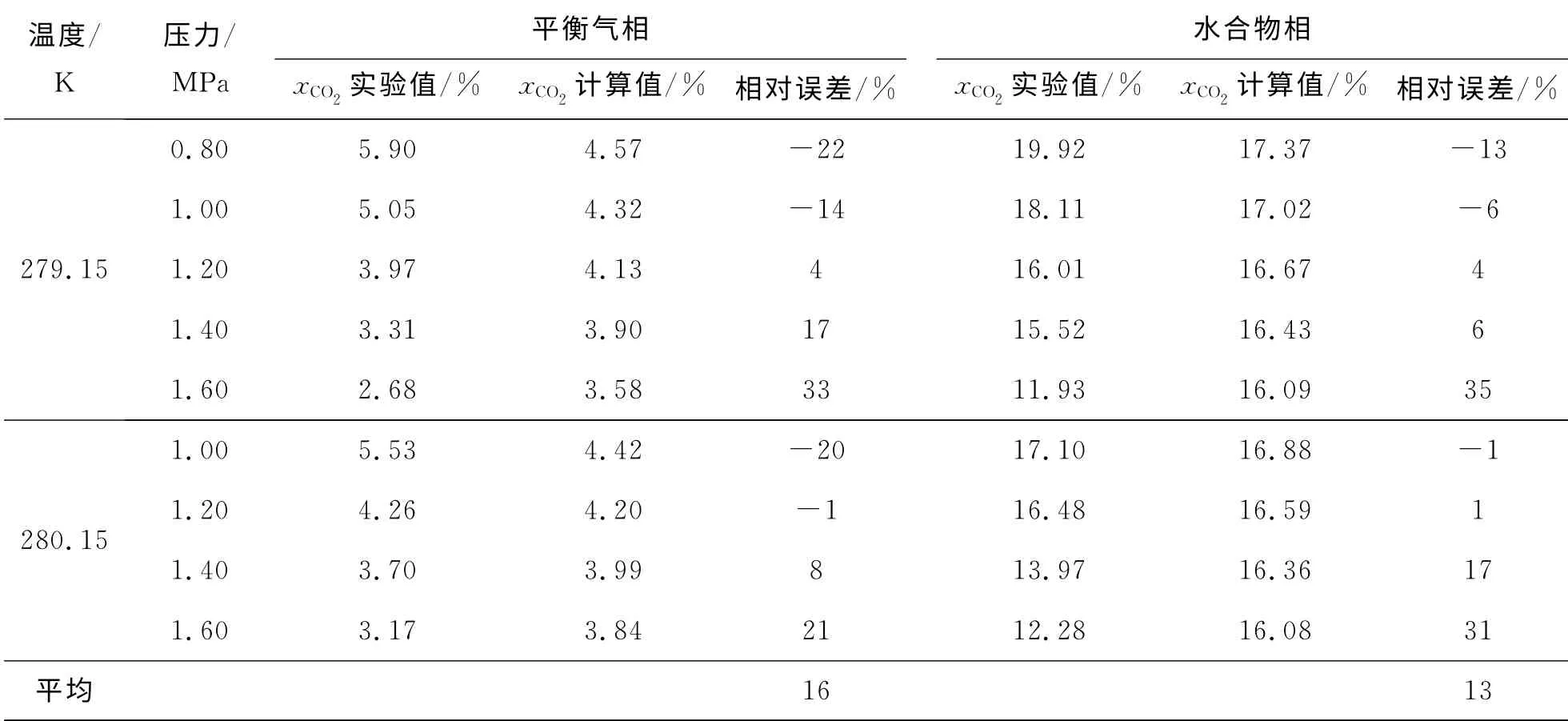
表1 实验值与模拟计算值的对比Table 1 Concentration of CO2at different temperature and pressure
由表1可以发现气-水合物两相闪蒸模型在一定程度上能够预测平衡气相和水合物相中CO2的组成,但存在一定误差,平衡气相的计算值与实验值的平均相对误差为16%,水合物相的计算值与实验值的平均相对误差为13%。但是气相和水合物相相对误差的最大值达到了产生误差33%和35%,分析其主要的原因如下:(1)两相闪蒸计算忽略了气体在水中的溶解度,实际上CO2在THF 存在时的溶解度还未见报道,当系统的压力升高时,溶解度的影响就会增加,这个忽略造成了计算值与实验结果存在偏差。(2)THF 和水为极性流体,对此类混合流体的相平衡以及热力学性质的计算精度还不高,而这些计算的精度将直接影响两相闪蒸的预测效果。
4 结论
针对以天然气为原料合成氨和生产尿素工艺对CO2需求的情况,开展了水合物法回收烟道气中CO2的研究,得到了以下结果:
(1)采用恒温恒压法对CO2+N2(CO2摩尔分数为9.06%)在摩尔分数为6.0% THF 溶液的一级 水 合 分 离 结 果 进 行 分 析。在 温 度2 7 8.1 5~281.15K,压力0.8~1.8 MPa,摩尔分数为6.0%THF存在下,相同温度下,平衡气相和水合物相中CO2的摩尔组成随压力的增大而降低,CO2的最大回收率是48.55%,最大分离因子是5.66。
(2)应用气-水合物两相闪蒸模型预测CO2+N2在摩尔分数为6.0% THF 溶液的平衡气相以及水合物相的气体组成,并与实验结果进行对比,发现计算结果存在一定误差。这与模型的假设的适用性以及流体的相平衡和热力学性质有很大关系。今后应补充相关的实验数据并加强对计算过程方面的研究。
[1] 骆仲泱,方梦祥,李明远,等.二氧化碳捕集封存和利用技术[M].北京:中国电力出版社,2012.
[2] 王金莲,方梦祥,晏水平,等.吸收二氧化碳新型混合化学吸收剂的研究[J].环境科学,2007,28(11):2630-2636.
[3] James T Y,Kevin P R,Kathy R,et al.Semi-batch absorption and regeneration studies for CO2capture by aqueous ammonia[J].Fuel Processing Technology,2005,86:1533-1546.
[4] 费维扬,艾宁,陈建.温室气体CO2的捕集和分离-分离技术面临的挑战和机遇[J].化工进展,2005,24(1):1-4.
[5] 魏建文.介孔二氧化硅改性及其吸附CO2研究[D].杭州:浙江大学,2009.
[6] 秦向东,温铁军,金美芳.脱除与浓缩CO2的膜分离技术[J].膜科学与技术,1998,18(6):7-13.
[7] Li Jing-Liang,Chen Bing-Huang.Review of CO2absorption using chemical solvents in hollow fiber membrane contactors[J].Seperation and Purification Technology,2005,41:109-122.
[8] 詹昊,曾志勇,李小森,等.添加剂对水合物法回收烟气中二氧化碳影响的研究进展[J].现代化工,2011,31(12):12-17.
[9] 陈光进,孙长宇,马庆兰.气体水合物科学与技术[M].北京:化学工业出版社,2008.
[10] Kang S P,Lee H.Recovery of CO2from flue gas using gas hydrate:Thermodynamic verification through phase equilibrium measurements[J].Environ.Sci.Technol.,2000,34(20):4397-4400.
[11] Kang S P,Lee H,Lee C S,et al.Hydrate phase equilibria of the guest mixtures containing CO2,N2and tetrahydrofuran[J].Fluid Phase Equilibria,2001,185:101-109.
[12] Linga P,Adeyemo A,Englezos P.The clathrate hydrate process for post and pre-combustion capture of carbon dioxide[J].Journal of Hazardous Materials,2007,149:625-629.
[13] Li Shifeng,Fan Shuanshi,Wang Jingqu,et al.CO2capture from binary mixture via forming hydrate with the help of tetra-n-butyl ammonium bromide[J].Journal of Natural Gas Chemistry,2009,9:15-20.
[14] Fan Shuanshi,Li Shifeng,Wang Jingqu.Efficient capture of CO2from simulated flue gas by formation of TBAB or TBAF semiclathrate hydrates[J].Energy &Fuels,2009,23:4202-4208.
[15] Tang J F,Li X G,Li Y X,et al.Experimental study on natural gas hydrate stability[J].Natural Gas Industry,2008,25:125-128.
[16] 廖志新,郭绪强,李遵照,等.非烃气体置换CH4水合物的实验研究[J].石油化工高等学校学报,2013,26(4):1-5.
[17] 郭天民.多元气液平衡和精馏[M].北京:石油工业出版社,2002.

