透明背脊皮翼视窗在肿瘤活体成像中的应用
许改霞,翟 鹏,林苏霞,饶南熹,朱小妹,王晓梅,牛憨笨
1)深圳大学光电工程学院,光电子器件与系统教育部/广东省重点实验室,深圳518060;2)深圳大学医学院,深圳市生物医学工程重点实验室,深圳518060
肿瘤发生是一个复杂的多因素、多阶段过程,是个体基因不稳定性及包括人类生活方式在内的环境因素等共同作用的结果,研究肿瘤的发生发展机理,对肿瘤治疗方法和新药开发具有重要意义. 20世纪70 年代,Judah 等[1]首次提出不断生长的肿瘤血管可以产生内皮生长因子,刺激产生新的血管,从而为肿瘤组织的生长提供氧气及其他营养物质,并将代谢产物转运出去. 此发现一经报道,就引起学者们的广泛关注,围绕肿瘤血管再生研究,旨在寻找有效药物抑制肿瘤局部血管增生,从而“饿死”肿瘤. 随着治疗技术和检测手段的发展,肿瘤药物研究方面取得巨大进步,尤其是掌握了与肿瘤发生相关的若干基因;但在肿瘤发生机制方面,由于与癌症相关的基因并非单独起作用,它们之间存在极为复杂的相互关联,因此肿瘤机制研究相对缓慢.
然而,荧光标记物如各种染料标记物和荧光蛋白的发展,以及各种新型成像技术的出现,为肿瘤活体成像带来新希望,背脊皮翼视窗(dorsal skin fold window chamber,DSFC)也在肿瘤研究中展现独特的优势和发展潜力. 本文综述背脊皮翼视窗的特点及发展历史,介绍背脊皮翼视窗的构建方法及与之相关的光学活体成像方法,指出其在肿瘤活体成像研究中的应用前景.
1 背脊皮翼视窗的历史沿革
1.1 结构改进
1924 年,Branemark 等[2]首次将中空的金属环植入兔耳,暴露出视窗中心部位的血管和组织,形成透明光学视窗,对兔耳局部组织生长进行活体显微观察,为活体成像开辟新思路. 该视窗几乎不用考虑组织自发荧光及光传播过程中在组织内的吸收与散射,在相同分辨率条件下成本大大低于其他活体成像系统,且耳部血管及组织在视窗内清晰可见,成像效果良好. 此外,由于窗口操作减小了常规动物实验创伤引起的应激反应,同时可以保证较长时间内获得优质图像,具有实时、原位和长时间监测等观察特点,很快被用于活体组织生长、血管再生和血液循环等方面研究. 然而,由于实验兔的肉芽组织生长较慢,用于肿瘤研究制作周期太长,且维护和操作费用较高,限制了视窗模型的应用.
1943 年,Beverly 等[3-4]改进了Branemark 的透明视窗技术,将兔耳视窗发展为小鼠背脊皮翼视窗. 即把小鼠背部皮肤褶压入一个由两块合金材料组成的环形夹板中,暴露视窗中心部位,实现对小鼠皮下组织及微循环的观察,这是第一次完全意义上实现了对肿瘤、肿瘤周围血管以及宿主皮下组织的长时间、原位和实时观测,这种被称为背脊皮翼视窗的透明视窗模型,形成现代透明视窗的雏形.
现在背脊皮翼视窗基本沿袭了Beverly 等人设计的视窗结构. 但因当时材料的限制,视窗重量过大,不利于小型动物的正常活动,且视窗稳定性较差,无法满足长时间光学成像的要求.
1.2 材料发展
1970 年,Arfors 等[5]将钛合金材料引入视窗构建. 钛合金重量轻,生物相容性好,具有较低的热传导率和良好的生化惰性,极大改善了不锈钢视窗的不足. 此后,由于模型动物培养技术的发展,人们对视窗的细微结构进行优化,兼顾操作灵活性、实用性和稳定性等方面,将视窗技术拓展到其他啮齿类动物模型研究,如仓鼠颊囊透明视窗[6]、大小鼠头骨部视窗[7]和小鼠乳腺脂肪板视窗[8]等. 由于小鼠在病理学研究方面历史较长,技术相对成熟,故小鼠背脊皮翼视窗是所有视窗中应用最广泛的.
图1 为典型背脊皮翼视窗的基本结构:主要由后固定片、定位环、紧固环、前固定片和皮肤压片(玻璃盖片)组成,仅2.7 g. 两个固定片材料均为钛合金,定位环材料为铜铍合金,每个固定片都有两个侧向直角法兰,便于安放在动物背部,固定片中心为直径15 mm 的圆孔,即光学观察视窗. 构建背脊皮翼视窗时,固定片将实验动物的背部皮肤像三明治一样夹起来,定位环嵌套在前固定片内部,紧固环将皮肤压片锁在定位环内,通过螺丝螺帽将整个系统固定在小鼠背部,最后观察视窗与显微系统耦合即可进行光学实时成像[9].

图1 背脊皮翼视窗[10]Fig.1 Dorsal skin fold window chamber[10]
1.3 标记物发展
早期的背脊皮翼视窗,仅用于观察活体局部组织形貌的变化,并未引入荧光标记物. 随着研究领域的拓宽和新型荧光成像手段的介入,人们开始将荧光标记物引入视窗观测模型中[7],常用的荧光染料有异硫氰酸荧光素 (fluorescein isothiocyanate,FITC) -凝集素和FITC -葡聚糖等. FITC 的荧光强度与活细胞数量成正比,具有很高的精确度,但想得到稳定表达荧光素的细胞株,其操作复杂,且光漂白现象明显,不利于长时间检测,在与血液有关的机制研究中受到局限;1997 年,Takashi 等[11]将绿色荧光蛋白 (green fluorescent protein,GFP)引入视窗模型内的肿瘤细胞示踪,用于观察特定肿瘤细胞的游走、迁移和生长情况,此后,GFP、增强型绿色荧光蛋白(enhanced green fluorescent protein ,EGFP)和红色荧光蛋白 (red fluorescence protein,DsRed)等荧光蛋白在活体成像中也得到广泛应用. 虽然使用荧光蛋白转染的细胞稳定性和特异性提高了,但同FITC 一样,也存在光漂白现象;之后,作为新型荧光标记物的量子点 (quantum dots,QDs)被用于视窗模型[12],由于其具有发光亮度高和不易光漂白等优良光学特点,使得长时间、高分辨显微结构成像成为可能,极大的推动了活体成像在肿瘤方面的深入研究.
1.4 背脊皮翼视窗推动肿瘤活体成像研究
至此,经过近90 年的发展,背脊皮翼视窗已成为肿瘤活体光学成像最重要的辅助工具之一,在肿瘤机制、肿瘤诊断和肿瘤治疗研究的各个方面发挥巨大作用. 2000 年,Li 等[13]利用视窗良好的光学成像效果,将少量(20 ~30 个)荧光标记的肿瘤细胞注入背脊皮翼视窗中,观察肿瘤的早期生长、血管再生以及微血管介导的肿瘤细胞转移,该研究对肿瘤早期的发生发展以及早期诊断具有重要意义;2002 年,Rakesh 等[14]首次运用背脊皮翼视窗研究肿瘤细胞间的间隙压力和肿瘤流体转移,拓展该技术的研究范围;2005 年,Matthew 等[15]将背脊皮翼视窗与多光子显微镜活体成像系统耦合,长时间跟踪肿瘤细胞向远端器官转移时的游走、捕获及附着过程,使视窗技术从原位癌研究拓展到癌症转移可视化领域;2005 年,Makale 等[16]制造双面视窗,其中一面是透明的成像窗口,另一面是平板氧气或葡萄糖的探测器,用于氧气和血糖检测以及器官和组织的移植研究,此时基于背脊皮翼视窗检测系统的输出已不仅是光学信号,同时还有传感器输出的电信号;此外,Matthew 等[17-19]用背脊皮翼视窗观察新药或纳米颗粒治疗肿瘤的过程,该应用可极大缩短新药的开发周期,对临床和医药产业都具有巨大推动作用. 近年来,中国学者也将背脊皮翼视窗引入癌症研究,并在肿瘤发生机制及物理治疗方法方面取得有意义的结果[20-21].
由此可见,背脊皮翼视窗已经并将继续在活体小动物局部微环境可视化研究中发挥重要作用,研究内容也由单一的肿瘤边缘、肿瘤区域血管生长的观测拓展到与肿瘤生长有关的细胞、肿瘤与周边血管之间的相互作用、肿瘤组织微环境、肿瘤治疗药物的靶向性及药效的观测,该技术将极大地推动肿瘤诊治过程可视化进程.
2 背脊皮翼视窗的构建
当前用于肿瘤研究的背脊皮翼视窗,大多基于裸鼠肿瘤模型动物构建. 实验用鼠的培养环境和手术操作程序都严格按照裸鼠建模步骤实施. 简单来讲,裸鼠在全麻后置于灭菌手术平台,背部皮肤褶压入两块钛合金夹板中,见图2. 定位螺丝将背脊皮翼视窗固定片定位在目标血管附近,剪刀剪开对应框架圆孔位置的皮肤圆孔(直径为1.4 cm),将肌肉暴露在视野中,建立光学视窗;构建肿瘤模型时将块状肿瘤组织或悬浮肿瘤细胞植入视窗皮下,而后将系统框架与小鼠缝合在一起.
植入肿瘤有两种方式:一种是肿瘤组织植入法,直接从建模成功的裸鼠取出肿瘤组织,切成1 mm 见方的小块植入到实验小鼠选定区域(通常为背部),盖玻片盖在肿瘤组织上方,压紧;另一种是肿瘤细胞注射法,将分散的肿瘤细胞注入皮下组织或肌肉组织中[22]. 两种方法都依靠肿瘤细胞自身生长、浸润与活体小鼠之间建立血液循环.
通常构建成功的背脊皮翼视窗,在显微镜视野下观察,盖玻片紧贴皮下组织,且透明、无斑点、无气泡,则血液流通正常. 若构建失败,则显微镜下光学细节模糊,肉眼可见血管部位失去血色,主要原因是创面细菌感染. 此外,活体成像的图像效果取决于肿瘤的扩散速度,若肿瘤细胞生长扩散很快,观察后期成像效果则变差.
3 基于背脊皮翼视窗的活体光学成像系统
传统光学成像系统,如体视显微镜或普通荧光显微镜,无法提供样品精细的三维信息,同时成像深度相对较小,因此近年来在透明背脊皮翼平台中应用较少. 配有高数值孔径物镜的单光子共聚焦显微成像系统,最高可达200 nm 的横向分辨率,见图3 (a). 多光子显微成像技术,只激发焦点区域的荧光分子,具有更高分辨率和灵敏度,见图3(b). 若用红外光谱激发,可达到几百微米的成像深度. 结合多色标记成像即可对多种感兴趣分子或结构进行同时观察,了解它们的相互作用. 利用光谱扫描和三维成像,可获得肿瘤部位多个参数,如肿瘤大小、血管再生、血流动力学、血管渗透性、间隙pH 值、间隙渗透及胶原蛋白结构等[3,23-25],这些参数都与肿瘤发展密切相关.
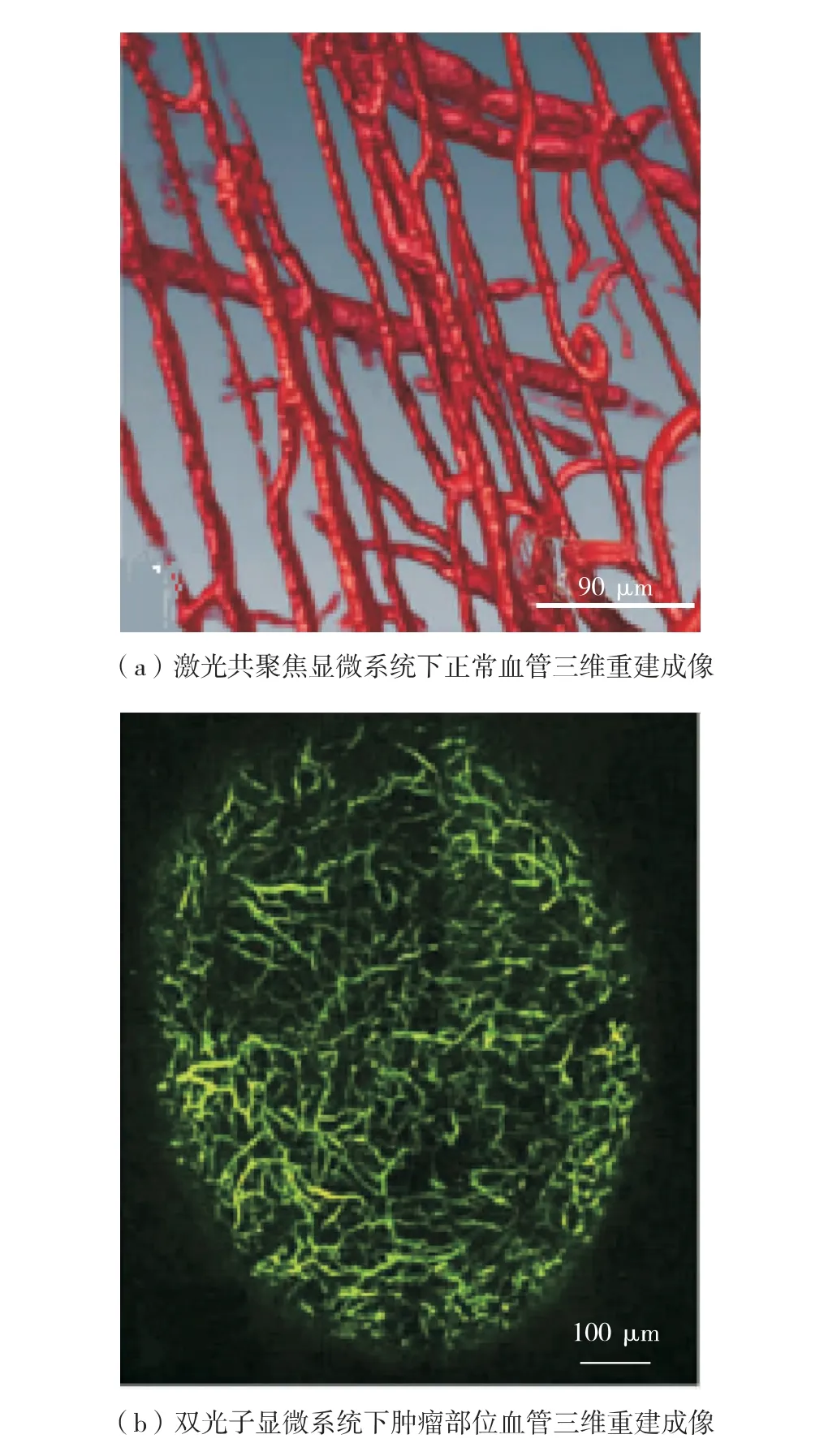
图3 基于背脊皮翼视窗的血管成像[25]Fig.3 Imaging of vascular based on the dorsal skin fold window chamber[25]
光学频率区域成像 (optical frequency domain imaging,OFDI)是一种基于扫频光源的、新型的光学相干层析成像技术[2],具有良好的分辨率、扫描成像速度以及成像深度,其最大特点是对于具有弹性光散射特性的样品,可得到三维方向分辨率均很高的图像,如图4. 新的光频区域成像结合多普勒技术可在大约10 min 内完成4 ~5 mm 肿瘤组织的三维图像,且成像深度可以达到1 000 μm. 这种散射信号基于机体内部血流运动的构建图像,无需其他外源性标记物,几乎毫无侵入性[26-28],是观察活体小动物血流情况的最佳方法.
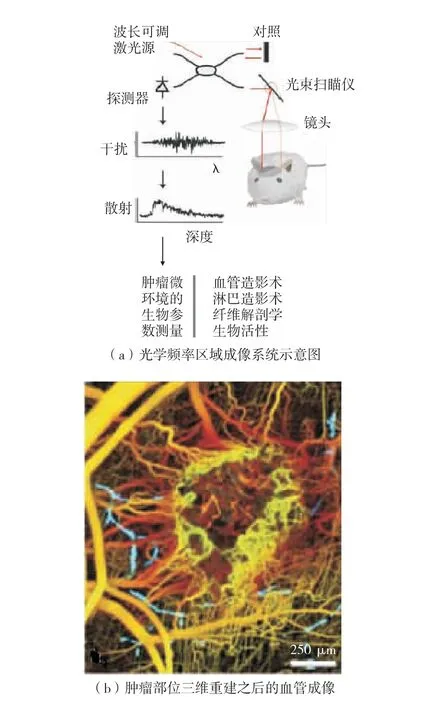
图4 基于背脊皮翼视窗的光频区域成像系统[27]Fig.4 optical frequency domain imaging system based on the dorsal skin fold window chamber[27]
4 背脊皮翼视窗在肿瘤研究中的应用
4.1 观测肿瘤组织的实时动态变化
在背脊皮翼视窗的帮助下,成像系统可长时间实时对活体动物进行微创成像,若利用低功率光源照明和成像,可得到活体小动物肿瘤组织长时间、连续变化的数据,利用图像分析软件进行数字化及其他处理,可得到肿瘤二维结构的数据,根据二维肿瘤结构的大小和成像深度计算可得肿瘤组织的体积,最后获得基于时间和形态学变化的肿瘤结构生长情况,这对肿瘤生长研究及临床肿瘤阶段的判断和治疗具有重要价值[29].
图5 (a)为本课题组构建的裸鼠背脊皮翼视窗模型,植入5 μL 浓度为105个/μL 的喉癌细胞Hep-2. 10 d 后,肿瘤生长情况如图5 (b). 可见,视窗中心肿瘤部位出现明显组织增厚、毛细血管密集弯曲的现象.
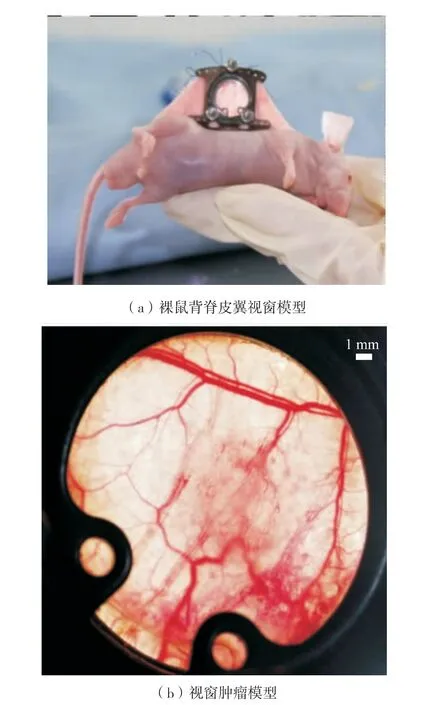
图5 裸鼠背脊皮翼视窗模型及视窗肿瘤模型Fig.5 Model of dorsal skin fold window chamber on nude mice and tumor model
4.2 观测肿瘤对于微血管的特征干扰
新生血管增多是多数肿瘤细胞、血管内皮细胞与其微环境相互影响的结果,是多数恶性肿瘤进展的标志. 同时,新生血管的形成对肿瘤细胞本身的增殖和生长必不可少,它还是肿瘤细胞侵袭转移的必要条件. 新生血管的各项参数还可作为判断肿瘤进展情况的指标,研究肿瘤对微血管的特征干扰对提示肿瘤发展机制具有重要作用. 利用背脊皮翼视窗可对关于血管的血流功能、血流动力、血氧、血管直径、血管密度、血管中白细胞、内皮细胞相互作用以及血管渗透性等诸多参数进行分析[30-32].
在实际研究中,先通过尾静脉注射将相关造影剂注入小鼠体内,再利用显微成像系统对造影血管进行连续拍照,最后通过离线图像分析软件对血管进行分析处理,便可得上述参数数据[24].
4.3 观测肿瘤局部血管外参数
肿瘤血管在结构和功能上与正常血管差别很大,造成肿瘤组织血供相对不足,瘤细胞的无氧代谢增加,乳酸堆积,因此肿瘤组织经常处于低营养、慢性乏氧和低pH 的综合状态. 大多数肿瘤细胞在这种不正常的负性微环境压力下难以存活,但是持续存在的代谢压力,会增加基因组的不稳定性,诱导新的肿瘤细胞克隆出现和扩增,导致肿瘤恶性度增高,及局部区域和远处转移的概率增加.同时,肿瘤血管内皮细胞具有抗氧化能力增强的特点,这是基于肿瘤血管内皮细胞的氧应激反应,它可通过受体酪氨酸激酶通路上调肿瘤内皮细胞一氧化氮合酶的表达,提高内源性一氧化氮(NO)减少氧损伤,降低免疫细胞的杀伤能力[33-34].
将特异性荧光标记物(pH 敏感、NO 或O2浓度敏感)注射到活体动物体内,应用背脊皮翼视窗对肿瘤组织局部进行监测,即可获得血管外参数信息,利用离线软件对图像中的信息进行分析处理,便可得到肿瘤局部的pH 值、组织NO 浓度或间隙O2浓度的值[15,23,30,34-36].
4.4 肿瘤相关基因研究
利用背脊皮翼视窗进行肿瘤基因研究,通常是为了检测特定基因启动子在基质和肿瘤细胞中的活动. 常见手段首先将启动子所驱动的荧光表达基因注入小鼠体内,一旦这种基因有所表达,相应的细胞系就会发出荧光,同时荧光强度会被实时记录,作为进行特定基因在肿瘤生长转移扩散中起作用的重要指标[29,37-38],这种方式具有高效、准确和实时的测量特点. 2007 年,Mark 等[39]阐述缺氧诱导因子-1 在肿瘤血管早期生长中的作用,通过质粒转染的方式,将缺氧诱导因子-1 与绿色荧光蛋白同时转染到大鼠乳腺癌细胞系中,而后将稳转的细胞植入背脊皮翼视窗模型,他们发现随着肿瘤的生长,缺氧诱导因子-1 表达量也随之增加,如图6.
2010 年,Gregory 等[40]利背脊皮翼视窗建立肿瘤部位三维氧压模型,更加形象地说明缺氧诱导因子1 基因与肿瘤生长密切相关.

图6 通过质粒转染绿色荧光蛋白的大鼠乳腺癌细胞荧光成像[39]Fig.6 Fluorescence imaging of rat mammary carcinoma cells transfected with GFP by lipofection[39]
4.5 抗肿瘤药物的研究
肿瘤的生长需要新生血管参与,因此在抗肿瘤药物中,有一类是专门使抗肿瘤血管生成的,其实质是通过抑制肿瘤新生血管达到治疗肿瘤的目的.从原理上说,抗肿瘤生成治疗对所有实体肿瘤都有效,作用对象是不同肿瘤组织中几乎相同的血管内皮细胞. 使肿瘤毛细血管萎缩,切断肿瘤的营养供应,使肿瘤得不到营养而慢慢“饿死”[41].
2010 年,Mamta 等[18]分别构建小鼠乳腺癌和人肾脏癌背脊皮翼视窗模型,研究肿瘤血管阻断剂Oxi4503 对上述两种肿瘤的治疗效果. 结果发现,这种血管阻断剂对人肾脏癌肿瘤组织血管仅有暂时性的血管阻断,6 h 后血管逐渐恢复;而对小鼠乳腺癌肿瘤部位血管则具有明显的血管阻断效果. 通过背脊皮翼视窗所提供肿瘤局部血管的精细结构信息,可提示肿瘤治疗药物的作用路径与机理,从而为检测肿瘤药物对血管再生的抑制提供一种直观手段,定量评价药物活体靶向性及抗肿瘤效果,缩短药物筛选的周期.
4.6 长时间高分辨动态成像
借助量子点荧光亮度高、抗光漂白等特点[42-47],研究者进行肿瘤血管渗透性、肿瘤靶向及抗肿瘤药物等方面的长时间高分辨动态成像研究[12,48-50].
2007 年,Voura 等[50]将具有特异靶向乳腺癌细胞的功能化量子点,通过尾静脉注射的方式,注入小鼠体内,而后利用背脊皮翼视窗荧光成像系统对视窗中的量子点进行追踪,捕捉到量子点从血管到进入肿瘤细胞核区域的6 个过程:在血管中运输→从肿瘤部位血管壁溢出到达肿瘤细胞间隙→肿瘤细胞外运动→特异性结合细胞膜上蛋白→通过细胞膜进入细胞→到达肿瘤细胞核区域,如图7. 这项研究实现了量子点在活体生物体内的单分子示踪,对肿瘤生长机理和抗肿瘤靶向药物研究具有深远意义.
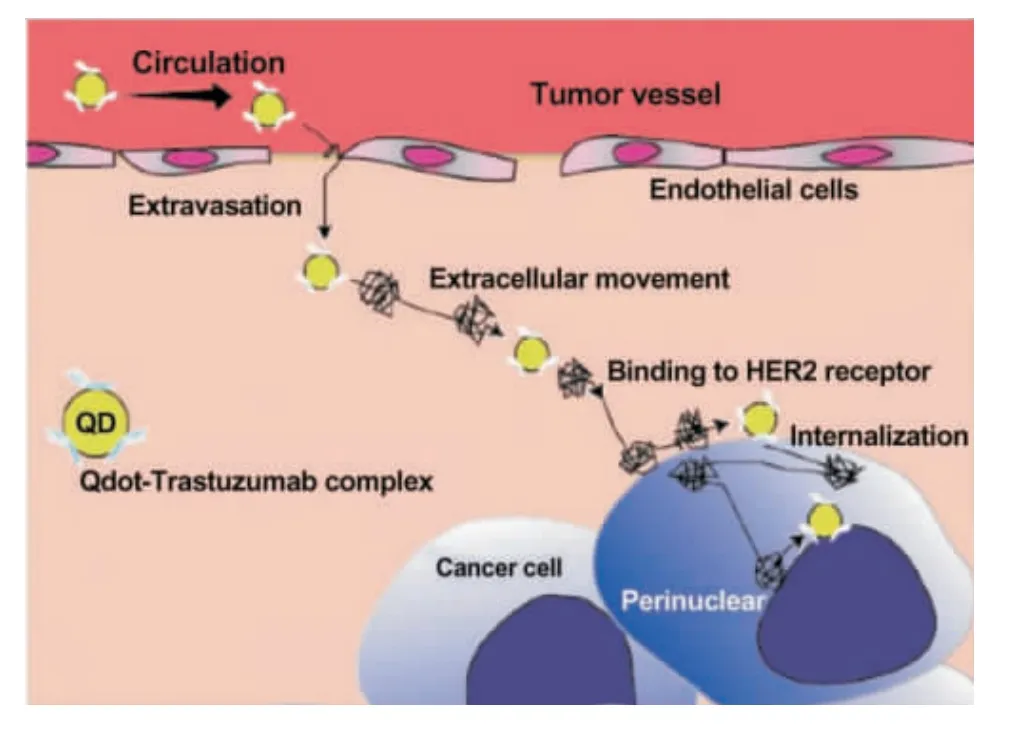
Fig.7 Schematic illustration of targeted quantum dots transpoting in the tumor tissue[46]图7 靶向量子点在肿瘤部位转运情况示意图[46]
展 望
背脊皮翼视窗相对其他活体成像系统,具有微创、实时和原位观察等优点,借助辅助配件,可与目前使用的大多数光学成像系统很好耦合,获得更清晰细致的肿瘤局部动态信息,方便将大部分停留在细胞层面的实验转接到活体研究水平. 背脊皮翼视窗还在生物相容性材料、感染、干细胞、血液动力学、神经系统科学、药物治疗、炎症及免疫研究领域具有巨大应用前景,尤其是在临床药物研发方面将起到极大促进作用.
随着新材料和新方法的出现,与背脊皮翼视窗相关的其他活体透明视窗结构,如小鼠乳头脂肪垫视窗模型、肠系膜视窗模型及头盖骨视窗模型等,也在不断发展完善,相信这种光学活体成像辅助手段必将在肿瘤研究和新药开发中发挥更大作用.
/ References:
[1]Judah F. Tumor angiogenesis:therapeutic implications[J]. New England Journal of Medicine,1971,285(21):1182-1186.
[2]Branemark P L,Aspegren K,Breine U. Microcirculatory studies in man by high resolution vital microscopy [J].Angiology,1964,15(8):329-332.
[3]Beverly A T. Tumor Models in Cancer Research [M].2nd ed. New York:Humana Press,2011:641-679.
[4]Gudrun E K,Andreas G,Edward K G. Intravital microscopy of tumor angiogenesis and regression in the dorsal skin fold chamber:mechanistic insights and preclinical testing of therapeutic strategies [J]. Clinical & Experimental Metastasis,2009,26(4):329-344.
[5]Arfors K E,Jonsson J A,McKenzie F N. A titanium rabbit ear chamber:assembly,insertion and results [J].Microvascular Research,1970,2(4):516-518.
[6]Eddy H A,Casarett G W. Development of the vascular system in the hamster malignant neurilemmoma [J]. Microvascular Research,1973,6(1):63-82.
[7]Yuan F,Salehi H A,Boucher Y,et al. Vascular permeability and microcirculation of gliomas and mammary carcinomas transplanted in rat and mouse cranial windows[J]. Cancer Research,1994,54(17):4564-4568.
[8]Tam J,Duda D G,Perentes J Y,et al. Blockade of VEGFR2 and not VEGFR1 can limit diet-induced fat tissue expansion:role of local vers us bone marrow-derived endothelial cells [J]. PLoS One,4(3):e4974-1-e4974-6.
[9]Milan M. Intravital imaging and cell invasion [J].Methods in Enzymology,2007,426:375-401.
[10]Gregory M P,Andrew N F,Shan S Q,et al. In vivo optical molecular imaging and analysis in mice using dorsal window chamber models applied to hypoxia,vasculature and fluorescent reporters [J]. Nature Protocols,2011,6(9):1355-1366.
[11]Takashi C,Yohei M,Li L N,et al. Use of histoculture and green fluorescent protein to visualize tumor cell host interaction [J]. In Vitro Cellular & Developmental Biology-Animal,1997,10(33):745-747.
[12]Masaaki K,Hideo H,Motohiro T,et al. Dynamics of different-sized solid-state nanocrystals as tracers for a drugdelivery system in the interstitium of a human tumor xenograft [J]. Breast Cancer Research,2009,11(4):R43-1-R43-9.
[13]Li C Y,Shan S Q,Cao Y T,et al. Role of incipient angiogenesis in cancer metastasis [J]. Cancer and Metastasis Reviews,2000,19(1/2):7-11.
[14]Rakesh K J,Lance L M,Dai F. Dissecting tumor pathophysiology using intravital microscopy [J]. Nature Review Cancer,2002,2(4):266-276.
[15]Matthew R D,Liu W G,Charles R M,et al. Tumor vascular permeability,accumulation,and penetration of macromolecular drug carriers [J]. Journal of the National Cancer Institute,2006,98(5):335-344.
[16]Makale M T,Chen P C,David A G. Variants of the tissue-sensor array window chamber [J]. American Journal of Physiology Heart and Circulatory Physiology,2005,289(1):57-65.
[17]Matthew R D,Liu W G,Charles R M,et al. Tumor vascular permeability,accumulation,and penetration of macromolecular drug carriers [J]. Journal of the National Cancer Institute,2006,98(5):335-344.
[18]Mamta W,Casey D,Dietmar W S,et al. In vivo functional differences in microvascular response of 4T1 and Caki-1 tumors after treatment with OXi4503 [J]. Oncology Reports,2010,23(3):685-692.
[19]Hsiang K Y,Christopher G K,Christy M W,et al. In vivo particle tracking and photothermal ablation using plasmon-resonant gold nanostars [J]. Nanomedicine:Nanotechnology,Biology,and Medicine,2012,8(8):1355-1363.
[20]Gu Xiang,Liu Xiaoxia,Sun Jianqi. Synchrotron radiation imaging technology in tumor new blood vessels experimental research [J]. Nuclear Technology,2009,32(7):487-492.(in Chinese)顾 翔,刘晓霞,孙建奇. 同步辐射成像技术应用于肿瘤新生血管的实验初探[J]. 核技术,2009,32(7):487-492.
[21]Liu Ping,Xu Xuemin,Zhang Aili,et al. Applied research of thermal physics in tumor therapy and nano particles for targeted drug delivery [J]. Chinese Journal of Biomedical Engineering,2005,24(2):212-216. (in Chinese)刘 苹,徐学敏,张爱丽,等. 热物理在肿瘤治疗及纳米药物靶向输送方面的应用研究[J]. 中国生物医学工程学报,2005,24(2):212-216.
[22]Zhang G Q,Gregory M P,Mark W D,et al. A dual-emissive-materials design concept enables tumor hypoxia imaging [J]. Nature Materials,2009(8):747-751.
[23]Zhong G G,Tian L,Hu J. Prevention of metastasis in a 4T1 murine breast cancer model by doxorubicin carried by folate conjugated pH sensitive polymeric micelles [J].Journal of Controlled Release,2011,152(1):84-89.
[24]Bernard C,Nicole M K,Nelson J S. Laser speckle imaging for monitoring blood flow dynamics in the in vivo rodent dorsal skin fold model [J]. Microvascular Research,2004,68(2):143-146.
[25]Tozer G M,Ameer-Beg S M,Baker J,et al. Intravital imaging of tumor vascular networks using multi-photon fluorescencemicroscopy [J]. Advanced Drug Delivery Reviews,2005,57(1):135-152.
[26]Wofgang D,James G F. Optical Coherence Tomography:Technology and Applications [M]. New York:Springer Press,2008:209-287.
[27]Benjamin J V,Ryan M L,James A T,et al. Three-dimensional microscopy of the tumor microenvironment in vivo using optical frequency domain imaging [J]. Nature Medicine,2009,15(10):1219-1223.
[28]Ding Zhihua,Chen Minghui,Wang Kai,et al. Quick sweep frequency light source and its in optical frequency domain the applications imaging [J]. Chinese Journal of Lasers,2009,36(10):2469-2476.(in Chinese).丁志华,陈明惠,王 凯,等. 快速扫频光源及其在光学频域成像中的应用[J]. 中国激光,2009,36(10):2469-2476.
[29]Tsuzuki Y,Fukumura D,Oosthuyse B,et al. Vascular endothelial growth factor (VEGF)modulation by targeting hypoxia inducible factor-1α →hypoxia response element→VEGF cascade differentially regulates vascular response and growthrate in tumors [J]. Cancer Research,2000,60:6248-6252.
[30]Debergh,Van D N,Pattyn P,et al. The low-molecularweight heparin,nadroparin,inhibits tumor angiogenesis in a rodent dorsal skin fold chamber model [J]. British Journal of Cancer,2010,102:837-843.
[31]Melissa C S,Andrew F,Lan L,et al. Longitudinal optical imaging of tumor metabolism and hemodynamics [J].Journal of Biomedical Optics,2010,15(1):011112.
[32]Heddlestonl J M,Li Z,Lathia J D,et al. Hypoxia inducible factors in cancer stem cells [J]. British Journal of Cancer,2010,102:789 -795.
[33]Kashiwagi S,Izumi Y,Gohongi T,et al. NO mediates mural cell recruitment and vessel morphogenesis in murine melanomas and tissue-engineered blood vessels [J]. Journal of Clinical Investigation,2005,115(7):1816-1827.
[34]Kashiwagi S,Tsukada K,Xu L,et al. Perivascular nitric oxide gradients normalize tumor vasculature [J]. Nature Medicine,2008,14(3):255-257.
[35]Hansen-Algenstaedt N,Stoll B R,Padera T P,et al.Tumor oxygenation during VEGF-R2 blockage,hormone ablation,and chemotherapy [J]. Cancer Research,2000,60(16):4556-4560.
[36]Martin N A,Gaffney E A,Gatenby R A,et al. Leaky vessels as a potential source of stromal acidification in tumours [J]. Journal of Theoretical Biology,2010,267(3):454-460.
[37]Ondeelis J,Singer Rt H,Segall J E. The great escape:when cancer cells hijack the genes for chemotaxis and motility [J]. Annual Review of Cell and Developmental Biology,2005,21:695-718.
[38]Dewhirst M W,Shan S,Cao Y T,et al. Intravital fluorescence facilitates measurement of multiple physiologic functions and gene expression in tumors of live animals [J].Disease Markers,2002,18(5/6):293-311.
[39]Mark W Dt,Yiting C,Li C Y,et al. Exploring the role of HIF-1 in early angiogenesis and response to radiotherapy[J]. Radiotherapy and Oncology,2007,83(3):249-255.
[40]Gregory M P,Andrew N F,Zhang G Q,et al. Optical imaging of tumor hypoxia dynamics [J]. Journal of Biomedical Optics,2010,15(6):066021-1-066021-7.
[41]Wen Chongwei,Ning Degang,Liu Ruijiang,et al. A novel target for starving tumor therapy:endocrine-gland-derived vascular endothelial growth factor [J]. Progress in Biochemistry and Biophysics,2011,38(1):5-10. (in Chinese)闻崇炜,宁德刚,刘瑞江,等. 肿瘤饥饿疗法的新靶标:内分泌腺衍生血管内皮生长因子[J]. 生物化学与生物物理学进展,2011,38(1):5-10.
[42]Nie S M,Xing Y,Gloria J K,et al. Nanotechnology applications in cancer [J]. Annual Review of Biomedical Engineering,2007,9:257-288.
[43]Resch-Genger U,Grabolle M,Cavaliere-Jaricot M,et al.Quantum dots versus organic dyes as fluorescent labels[J]. Nature Methods,2008,5(9):763-775.
[44]Chan W C W,Nie S M. Quantum dot bioconjugates for ultrasensitive nonisotopic detection [J]. Science,1998,281(5385):2016-2018.
[45]Michale X,Pinaud F F,Bentolila L A,et al. Quantum dots for live cells,in vivo imaging,and diagnostics [J].Science,2005,307(5709):538-544.
[46]Smith A M,Nie S M. Next-generation quantum dots [J].Nature Biotechnology,2009,27(8):732-733.
[47]So M K,Xu C J,Loening A M,et al. Self-illuminating quantum dot conjugates for in vivo imaging [J]. Nature Biotechnology,2006,24(3):339-343.
[48]Tada H,Higuchi H,Wanatabe T M,et al. In vivo realtime tracking of single quantum dots conjugated with monoclonal anti-HER2 antibody in tumors of mice [J]. Cancer Research,2007,67(3):1138-1144.
[49]Stroh M,Zimmer J P,Duda D G,et al. Quantum dots spectrally distinguish multiple species within the tumor milieu in vivo [J]. Nature Medicine,2005,11(6):678-682.
[50]Voura E B,Jaiswal J K,Mattoussi H,et al. Tracking metastatic tumor cell extravasation with quantum dot nanocrystals and fluorescence emission-scanning microscopy[J]. Nature Medicine,2004,10(9):993-998.

