紫杉醇联合顺铂化疗对人卵巢浆液性囊腺癌组织occludin 和ZO-1 表达以及线粒体超微结构的影响*
谭树芬, 杨宏英, 李 凡, 魏向群, 李树清△
(昆明医科大学1第三附属医院妇瘤科,2病理生理教研室,云南 昆明650118)
卵巢浆液性囊腺癌(serous cystadenocarcinoma,SC)是最常见的卵巢上皮恶性肿瘤,约占全部卵巢肿瘤的40%,占卵巢上皮性癌的50% ~60%。当前,铂类药物对卵巢癌仍然是最重要的化疗药物[1-2]。新近研究发现,紧密连接(tight junction,TJ)膜蛋白结构的缺失可能是导致细胞黏附能力丟失和肿瘤转移的关键步骤[3-4],其在卵巢恶性肿瘤表达的差异可能成为卵巢癌诊治的标志物[1]。TJ 的occludin 和zonula occludens-1 (ZO-1)蛋白是控制内皮或上皮细胞之间连接的关键物质,具有维持细胞极性、黏附性、运动性、调节细胞增殖及分化的功能[5],尽管紫杉醇联合铂类是迄今认为最有效的化疗方案,但其对SC 细胞occludin 和ZO-1 表达的作用尚不清楚。本文旨在观察紫杉醇联合顺铂化疗对SC 细胞occludin 及ZO-1 表达的影响。
材 料 和 方 法
1 对象
20 例卵巢癌组织石蜡标本,取自昆明医科大学第三附属医院妇瘤科2009 年~2012 年间行卵巢癌切除术的患者,年龄30 ~70 岁。分组原则:对于手术治疗无困难的卵巢肿瘤患者,住院后直接实施手术治疗。若手术治疗困难的患者,先行B 超引导穿刺活检,当确诊为卵巢癌后进行化疗,待肿瘤体积缩小后再行手术切除。石蜡标本均制成厚约4 μm 的连续组织切片2 份,其中一份进行HE 染色和病理组织学检查,另一份标本进行免疫组化染色。以3 例知情同意后的子宫肌瘤患者的卵巢组织作为正常对照组。化疗方案:紫杉醇加铂类化疗,具体为紫杉醇按175 mg/m2,铂类选择顺铂,按70 mg/m2静滴。
2 方法
2.1 电子显微镜观察 将患者术中切除的卵巢及时取组织块,置于3.5%戊二醛内保存,磷酸盐缓冲液冲洗后,丙酮酸逐级脱水,1%四氧锇酸固定24 h,超薄切片机半薄切片定位,再作柠檬酸铅醋酸铀双染色,在JEM-1011 型电子显微镜下进行常规形态学观察。
2.2 紧密连接蛋白的免疫组化检测 采用免疫组化MaxVision 快捷法进行occludin 及ZO-1 检测。操作步骤:常规固定包埋卵巢癌样本,石蜡切片脱蜡、梯度乙醇脱水后,浸泡于蒸馏水中待用。组织高压抗原修复:将水洗后的切片浸泡于0.01 mol/L 柠檬酸盐缓冲液(pH 6.0)中,在压力锅内加热至沸腾(10 min);将脱蜡水化后的组织切片置于耐高温染色架上,放入已沸腾的缓冲液内继续加热至工作温度和工作压力(喷汽)2 min 后,压力锅离开热源。数分钟后,冲淋冷却蒸馏水冲洗2 次。3% H2O2阻断内源性过氧化物酶,PBS 冲洗3 min ×3 次,非免疫小牛血清封闭抗原(10 min),甩去血清,勿冲洗;用PBS(pH 7.4)冲洗3 min ×3 次,除去PBS 液,每张切片加50 μL 的第Ⅰ抗体(1∶100 稀释),4 ℃冰箱下孵育过夜。PBS 冲洗5 min ×3 次。除去PBS 液,每张切片加50 μL 酶标抗鼠/兔聚合物(Ⅱ抗),室温下孵育15 min。PBS 冲洗3 min ×3 次。除去PBS 液,每张切片加50 μL 新鲜配制的DAB 溶液,显微镜下观察5 min。自来水冲洗,苏木素复染,用0.1% HCl 分化,自来水冲洗返蓝。切片经梯度酒精脱水干燥,二甲苯透明,中性树胶封固。采用正常卵巢组织(取自子宫肌瘤患者切除的卵巢组织)标本作为正常对照,以PBS 代替Ⅰ抗作为阴性对照。
2.3 免疫组化结果判定标准 所有石蜡切片由病理科医师独立评判后综合评定。Occludin 和ZO-1 阳性物在细胞浆呈细颗粒状棕黄色反应。在相同电压及相同光亮度条件下,用20 倍物镜摄取以上各区域的图像传送至计算机显示屏,用Nikon-MiVnt 显微图像分析系统进行免疫组化图像定量分析,所测得阳性细胞平均灰度值表示occludin 和ZO-1 阳性表达信号的相对强弱。
3 统计学处理
数据以均数±标准差(mean±SD)表示,用SPSS 11.5 统计软件包,行单因素方差分析,方差齐性检验,以P <0.05 为差异有统计学意义。
结 果
1 化疗对人卵巢SC 细胞线粒体超微结构的影响
电镜观察显示,正常卵巢上皮细胞超微结构正常,形状排列规则,线粒体未见异常。SC 细胞顶端可见小而粗短的微绒毛,以不规则的方式突向腔面,基底部细胞膜则多呈平滑状,核位于基底部;线粒体明显肿胀,位于细胞体部,呈现巨线粒体,且嵴断裂十分显著。化疗后SC 细胞排列较规则,线粒体肿胀消失、线粒体体积明显减小,形态接近正常,见图1。
2 化疗对人卵巢SC 组织紧密连接蛋白(occludin和ZO-1)表达的影响
免疫组化结果显示,对照组卵巢上皮细胞occludin 和ZO-1 蛋白强表达,胞浆内有较多棕黄色阳性物,定位准确,表达清楚,背景清晰,胞核经苏木素复染,呈蓝黑色;SC 细胞occludin 和ZO-1 蛋白弱表达,胞浆内仅见少量棕黄色阳性物,蓝黑色的胞核更加明显,与对照组相比灰度值明显升高(P <0.05 或P <0.01);化疗组SC 细胞occludin 和ZO-1 表达增强,胞浆内有较多棕黄色阳性物,定位准确,表达清楚,背景清晰,胞核亦呈蓝黑色,与SC 组相比灰度值明显降低(P <0.05 或P <0.01),见图2。
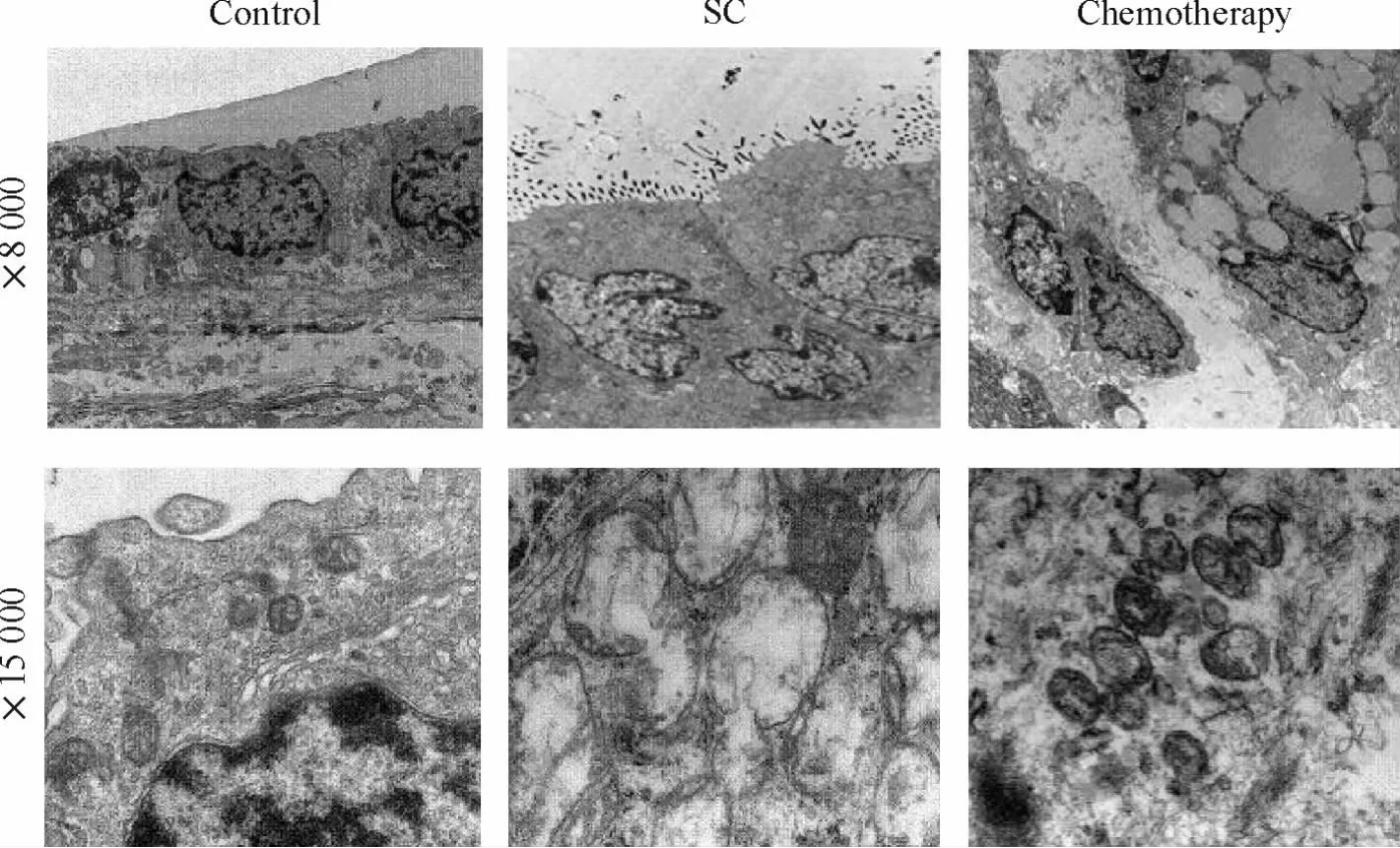
Figure 1. Effects of paclitaxel-cisplatin combination chemotherapy on ultrastructural changes of human ovarian serous cystadenocarcinoma (SC)cells.图1 化疗对人卵巢SC 细胞超微结构的影响
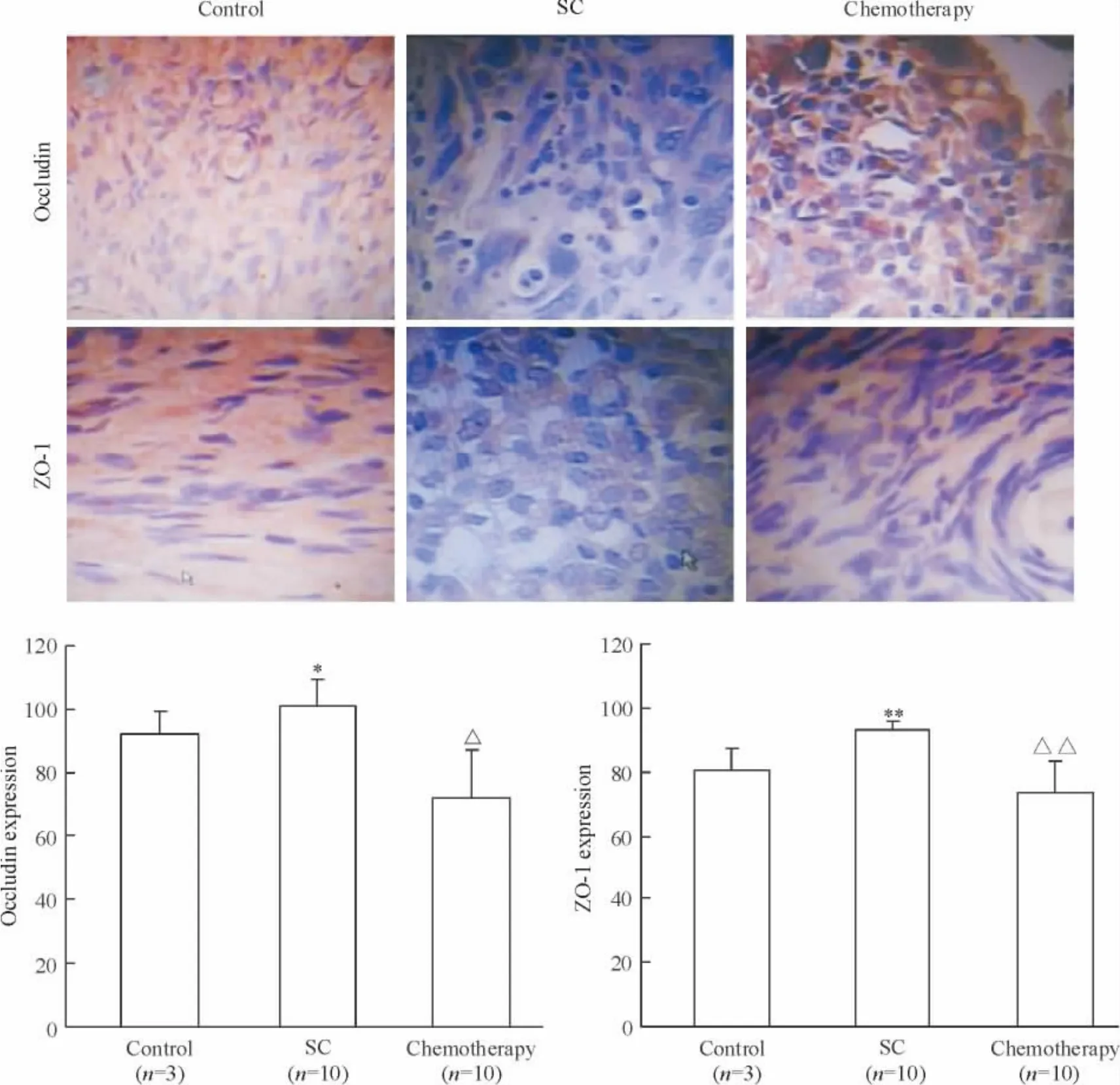
Figure 2. Effects of paclitaxel-cisplatin combination chemotherapy on the expression of occludin and ZO-1 in human ovarian serous cystadenocarcinoma (SC)tissues (×200).Mean±SD. * P <0.05,**P <0.01 vs control;△P <0.05,△△P <0.01 vs SC.图2 化疗对人卵巢SC 组织紧密连接蛋白表达的影响
讨 论
卵巢癌是严重威胁妇女健康的常见疾病,由于其死亡率一直居高不下而成为当前国际肿瘤研究的重要领域。近年来,虽然化疗方案的不断完善与应用,但卵巢恶性上皮性肿瘤的疗效却未见明显改善。卵巢癌的5 年生存率之所以总是徘徊于30% ~40%之间,其最重要的原因就是癌转移之前的早期诊断十分困难。因此,开展卵巢癌发病规律、病理特点以及分子生物学的研究与探索具有极其重要的实践意义,也是当前卵巢癌防治研究的重要领域。TJ 主要由跨膜蛋白和胞质附着蛋白组成。跨膜蛋白occludin 是第1 个被发现的TJ 蛋白[3],其N 端对TJ 的装配和屏障功能的保持起重要作用,C 端与ZO-1 直接相连,与ZO-1 共同调节紧密连接的结构变化,此特点对occludin 在TJ 间的定位及细胞间的通透性调节极其重要。ZO-1 是第1 个被证实的TJ 附着蛋白,它与occludin 位于胞质内的C 端直接相连[4,6]。TJ 中的occludin 和ZO-1 是控制物质穿过内皮和上皮细胞间连接的关键结构,具有维持细胞极性、黏附性、运动性、调节细胞增殖及分化的功能[3]。当组织恶变时,TJ 的功能异常可导致细胞极性破坏,表明TJ 蛋白可能是药物靶向一种特殊分子。免疫组化研究显示,SC 组织occludin 和ZO-1 表达明显减弱,而化疗组卵巢上皮细胞occludin 和ZO-1 表达明显增强,可能是缓解细胞水肿及线粒体肿胀的关键所在。
国外学者认为,线粒体在顺铂抗肿瘤作用中具有的重要价值,因此将探索的注意力在集中到顺铂与线粒体的相互作用方面[1]。我们对SC 的超微结构观察显示,SC 线粒体肿胀和嵴断裂的改变明显。已证明,嵴型肿胀一般为可逆性,倘若膜损伤明显加重时,可经过混合型肿胀而过渡为基质型肿胀。SC细胞的巨型线粒体可能是此型肿瘤恶性度较高的原因之一。化疗组卵巢线粒体肿胀明显减轻与occludin 和ZO-1 表达增强相平行,提示二者在保持卵巢的结构与功能中可能具有重要作用。TJ 在卵巢恶性肿瘤转化中表达的不同特点有望成为卵巢癌诊治的重要标志物[3]。已证明,肿瘤细胞暴露于顺铂最终导致细胞凋亡,仅1%的细胞内铂可绑定到核DNA,而绝大多数细胞内的药物可与其它分子相互作用,包括线粒体DNA[7-8]。Lee 等[9]的研究证实,卡铂可使Bax 水平升高,而Akt 抑制剂则使Bax 水平下调,表明Akt 抑制剂可通过增加caspase-8 以及线粒体细胞色素C 的释放而加强卡铂对卵巢癌细胞的攻击效应。鉴于大部分化疗药物作用于肿瘤细胞时都会产生活性氧而引起氧化应激[10],其与TJ 蛋白表达以及线粒体信号转导间的分子机制有待进一步研究。
(致 谢:本文统计学处理承蒙昆明医科大学沈凌、陈静老师大力协助,谨此致谢!)
[1] Saitou M,Isonishi S,Hamada T,et al.Mitochondrial ultrastructure-associated chemotherapy response in ovarian cancer[J]. Oncol Rep,2009,21(1):199-204.
[2] 邓晓慧,宋海岩,孙春莉. 槲皮素对人卵巢癌SKOV-3细胞增殖的影响[J].中国病理生理杂志,2013,29(1):99-102.
[3] Li D,Mrsny RJ. Oncogenic Raf-1 disrupts epithelial tight junctions via downregulation of occluding[J]. J Cell Biol,2000,148(4):791-800.
[4] 尹 芳,乔泰东,时永全,等. 紧密连接分子Occludin mRNA 在胃癌中的表达和分布[J]. 中华肿瘤杂志,2002,24(6):557-560.
[5] Zhu Y,Brännström M,Janson PO,et al. Differences in expression patterns of tight junction proteins,clandin-1,3,4,and 5,in human ovarian surface epithelium as compared to epithelia in inclusion cysts and epithelial ovarian tumours[J]. Int J Cancer,2006,118(8):1884-1891.
[6] Müller SL,Portwich M,Schmidt A,et al. The tight junction protein occludin and the adherens junction protein αcatenin share a common interaction mechanism with ZO-1[J]. J Biol Chem,2005,280(5):3747-3756.
[7] Hirama M,Isonishi S,Yasuda M,et al. Characterization of mitochondria in cisplatin-resistant human ovarian carcinoma cells[J]. Oncol Rep,2006,16(5):997-1002.
[8] 汪 辉,黄亚非,李 天,等.卵巢癌细胞对CD8+T 细胞ζ 链表达及分泌Tc1/Tc2 型细胞因子的影响[J].中国病理生理杂志,2008,24(1):97-100.
[9] Lee CS,Kim YJ,Jang ER,et al.Akt inhibitor enhances apoptotic effect of carboplatin on human epithelial ovarian carcinoma cell lines[J]. Eur J Pharmacol,2010,632(1-3):7-13.
[10]蔡鹏程,张德太,杨菊红,等. 顺铂对HeLa 细胞6-磷酸葡萄糖脱氢酶表达和活性的影响[J].中国病理生理杂志,2008,24(7):1323-1326.

