聚乳酸/茶多酚复合纳米纤维膜的抗菌机制及性能
费燕娜,高卫东,王鸿博,王银利
(1.生态纺织教育部重点实验室(江南大学),江苏无锡 214122;2.浙江朝晖过滤技术股份有限公司,浙江桐乡 314500)
纳米抗菌材料是在纳米技术出现后,将抗菌剂通过一定的方法和技术制成纳米级抗菌剂,再与抗菌载体通过一定的方法和技术制备而成的具有抗菌功能的材料。目前纳米材料中,抗菌产品[1-3]及概念已成为其中最引人注目的应用领域之一[4-6]。纳米抗菌纤维作为纳米材料中一个重要的方面,也受到越来越多研究人员的关注。目前制备纳米级抗菌纤维最常见的方法是将诸如银、氧化锌、甲壳素、二氧化钛等无机天然光催化型抗菌剂与高聚物共混,通过静电纺丝法制备出具有抗菌功能的纳米纤维,并对其抗菌性能以及抗菌机制进行研究和探讨[7-8]。王曦等[9]制备了含银 PA6 纳米纤维,分析了银含量对抗菌效果的影响。XU等[10]制备了壳聚糖/聚乳酸复合纳米纤维,研究了壳聚糖含量与抗菌效果之间的关系。茶多酚(TP)作为一种安全无毒副作用的绿色化合物,近年来已受到研究人员越来越多的关注[11-13]。本文将 TP作为抗菌剂,聚乳酸(PLA)作为载体,采用静电纺丝法,制备PLA/TP复合纳米纤维薄膜,分别采用抑菌圈法和振荡烧瓶法对其进行定性和定量的抗菌性能检测,并对其抗菌机理进行初步探讨。
1 实验部分
1.1 材料与设备
1.1.1 材料及试剂
茶多酚(TP),纯度98%,黄褐色粉末(江南大学食品学院);二氯甲烷(DCM)、N,N-二甲基甲酰胺(DMF),分析纯(国药集团化学试剂有限公司);聚乳酸(PLA)切片,片材级,相对分子质量为10万(深圳光华实业伟业有限公司)。
抗菌主要化学试剂:牛肉浸膏、生化试剂BR、氯化钠,氢氧化钠、磷酸二氢钠、磷酸氢二钠 (中国医药集团上海化学试剂公司);蛋白胨、琼脂粉(国药集团化学试剂有限公司)。
1.1.2 静电纺丝设备
WZ-50 C6型微量注射泵(浙江史密斯医学仪器有限公司),DW-P303-1ACD8 型高压直流电源(天津东文高压电源厂),平板接收装置(实验室自制)。
1.2 实验方法
1.2.1 纺丝液的制备
用电子天平称取适量 PLA和 TP,溶于DCM、DMF的混合纺丝溶剂中。确定溶液中DCM和DMF的体积比为7∶3。本文实验设定PLA与TP的质量比 分 别 为:100/0、90/10、80/20、70/30、60/40、50/50(W/W)。在室温下磁力搅拌12 h,静置备用。
1.2.2 静电纺丝
将上述纺丝液倒入20 mL注射器中,采用内径0.7 mm削平的注射针头作为毛细管,调整注射器高度,使针头高度与铝箔接收板的中心位置在同一水平线上,二者之间的接收距离(C-SD)按需调节。注射泵连接高压直流电源的正极,铝箔接收板连接负极,溶液挤出量(纺丝速度)由注射泵控制可调,打开电源,按需要设定纺丝电压。本文实验中,纺丝工艺参数设定为:纺丝电压18kV、纺丝速度0.6 mL/h、接收距离17 cm。
1.2.3 抗菌试样制备
把待测试样剪成直径为25 mm的圆试样(用于抑菌圈测试)及5 mm×5 mm小碎片(用于振荡烧瓶法测试)若干,分别装于三角锥形瓶内封口,由于被测试样不适宜高温灭菌,因此本实验采用紫外灯光照30 min灭菌备用。
1.3 红外光谱(FT-IR)观察
用衰减全反射(ATR-Ge)制样法,将聚乳酸纳米纤维膜和不同质量混比的聚乳酸/茶多酚复合纳米纤维膜分别制样后进行红外光谱扫描,进行比较分析。
1.4 抗菌性能测试
关于静电纺纳米薄膜的抗菌性能检测,目前国内尚无统一的评价标准。由于聚乳酸/茶多酚复合纳米纤维膜为一次性纺织纤维用品,因此本文实验参照纺织品抗菌性能的评价方法,分别采用抑菌圈法和改良的振荡烧瓶法对PLA/TP复合纳米纤维膜的抗菌性能进行定性及定量的检测。参照标准为GB/T 20944.1—2007《琼脂平皿扩散法》、GB/T 20944.3—2008《振荡法》以及 GB 15979—2002《一次性使用卫生用品卫生标准》。实验中所使用的2种菌种分别为:大肠杆菌(格兰氏阴性菌代表,ATCC25922,E.coli);金黄色葡萄球菌(格兰氏阳性菌代表,ATCC6538,S.aureus)。
1.4.1 抑菌圈法
在无菌培养皿中分别加入E.coli和S.aureus菌悬液,然后倒入冷却至46℃的营养琼脂培养基,立即旋转使其充分均匀分散,放置5 min待培养基凝结后,将直径25 mm的试样均匀的按压在培养基中央,确保试样和培养基充分接触,放入37℃恒温培养箱中培养18~24 h,观察试样周围的细菌生长情况,测量抑菌圈尺寸。
抑菌圈评价:根据抑菌圈宽度以及试样下方细菌的繁殖情况来判定抑菌效果的好坏。每个试样至少测量3处,取平均值。抑菌圈大小可按式(1)计算:

式中:H为抑菌圈宽度,D为抑菌圈外径的平均值,d为试样直径,单位均为cm。
1.4.2 振荡烧瓶法
将试样放入加有菌液的磷酸盐缓冲液(PBS)中,进行“0”接触时刻取样,按10倍稀释法制作平皿,待琼脂冷却后放入37℃培养箱中,然后将装有试样和菌液的烧瓶放入摇瓶柜中,温度设定为37℃,转速为120 r/min,到规定时间后,取出烧瓶,按“0”接触时刻平皿的制作方法制作平皿,冷却后放入相同培养箱培养24 h。
抗菌效果评价:样品的抗菌性能通过抑菌率进行判定,可按式(2)计算:
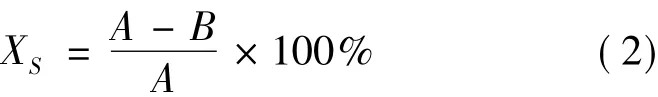
式中:XS为抑菌率;A为“0”接触时刻平均菌落数;B为样品振荡后平均菌落数。
1.5 抗菌机理
为探讨TP的抗菌机制,采用H-7000型透射电镜(日本HITACHI公司)分析经过PLA/TP复合纳米纤维膜处理后的菌体,观察TP加入对细胞超微结构的影响。
2 结果与分析
2.1 FT-IR分析
图1示出不同混比条件下PLA/TP复合纳米纤维膜的红外光谱图。
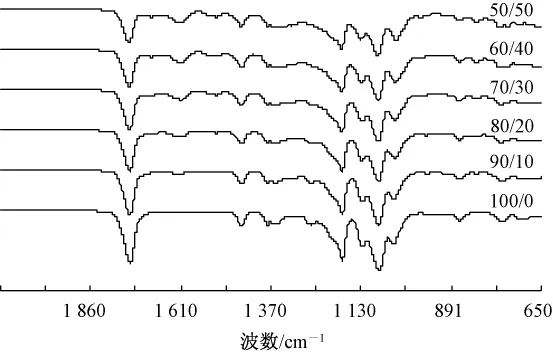
图1 PLA/TP复合纳米纤维膜FT-IR图Fig.1 IR spectra of PLA/TP composed nanofibermembranes
通过分析图1可得出以下2点结论:1)当PLA与TP混比为100/0时,红外谱图中在1 381 cm-1处出现甲基的变形振动吸收峰,但随着TP含量的增加,当混比为 80/20时,这个吸收峰已右移至1 359 cm-1处,当TP含量继续增加至二者比例为50/50时,已右移至1 339 cm-1处,这是由于PLA中的甲基结合TP中的苯环形成π-π共轭体系,由于共轭效应,使其电子云密度平均化,因此使吸收峰向低波数方向移动,同时由于受到氢键的影响,峰形有变宽的趋势;2)随着PLA/TP中TP含量的增加,PLA中出现苯环取代现象,当二者混比达到70/30时,从红外谱图可以很明显地看出在1 613 cm-1处出现苯环吸收峰,当TP含量继续增加,吸收峰也随之增强,可以看到在60/40、50/50的红外谱图中分别在1 611 cm-1和1 558 cm-1处出现苯环吸收峰,同时在821 cm-1处出现了取代苯的特征吸收峰。综上可知:以PLA为载体,TP为抗菌剂共混纺制的PLA/TP复合纳米纤维薄膜中二者通过价键的结合很好地复合在一起。
2.2 复合膜的抑菌性
图2(a)、(b)、(c)分别示出不同质量比条件下PLA/TP复合纳米纤维膜对E.coli的抑菌效果。图2(d)、(e)、(f)分别示出各试样对S.aureus的抑菌效果图。从图2(a)、(d)中可以明显看到没有添加TP的纯PLA纳米纤维膜没有抑菌圈,且试样下方细菌的繁殖情况仅是轻微减少,因此可以判定纯PLA纳米纤维膜对E.coli和S.aureus没有抗菌效果。当二者质量比为90/10时(见图2(b)、(e)),可以看出试样周围仍然没有抑菌圈,但试样下方细菌繁殖情况明显被抑制,仅有少量菌落,因此可以认为该试样对2种菌的抗菌效果较好。当二者质量比为80/20时,从图2(c)、(f)中可以看出试样周围开始出现抑菌圈,且试样下方没有细菌繁殖,对2种菌的抗菌效果好。继续增加TP含量,发现除抑菌圈宽度稍有增加外,其余效果与图2(c)、(f)相似。
表1示出不同质量比PLA/TP复合纳米纤维膜抑菌宽度,从表可以看出,随着复合薄膜中TP含量的增加,抑菌圈宽度也逐渐增加,抗菌效果增强。当PLA与 TP的质量比为 50/50时,对E.coli和S.aureus的抑菌圈宽度分别达到5.17 cm和5.67 cm。并且对S.aureus的抑菌圈宽度要稍大于大肠杆菌的抑菌圈宽度,说明复合薄膜对S.aureus的抗菌效果强于E.coli。
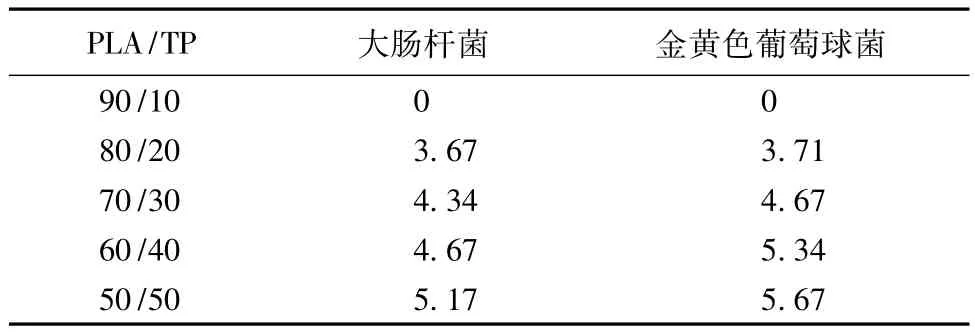
表1 不同质量比PLA/TP复合纳米纤维膜抑菌宽度Tab.1 W idths of inhibition zones of PLA/TP com posed membranesw ith differentmass ratios cm
2.3 振荡烧瓶法分析
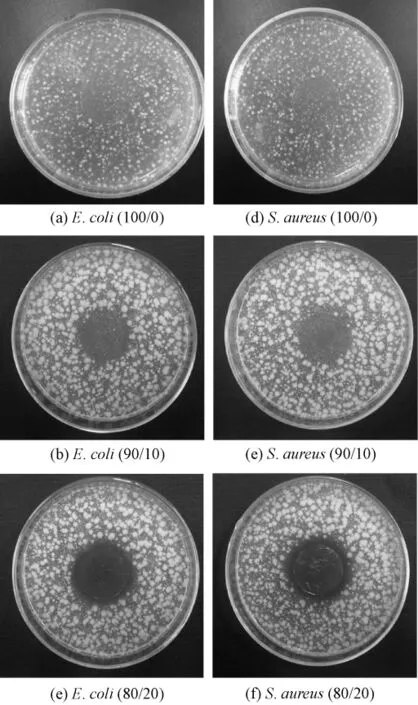
图2 不同质量比PLA/TP复合纳米纤维膜抑菌圈实验效果Fig.2 Results of inhibition zone tests of PLA/TP composed membranes with differentmass ratios
表2示出不同质量HPLA/TP复合纳米纤维膜抑菌率。从表可看出,随着PLA与TP质量比从100/0减小到90/10时,抑菌率明显提高。对E.coli和S.aureus的抑菌率分别从20.6%和21.3%迅速上升到92.9%和85.7%,当PLA与TP质量比继续减小到50/50时,复合纳米纤维膜的抑菌率上升趋势逐渐变缓,对E.coli和S.aureus的抑菌率分别达到96.9%和97.6%。说明不加TP的PLA纳米纤维膜的抗菌效果不明显。当PLA与TP质量比为90/10时,复合纳米纤维膜的抗菌性能已得到显著提高,若再增加TP含量,对抗菌性能的改善已不太明显。各试样对S.aureus的抑菌率要稍大于E.coli的抑菌率,与抑菌圈实验结果一致。
图3示出不同质量HPLA/TP复合纳米纤维抗菌效果。从图可看出,加了PLA/TP复合纳米纤维膜后,平皿中的菌落数较之不加试样的有明显减少,随着TP含量的增加,菌落数迅速减少,当PLA与TP质量比从70/30减小到50/50时,从拍摄的图片中凭肉眼均已很难观察到菌落。
2.4 复合膜的形貌分析

图3 不同质量比PLA/TP复合纳米纤维膜抗菌效果Fig.3 Antibacterial results of PLA/TP composed membranes with differentmass ratios
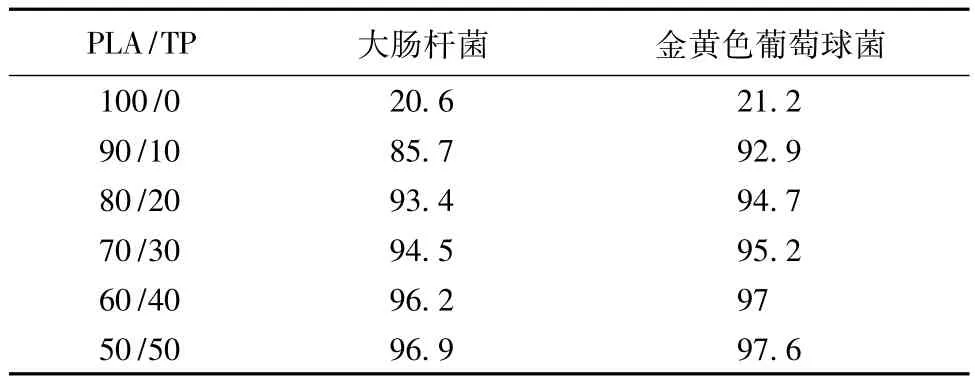
表2 不同质量比PLA/TP复合纳米纤维膜抑菌率Tab.2 Antibacterial rate of PLA/TP com posed film s w ith differentmass ratios %
为了进一步探讨PLA/TP复合纳米纤维膜的抑菌机理,采用透射电镜分析处理前后S.aureus和E.coli超微结构的变化。图4示出不同薄膜处理前后菌体的TEM照片。从图中可以看出未经纤维膜处理的S.aureus和E.coli,呈清晰的球状结构和杆状结构,菌体细胞壁和细胞膜连续完整,表面平滑,细胞结构完整,没有损伤(图4(a)、(d))。2种菌经PLA纳米纤维膜处理后,虽然细胞结构开始模糊,但细胞壁、膜没有损伤(图4(b)、(e))。明显观察到经PLA/TP(50/50)复合纳米纤维膜处理后,细胞质膜开始破裂(图4(c)、(f)),并且发现经处理过后的S.aureus细胞膜破裂程度严重,导致细胞内容物外泄,见图4(c)。由此可以推断PLA/TP复合纳米纤维膜破坏了2种菌体细胞膜结构的完整性,内容物呈絮状流出,细胞质成碎渣样或呈弥散状,最终导致细胞死亡。同时可以看出添加TP的复合纳米薄膜对S.aureus细胞膜的破坏作用要强于E.coli,作用相同时间后,TEM照片显示E.coli的细胞膜开始出现大量裂痕,而S.aureus的细胞膜已基本完全破裂,内容物流出。因此在相同作用时间内,PLA/TP复合纳米纤维薄膜对S.aureus的抗菌效果要优于E.coli。

图4 不同薄膜处理前后菌体的TEM照片Fig.4 TEM images of bacterial before and after treated by differentmembranes.(a),(b),(c):S.aureus before and after treated by PLA membrane and PLA/TP composed membranes;(d),(e),(f):E.coli before and after treated by PLA membrane and PLA/TP composed membrane
3 结论
1)FT-IR分析确定聚乳酸/茶多酚复合纳米纤维膜中有茶多酚的存在。二者通过价键的结合很好地复合在一起。
2)PLA/TP复合纳米纤维膜抗菌测试结果均表明:未添加TP的PLA纳米纤维膜基本没有抗菌效果,但随着TP含量的增加,抗菌性能提高。并且复合纳米纤维膜对金黄色葡萄球菌的抗菌效果要优于大肠杆菌。抑菌圈实验结果表明:随着复合薄膜中TP含量的增加,对大肠杆菌和金黄色葡萄球菌的抑菌宽度分别从3.67和3.71 cm增加到5.17和5.67 cm。振荡烧瓶实验结果表明:少量TP的加入,可使得PLA/TP复合纳米纤维膜的抗菌性能得到显著提高,若持续增加TP含量,对抗菌性能的改善不太明显。
3)TEM照片从微观上揭示了PLA/TP复合纳米纤维膜对2种菌种细胞膜结构的破坏作用。同时也揭示了该复合纳米纤维薄膜对金黄色葡萄球菌膜结构完整性的破坏作用要强于大肠杆菌。
[1] 程永清,李丽玲,尹晓敏,等.溶胶-凝胶法制备的掺银TiO2的相变和抗菌性能研究[J].贵金属,2007,28(1):37-42.CHEN Yongqing,LI Lilin,YIN Xiaomin,et al.Study on phase transformation and bactericidal activity of solgel Ag doped titania powders [J].Precious Metals,2007,28(1):37-42.
[2] TIAN F,LI B,JI B P.Antioxidant and antimicrobial activities of consecutive extracts from Galla chinensis:the polarity affects the bioactivities[J].Food Chem,2009(113):173-179.
[3] MATASYOH JC,MAIYO Z C,NUGRE R M,et al.Chemical composition and antimicrobial activity of the essential oil of Coriandrum sativum [J].Food Chem,2009(113):526-529.
[4] KOVALASKAYA N,HAMMONDA R W.Expression and functional characterization of the plant antimicrobial snakin-1and defensin recombinant proteins, protein expression and purification [J].Protein Expression and Purification,2009(63):12-17.
[5] 江海风,杨建忠.含纳米TiO2毛织物的抗菌性能研究[J].毛纺科技,2008(1):4-7.JIANG Haifeng,YANG Jianzhong. Antibacterial property of the wool fabric with nanometer TiO2[J].Wool Textile Journal,2008(1):4 -7.
[6] DENG H B,WANG X Y,LIU P,et al.Enhanced bacterial inhibition activity of layer-by-layer structured polysaccharide film-coated cellulose nanofibrousmats via addition of layered silicate[J].Carbohydrate Polymers,2011(83):239-245.
[7] 孙娟,姚琛,李新松.抗菌聚合物纳米纤维的研究进展[J].高分子通报,2010(8):27-33.SUN Juan,YAO Chen,LI Xinsong.Progress in the antibacterial polymer nanofibers[J].Polymer Bulletin,2010(8):27-33.
[8] 孙唯唯,张华,周永凯.抗菌型多功能聚酰胺纤维的结构与性能[J].纺织学报,2012,33(4):6-11.SUNWeiwei,ZHANG Hua,ZHOU Yongkai.Structure and properties of antibacterialmultifunctional pilyamide fibers[J].Journalof Textile Research,2012,33(4):6-11.
[9] 王曦,王鸿博,高卫东,等.含银PA6纳米纤维制备及抗菌性能的研究[J].合成纤维工业,2008,31(1):12-14.WANG Xi,WANG Hongbo,GAO Weidong,et al.Study on preparation and antibacterial property of silvercontaning PA6 nanofiber[J].China Synthetic Fiber Industry,2008,31(1):12-14.
[10] XU J,ZHANG JH,GAOW Q,ea al.Preparation of chitosan/PLA blend micro/nanofibers by electrospinning[J].Mater Lett,2009(63):658 -660.
[11] CHRISTIANE JD,EDWARD R F.A review of latest research findings on the health promotion properties of tea[J].JNutr Biochem,2001(12):404-421.
[12] AN B J,KWAK JH,SUN JH,et al.Biological and anti-microbial activity of irradiated green tea polyphenols[J].Food Chem,2004(88):549-555.
[13] 李慧玲,吴明华,林鹤鸣.茶多酚-铜络合物的合成及抗菌、消臭性能研究[J].浙江理工大学学报,2008,25(3):266-270.LIHuiling,WU Minghua,LIN Heming.Research on the synthesis of tea polyphenols/Cu complex and its bacteriostasis and deodorization property[J].Journal of Zhejiang Sci-Tech University,2008,25(3):266 -270.

