紫杉醇前药的合成及其对肿瘤细胞活性抑制的研究
单玲玲,高贵珍,曹稳根,段 红
宿州学院化学与生命科学院,安徽宿州,234000
紫杉醇最早是在20世纪60年代从大平洋红豆杉的树皮中提取得到的,作为一种新型微管稳定剂,被誉为20世纪抗肿瘤药物研究领域中最重大的突破。临床上紫杉醇已被用于治疗多种恶性肿瘤,如乳腺癌、卵巢癌、肺癌、头颈部恶性肿瘤和急性白血病[1]。但由于紫杉醇是一种天然的四环二萜类物质,结构复杂——有一个庞杂的环状结构及众多疏水性取代基,故在水中的溶解性不好,制约了紫杉醇的临床应用,因此,需要开发溶解性好的紫杉醇前药[2]。
氨基酸是机体组成的最基本物质,也是能量代谢的基础物质。在肿瘤细胞分裂生长过程中,呈现出对氨基酸的摄取量超过正常组织和细胞,因此,研究者将一些必需氨基酸作为抗肿瘤药物的载体和Linker,这样促进肿瘤细胞对药物的吸收和摄取,同时也可改善化学药物的水溶性,提高药物的生物利用度[3]。在抗肿瘤药物研究中,如何利用氨基酸改造药物成为研究热点[3]。在众多氨基酸中,谷氨酸是药物改造的首选Linker,这是因为谷氨酸是机体必需氨基酸,主要参与机体的氮代谢和能量代谢。有研究证明,在肿瘤组织生长中,谷氨酸是关键性的氨基酸,肿瘤细胞对其摄取率远远高于正常组织,同时也高于其他任何一种氨基酸[4]。离体实验表明:乳腺癌细胞中谷氨酰胺合成酶mRNA表达水平显著增高[5],合成的谷氨酸主要用于能量代谢。活体实验显示:肿瘤组织对谷氨酸的摄取量是正常组织的2倍[6],因此,将谷氨酸作为化学药物的Linker,不仅可提高其水溶性,也可为合成高效低毒的前药提供新途径。
本课题旨在制备紫杉醇前药谷氨酸-紫杉醇,评价紫杉醇前药的理化性质、释药特征及药效,用荧光染料(FITC)标记谷氨酸-紫杉醇,从体外直观证明紫杉醇前药的药效特征,为寻求低毒、高效小分子改造紫杉醇提供科学的实验依据。
1 实验部分
1.1 试剂与仪器
紫杉醇(分析纯,江苏红豆杉药业有限公司),谷氨酸(分析纯,美国Sigma公司),荧光染料FITC(分析纯,美国sigma公司);Model 580酶联免疫检测仪(美国Bio-Rad公司),荧光倒置显微镜(德国Leica公司)。
1.2 紫杉醇-谷氨酸的合成
称取100 mg(0.117 mmol)PTX溶于15 mL的DCM,同时用59.7 mg(0.140 4 mmol)Fmoc-Glu(OtBu)OH和14.29 mg(0.117 mmol)催化剂DMAP,室温(19℃)搅拌22 h。待反应结束后,用同体积的DCM稀释,然后用同体积的蒸馏水洗2次,加入无水硫酸镁干燥,真空旋蒸后,即得晶状体产物Fmoc-Glu(OtBu)-PTX。脱去Fmoc得到紫杉醇-谷氨酸。
1.3 紫杉醇-谷氨酸-FITC的制备
将谷氨酸-紫杉醇溶于DMF中,加入0.01 mmol FITC,-4℃搅拌3 h,将反应液经G25纯化,得到纯化的紫杉醇-谷氨酸-FITC。
1.4 释药动力学观察
通过紫杉醇前药在不同溶液中酯键断裂的实验,观察紫杉醇前药在体外释药动力曲线的特征。
1.5 体外毒性和细胞摄取
1.5.1 细胞MTT实验
在96孔板的每个孔中,加入乳腺癌细胞(MDA-MB)和卵巢癌(SKOV3),在37℃、二氧化碳浓度为5%的条件下,孵育48 h后,分别加入紫杉醇、紫杉醇-谷氨酸和紫杉醇-谷氨酸-FITC三种前药,紫杉醇的浓度为1 mg/mL。设空白组和对照组。感染48 h天后,在470 nm处的吸光值可用酶标仪进行测定。通过如下公式进行计算得到[7]:
Viable Rate(%)=(ODtreated/ODcontrol)×100%。
1.5.2 肿瘤细胞摄取前药的观察
通过体外细胞摄取实验,用FITC标记氨基酸-紫杉醇,考察乳腺癌细胞(MDA-MB-231)对紫杉醇前药的摄取,初步分析其靶向性的机理。
2 结果与讨论
2.1 谷氨酸-紫杉醇前药结构鉴定
纯化后的-NH2-Glu(OtBu)-PTX用LC-MS分析,其质谱鉴定结果(m/z=479 [M-1]-)也与-NH2-Glu(OtBu)-PTX的理论分子量完全一致,-NH2-Glu(OtBu)-PTX:MS(ESI,m/z):1283.4([M+Na]+)如图1。证明已成功合成谷氨酸-紫杉醇前药。
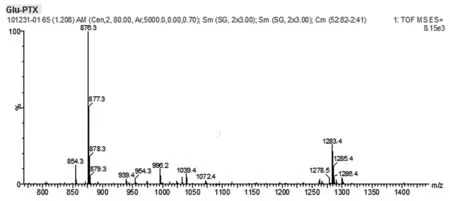
图1 谷氨酸-紫杉醇前药用LC-MS的结构鉴定
2.2 谷氨酸-紫杉醇前药释放曲线
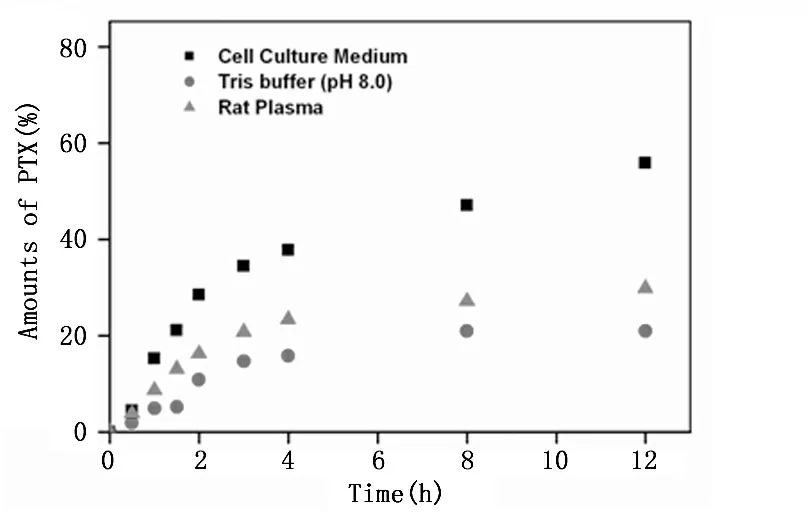
图2 谷氨酸-紫杉醇前药
在三种不同溶液中释药动力学曲线
将Glu-PTX孵育在37℃的PBS、血浆和细胞培养液中,按照不同的时间点取100 uL样品。图2显示,在孵育4 h后,在PBS中Glu-PTX药物释放为15.8%,血浆中的释放率是26.3%,细胞培养液中孵育的释放率为37.8%。由图2可以看出,前药在PBS中释放速度最慢,在细胞培养液中释放速度最快,在血浆中的释放速度处于中间状态,这与细胞培养液和血浆中含酶有关。
2.3 谷氨酸-紫杉醇前药的细胞抑制率
用MTT法检测谷氨酸-紫杉醇前药对MDA-MB-231和SKOV3细胞的抑制活性,实验结果如图3。
从图3可以看出,药物对MDA-MB-231和SKOV3细胞的作用与药物的浓度有明显的依赖性,药物浓度越大对肿瘤细胞的抑制性越强。两种前药对肿瘤细胞的抑制性略低于PTX单体,表明利用2位羟基修饰PTX可降低其细胞毒性。药物对MDA-MB-231和SKOV3两种肿瘤细胞的抑制作用相比,药物对MDA-MB-231的抑制率高于SKOV3,说明紫杉醇和紫杉醇前药对MDA-MB-231肿瘤细胞的抑制作用优于对SKOV3的作用。
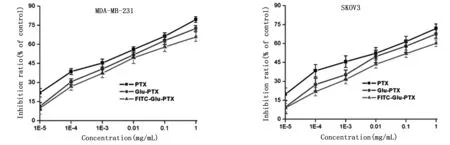
图3 紫杉醇前药在MDA-MB-231和SKOV3两种肿瘤细胞中的抑制作用(mean±SD,n=6)
2.4 紫杉醇前药在乳腺癌细胞中的摄取
用六孔板孵育MDA-MB-231细胞,加入FITC标记谷氨酸-紫杉醇前药并孵育12 h,由图4可观察到紫杉醇前药已进入肿瘤细胞,分析其结果,主要是因为紫杉醇前药提高了紫杉醇药物的水溶性,使肿瘤细胞对药物的摄取量增加。
图4 谷氨酸-紫杉醇前药在乳腺癌MDA-MB-231细胞中摄取
3 结 论
本实验成功制备了谷氨酸-紫杉醇前药,并用荧光染料标记紫杉醇前药,实验结果显示谷氨酸-紫杉醇前药具有良好的释药动力曲线,而对肿瘤细胞毒性较小,但可增加肿瘤细胞对其摄取量,这为改造紫杉醇提供了新途径。
参考文献:
[1]Wall ME.Camptothecin and taxol:discovery to clinic[J].Med Res Rev,1998,18(5):299-314
[2]Ettmayer P,Amidon G L,Clement B,et al.Lessons learned from marketed and investigational prodrugs[J].J Med Chem,2004,47:2393-2404
[3]卓仁喜,范昌烈,赵儒林.含5-氟尿嘧啶的氨基酸衍生物的合成及其抗肿瘤活性研究 [J].高等学校化学学报,2006,7(6):508-512
[4]Abou-Khalil W H,Yunis A A,Abou-Khalil S.Prominent glutamine oxidation activity in mitochondria of hematopoietic tumors[J].Cancer Res,1983,43:1990-1993
[5]Sandra Loeppen,Daniela Schneider,Frank Gaunitz,et al.Overexpression of Glutamine Synthetase Is Associated with-Catenin-Mutations in Mouse Liver Tumors during Promotion of Hepatocarcinogenesis by Phenobarbital[J].Cancer Res,2002,62:5685-5688
[6]Landel A M,Hammond W G,Meguid M M.Aspects of amino acid and protein metabolism in cancer-bearing states[J].Cancer Res,1985,55:230-237
[7]Huang Y,Shi J,He Q,et al.The promise of paclitaxel-peptide conjugates for MMP-2-targeted drug delivery[J].Cancer Biol Ther,2010,9(3):204-205

