虹鳟LECT2的酵母表达、纯化及生物活性分析
史雨红,章瑞程,杨旦阳,陆新江,陈 炯,李明云
宁波大学 应用海洋生物技术教育部重点实验室, 浙江 宁波 315211
白细胞衍生趋化因子 2 (leukocyte cell-derived chemotaxin 2, LECT2)是一个多功能细胞因子,参与肝移植及再生(Sato et al, 2004; Ohtomi et al, 2007)、类风湿性关节炎(Okumura et al, 2008)、肾淀粉样病变(Larsen et al, 2010)以及肿瘤细胞生长和迁移(Ong et al, 2011)等多种病理和生理过程。近年来,鱼类LECT2的研究发展迅速,且主要集中于其与病原微生物感染免疫反应的相关性。目前已克隆了鲤鱼(Cyprinus carpio) (Fujiki et al, 2000)、虹鳟(Oncorhynchus mykiss, rainbow trout) (Bayne et al,2001)、斑马鱼(Danio rerio) (Lin et al, 2007)、大黄鱼(Pseudosciaena crocea) (Li et al, 2008)、香鱼(Plecoglossus altivelis) (Yang et al, 2009)、赤点石斑鱼(Epinephelus akaara) (Shi et al, 2010)、斜带石斑鱼(E. coioides) (Wei et al, 2011)和褐石斑鱼(E. bruneus)(Harikrishnan et al, 2012)的LECT2基因。文献报道揭示,斑马鱼在感染杀鲑气单胞菌(Aeromonas salmonicida)和金黄色葡萄球菌(Staphylococcus aureus)后,肝脏LECT2基因mRNA表达量增加1000倍 (Lin et al, 2007);大黄鱼在感染溶藻弧菌(Vibrio alginolyticus)后,肝脏LECT2基因mRNA表达量增加82.82倍,在脾脏中表达量增加58.56倍(Li et al,2008);斜带石斑鱼感染金黄色葡萄球菌、创伤弧菌(V. vulnificus)、副溶血弧菌(V. parahaemolyticus)、酿酒酵母(Saccharomyces cerevisiae)和新加坡石斑鱼虹彩病毒(Singapore grouper iridovirus, SGIV)后,肝脏LECT2基因mRNA表达均上调(Wei et al, 2011);褐石斑鱼感染海豚链球菌(Strptococcus iniae)后,肝脏、脾脏和心脏LECT2基因mRNA表达量急剧上升(Harikrishnan et al, 2012)。新近,我们采用酵母双杂交和免疫共沉淀技术鉴定发现 LECT2能与一种免疫细胞上的模式识别受体(pattern recognition receptors, PRRs)—C型凝集素受体(C-type lectin receptor,CLR)(Chen et al, 2010 )相互作用,推测LECT2可能与鱼类免疫细胞调控有关。
虹鳟不仅是重要的冷水性养殖鱼类,也是鱼类免疫学研究的重要实验生物(Pérez-Sánchez et al,2011; Wenger et al, 2011)。本文采用毕赤酵母表达系统分泌表达了虹鳟LECT2,采用柱层析方法分离纯化目标蛋白,并验证其生物学活性,为相关蛋白的后续功能研究奠定了基础。
1 材料与方法
1.1 实验材料
大肠杆菌TOP10菌株、毕赤酵母X33和真核表达载体pPICZαA由本实验室保存。AMV逆转录酶、Ex Taq DNA聚合酶、DNA Ligation Kit Ver.2.0、限制性内切酶EcoRI、KpnI和Sac I为 Takara公司产品;1 kb DNA ladder为Fermentas公司产品;Gel Extraction Kit为Omega公司产品;YPD培养基为Clontech公司产品;Zeocin、DMEM培养基和庆大霉素为Invitrogen公司产品;UNOsphere S阳离子交换柱和P6填料为Bio-rad公司产品;BCA-200蛋白含量测定试剂盒为 Pierce公司产品;含有 BSA的免疫原EDC试剂盒购自Thermo Scientific公司;二抗 (辣根过氧化物酶标记山羊抗小鼠 IgG) 为北京中山金桥生物技术有限公司产品;ECL化学发光试剂盒、显影定影试剂盒购自碧云天生物技术研究所;硝基四氮唑蓝(NBT)和牛血清白蛋白(BSA)购自Sigma 公司;趋化小室法为Corning公司产品。其他常规化学药剂均为国产分析纯。引物由上海英俊生物技术有限公司合成。
1.2 实验方法
1.2.1 虹鳟LECT2 N端多肽的多克隆抗体制备
取虹鳟 LECT2 N端 20个氨基酸残基(EDIENYTSLQEFTEDISHCG),由吉尔生化(上海)有限公司合成多肽。再取合成多肽和BSA各5 mg,采用EDC法进行偶联。确定偶联成功后,每7 d免疫注射小鼠1次,共注射3次。于最后一次注射3 d后眼动脉取血,4 ℃放置 6 h离心取血清,用于Western blot检测。
1.2.2 重组虹鳟LECT2真核表达载体的构建
根据已发表虹鳟LECT2基因序列(EMBL登录号 AF363272) (Kokkinos et al, 2005)设计引物:pPI-rt-LECT2(+)/pPI-rt- LECT2(-) (表1),扩增片段为虹鳟LECT2去除信号肽的成熟蛋白(LECT2m)。取1 µg虹鳟肝脏总RNA为模板,oligo (dT)30为引物,42 ℃下AMV逆转录酶合成1.5 h,获得第一链cDNA。以此为模板,PCR扩增获得目的片段。扩增产物经 1%琼脂糖凝胶电泳分离纯化后,经限制性内切酶EcoR I和Kpn I双酶切后,插入相同酶切的pPICZαA载体,克隆获得pPICZαA-LECT2m重组质粒。
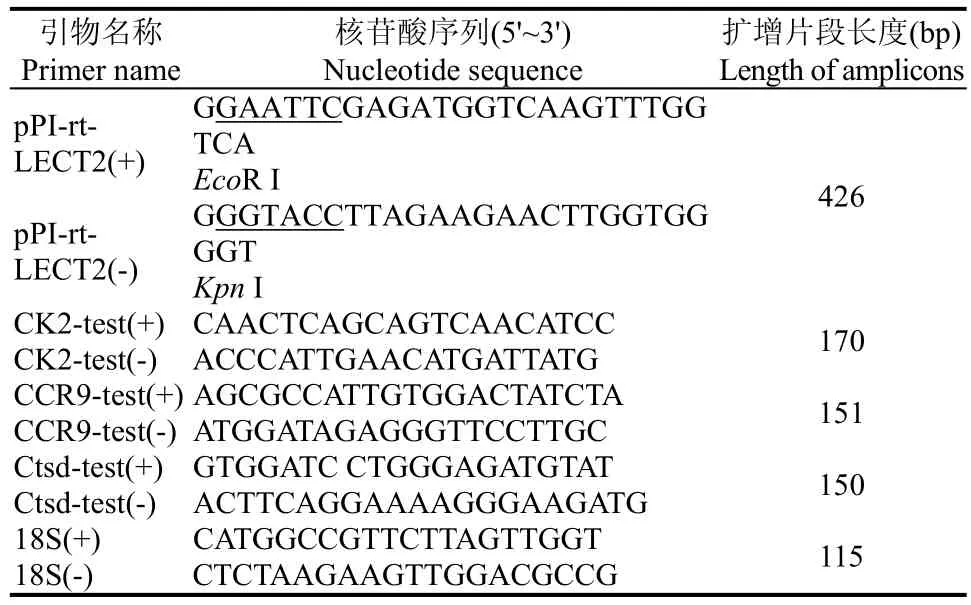
表1 实验中所用引物Table 1 Primers used in the study
1.2.3 重组虹鳟LECT2基因在毕赤酵母X33中表达
采用电转方法导入毕赤酵母X33中,转化液涂布含Zeocin (100 μg/mL) YPDS培养基上,30 ℃培养 3~4 d。将这些转化子点到 Zeocin含量分别为500、1 000、2 000 μg/mL的YPDS培养基上,筛选获得高抗性工程菌株。取Zeocin高抗性菌株的菌落进行菌落 PCR,引物为 pPI-rt-LECT2(+)/pPI-rt-LECT2(-)和5'AOX1/3'AOX1。高抗性工程菌株进行甲醇诱导(Jin et al, 2011),使毕赤酵母分泌表达重组虹鳟LECT2。
1.2.4 重组虹鳟LECT2的柱层析纯化
收集1.2.3节中的培养上清,上样至UNOsphere S阳离子交换柱,以3.0 mL/min的流速洗脱,洗脱液为1 mol/L 氯化钠溶液。分段收集洗脱组分,并进行 SDS-PAGE蛋白电泳及 Western blot检测。Western blot检测参考Huang et al (2011) 的方法,所用一抗为制备的虹鳟LECT2 N端多肽的多克隆抗体。最后将含有目的蛋白的洗脱组分用脱盐层析柱(P6填料)脱盐处理,目的组分真空冷冻干燥目的组分采用 BCA-200蛋白含量测定试剂盒测定总蛋白量,并用 12% SDS-PAGE 检测纯化效果,通过电泳条带的积分光密度计算蛋白纯度。
1.2.5 对巨噬细胞的趋化活性
健康虹鳟个体体重227~250 g,购自杭州近江农都水产品市场。头肾来源的巨噬细胞的分离参考Ryckaert et al (2010) 的方法,取虹鳟头肾组织,100目筛网过滤后用培养基I(DMEM含5% 肽牛血清,1%非必需氨基酸和谷氨酰胺,100 mg/mL链霉素、青霉素和卡那霉素以及10 IU/mL肝素)冲洗细胞悬液。Percoll室温梯度离心(400 r/min,25 min,4 ℃),取位于密度为 34%~51%区域的细胞并用 DMEM洗涤,细胞计数及台盼蓝染色观察后,细胞重悬于培养基II (DMEM,不含抗性及肽牛血清,含0.1%热灭活血清)中,细胞悬液浓度为1×106cells/mL。纯化后的重组虹鳟 LECT2以及其高温变性蛋白用培养基 II配制 5个浓度梯度(0、0.1、1、10、100 μg/mL)。利用趋化小室体外验证重组蛋白的趋化活性,具体步骤见Zhang et al (2011)。吉姆萨染液染色后显微镜观察,随机选择5个视野进行计数,表示为mean±SD。趋化指数(chemotactic index, CI) 指细胞迁移到待测样品液及对照液的数目比值。
1.2.6 对巨噬细胞呼吸爆发的影响
采用 NBT法测定巨噬细胞呼吸暴发,具体方法见 Hsieh et al (2008)。虹鳟巨噬细胞(2×106cells/mL)中加入500 μL PBS (含 0.1% NBT,5 μg/mL LECT2) ,17 ℃孵育12 h后用400 μL甲醇终止反应。产生的甲臜由 130 μL 2 M KOH 和 150 μL DMSO溶解。KOH/DMSO为空白对照,分别添加PBS(含 0.1% NBT)和 PBS(含 0.1% NBT,5 μg/mL BSA)与头肾来源的巨噬细胞进行孵育,作为空白对照和阴性对照。分光光度计在620 nm波长读取光密度值。
1.2.7 对巨噬细胞杀菌能力的影响
虹鳟头肾来源巨噬细胞(2×106cells/mL)经 5 μg/mL LECT2预处理12 h后,与E. coli DH5α共培养,MOI为10。30 min后加入100 μg/mL庆大霉素除去培养基上清中未被吞噬的E. coli DH5α。此后,用含12.5 μg/mL庆大霉素的PBS清洗细胞。将该样品分成两组,一组细胞共培养后用 0.1%Triton X-100溶液裂解后在LB培养基上涂布,培养18 h,计算菌落数作为摄入细菌数;另一组加入无血清培养基后培养2 h,再裂解并在LB培养基上涂布,培养18 h,计算菌落数作为存活细菌数。存活率=(存活细菌/摄入细菌数)×100。PBS和 PBS (5 μg/mL BSA)溶液处理头肾来源巨噬细胞作为空白对照和阴性对照。
1.2.8 对巨噬细胞基因表达的影响
按1..2.5分离头肾来源的巨噬细胞备用。将重组虹鳟LECT2配成溶液(5 mg/mL,培养基II),取1 mL上述细胞悬浮液(1×106cells/mL)加入到24孔细胞培养板中,将 24孔板转移至细胞培养箱(17 ℃,5% CO2)中培养24 h。用不含LECT2的培养基II作为阴性对照,对照组和实验组分别设置3个技术重复。根据NCBI数据库中趋化因子2 (CC chemokine with stalk, CK2, AF418561)、CC趋化因子受体型9(CC chemokine receptor type 9, CCR9,NM_001124610)以及组织蛋白酶 D (Cathepsin D,Ctsd, U90321)设计扩增引物(表 1)。mRNA 抽提、cDNA合成及荧光定量RT-PCR方法见Huang et al(2011)。
2 结 果
2.1 虹鳟LECT2真核表达载体构建、诱导表达及纯化
测序表明,pPICZαA-LECT2m重组质粒插入片段开读框正确,且与已获得的虹鳟成熟LECT2基因核苷酸序列同源性为 100%。该重组质粒转化毕赤酵母X33后,低抗培养基上得到>1 432个转化子。这些转化子在1 000 μg/mL Zeocin的YPDS培养基上获得 6个菌株。这些菌株用 pPI-rt-LECT2(+)/pPI-rt-LECT2(-)引物进行菌落 PCR,均扩增出 426 bp的条带,而阴性对照中无扩增条带;用5'AOX1和3'AOX1引物扩增出~1.0 kb LECT2表达单元和2.2 kb 的野生型AOX1基因。因此,这些克隆均为阳性重组工程菌株 X33/ pPICZαA-LECT2m。工程菌 X33/ pPICZαA-LECT2m 经甲醇诱导表达,SDS-PAGE电泳结果显示一条诱导表达条带,相对分子质量为~15.9×103,与预测大小相符。
选择6号工程菌进一步扩大诱导表达,诱导培养上清经UNOsphere S阳离子交换柱分离后,出现杂峰和明显主峰各一(图1A),分别命名为峰1和峰2,经SDS-PAGE蛋白电泳及Western blot检测,确定峰2为目的组分重组虹鳟LECT2(图1B,C)。经脱盐处理后,目的组分纯度为96%,该重组工程菌株 X33/ pPICZαA-LECT2m 的表达水平为~120 mg/L酵母培养物。
2.2 重组虹鳟LECT2对巨噬细胞趋化活性验证
当重组LECT2浓度为0.1~1 μg/mL时,浓度越高,趋化活性越强,浓度为1 μg/mL时趋化指数(CI)达到 7.92,之后无显著变化(图 2)。重组虹鳟LECT2较其高温变性蛋白对照组具有显著的趋化活性 (图2)。即纯化的重组虹鳟LECT2对头肾来源的巨噬细胞具有趋化活性,并在一定范围内具有浓度依赖性。
2.3 重组虹鳟LECT2对巨噬细胞呼吸爆发和杀菌能力的影响
与阴性对照相比,添加5 μg/mL LECT2,OD值显著升高3.1倍 (图3A),说明头肾来源的巨噬细胞产生大量超氧阴离子,将 NBT还原,呼吸爆发增强 (P<0.001)。5 μg/mL LECT2 处理虹鳟头肾来源巨噬细胞12 h后,E. coli DH5α与细胞共培养30 min,测定E. coli DH5存活率。结果显示,LECT2处理的头肾来源巨噬细胞中E. coli DH5α存活率显著下降,为阴性对照的0.51倍(图3B),说明LECT2处理使虹鳟头肾来源巨噬细胞杀菌能力增强(P<0.01)。
2.4 重组虹鳟LECT2对巨噬细胞基因表达的影响
为了验证重组虹鳟 LECT2的对巨噬细胞基因转录活性的影响,我们参考了 Zhang et al(2011)的重组香鱼 LECT2对头肾来源巨噬细胞基因表达影响实验,选择了变化显著的 CK2、CCR9以及Ctsd基因进行荧光定量PCR检测。结果表明,CK2、CCR9以及Ctsd基因 mRNA表达分别上调6.25、4.55及5.80倍 (图4)。
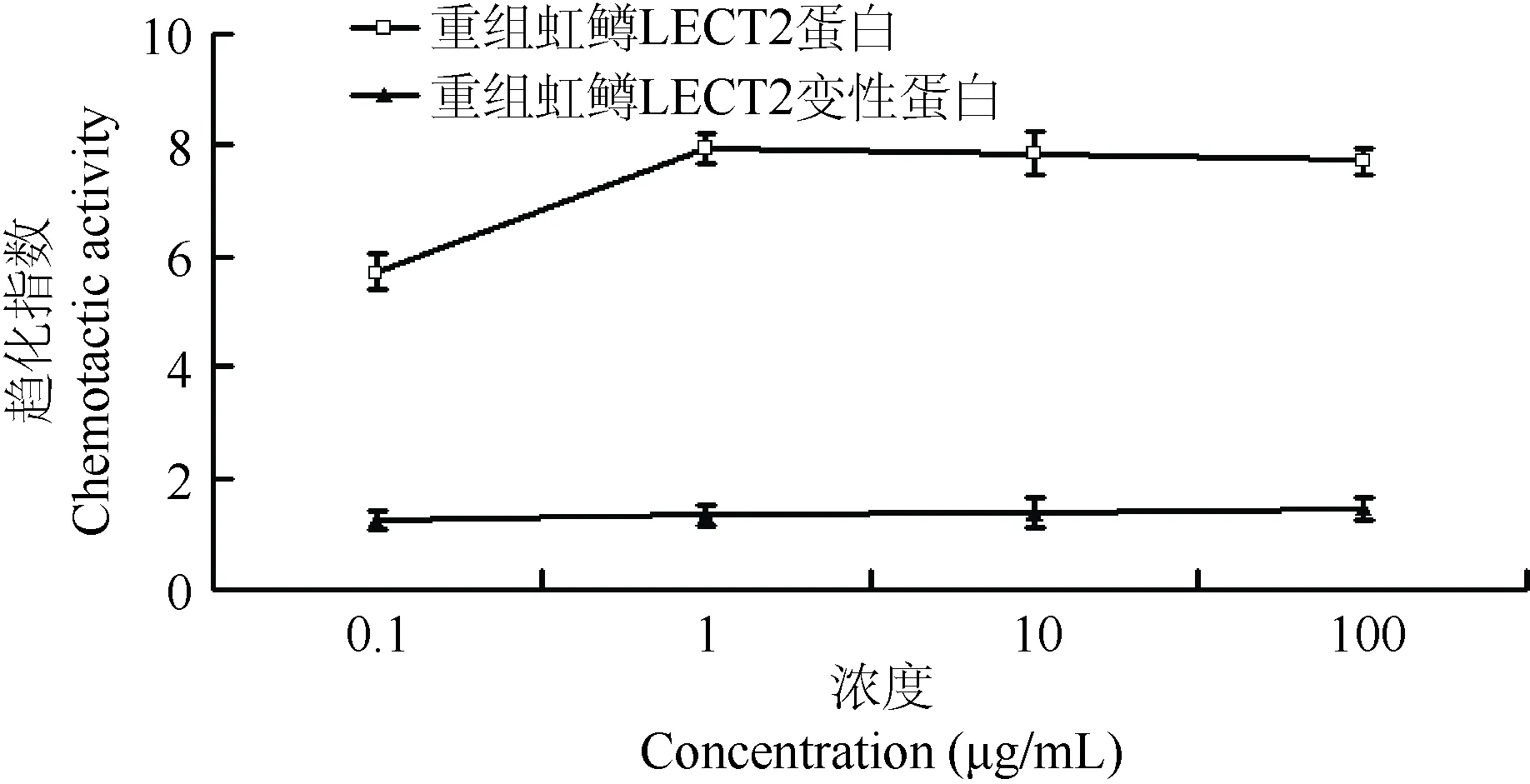
图2 不同浓度重组虹鳟LECT2和重组虹鳟LECT2变性蛋白对头肾来源巨噬细胞趋化活性的影响 (n=3)Figure 2 Dose-response relationship of rainbow trout refolded and denatured-reduced LECT2 to attract head kidney-derived macrophages, respectively
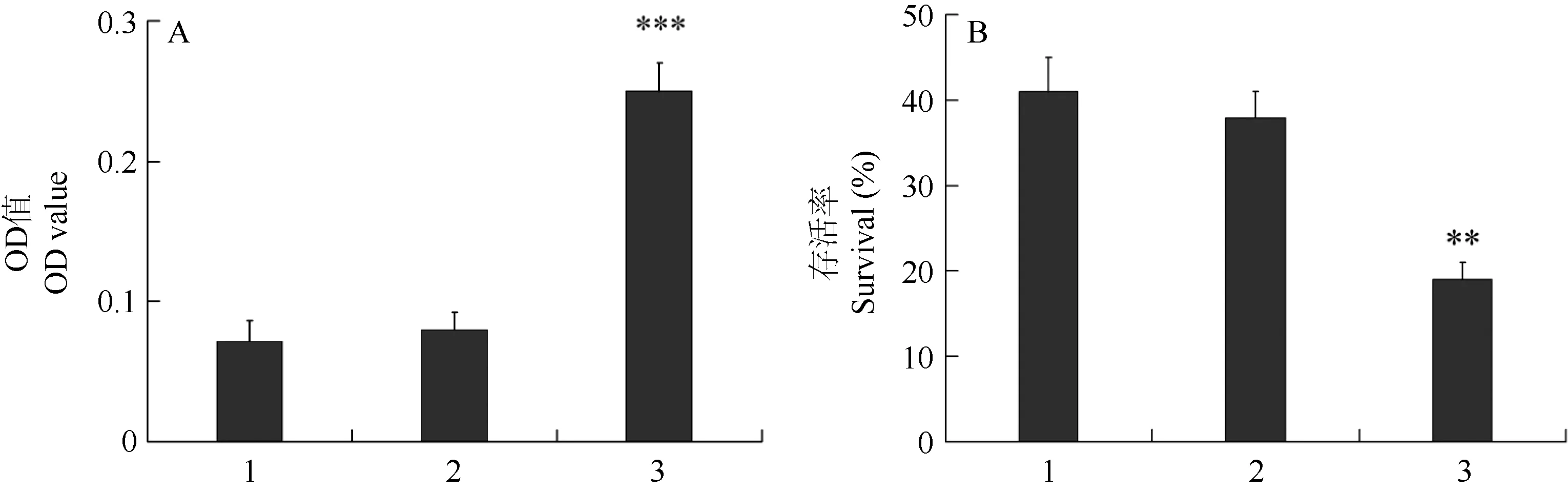
图3 重组虹鳟LECT2对头肾来源单巨噬细胞呼吸爆发(A)和杀菌能力(B)的影响Figure 3 Effects of rainbow trout LECT2 on respiratory burst activity (A) and bactericidal activity ofrainbow trout head kidney-derived macrophages (B)1:PBS,2:PBS (5 μg/mL BSA),3:PBS (5 μg/mL LECT2);n=3,**:P<0.01,***:P<0.001.

图4 重组虹鳟LECT2对头肾来源巨噬细胞CK2、CCR9和Ctsd表达的影响Figure 4 Effect of LECT2 on the expression of CK2, CCR9和Ctsd genes in primary cultured head kidney-derivedmacrophages of rainbow trout以 18 S rRNA 为内参;n=4,**P < 0.01; ***P < 0.001。Relative expression levels of mRNA are normalized against 18S rRNA. n=4, **: P < 0.01; ***: P < 0.001.
3 讨 论
本研究构建了虹鳟 LECT2酵母真核表达载体pPICZαA-LECT2m,并转化毕赤酵母X33,经甲醇诱导表达获得目的蛋白,采用阳离子交换柱和分子筛层析方法进行纯化,获得纯度为96%,得率为120 mg/L酵母培养物目的蛋白。由于虹鳟LECT2的4个半胱氨酸,由两对二硫键相连,呈发夹结构(Okumura et al, 2009),其活性依赖于形成正确的二硫键并折叠成高级结构。毕赤酵母表达系统具备真核系统所特有的二硫键修饰作用,所表达的目的蛋白无需繁琐的复性操作,有利于提高蛋白的稳定性和活性蛋白得率。
LECT2最初因具有嗜中性粒细胞体外趋化活性,因而被定义为新型趋化因子(Yamagoe et al,1996)。本研究表明,重组虹鳟LECT2对头肾来源巨噬细胞也具有趋化活性。这一结果与已报道的重组香鱼LECT2的作用一致 (Zhang et al, 2011)。进一步研究显示,该重组蛋白可使巨噬细胞呼吸爆发和杀菌能力增强。呼吸爆发是免疫细胞遇到免疫刺激物以后,氧消耗增加或者产生超氧离子而发生,而具有机体防御功能的一些细胞因子也可以诱导呼吸爆发,诸如TNFα、IFNγ和IL-8 (Rieger et al,2011)。巨噬细胞直接杀灭病原微生物,一方面可以抑制病原微生物的生长,另一方面还可以将抗原递呈给T细胞激活获得性免疫 (Martinez-Pomares and Gordon, 2012)。巨噬细胞这两种功能的增强,揭示LECT2不仅趋化巨噬细胞作定向移动,而且可增强巨噬细胞清除病原菌的作用。在分子水平上进一步研究发现,巨噬细胞功能的发挥离不开细胞因子的分泌和调控。CK2是在虹鳟中发现的CC趋化因子,与CK1不同的是具有一个91氨基酸组成的柄状结构(Liu et al, 2002)。巨噬细胞分泌并参与宿主免疫防御过程,特别是炎症反应。CCR9为趋化因子CC亚族的受体,在介导趋化因子参与的免疫调节、器官形成、调节造血和神经元通讯中起重要作用(Schmutz et al, 2010)。Ctsd是一种天冬氨酸类溶酶体的肽链内切酶,在免疫识别和炎症状态等病理变化中具重要作用(Park et al, 2009),它在鱼类中的免疫相关性已得到证实。重组虹鳟 LECT2处理巨噬细胞后,这3个基因表达上调,与重组香鱼LECT2的实验结果一致(Zhang et al, 2011)。因此,鱼类LECT2可能对头肾来源的免疫细胞具有免疫调节作用。
综上所述, 我们建立了虹鳟LECT2毕赤酵母表达及纯化方法,该方法操作简单,得率高,制备的虹鳟 LECT2具有生物学活性,可以用于后续功能研究。
- Zoological Research的其它文章
- Blockage of glucocorticoid receptors during memory acquisition,retrieval and reconsolidation prevents the expression of morphineinduced conditioned place preferences in mice
- Seasonal variations in the energy budget of Elliot’s pheasant(Syrmaticus ellioti) in cage
- Seed caching and cache pilferage by three rodent species in a temperate forest in the Xiaoxinganling Mountains
- Proximity association in polygynous western black crested gibbons(Nomascus concolor jingdongensis): network structure and seasonality
- 中国鸟类亚种新记录——黑冠黄鹎
- 蛇毒抗菌肽OH-CATH对大肠杆菌引起家兔泌尿系感染的保护作用

