银杏内酯B对缺氧缺血性脑损伤新生大鼠脑组织Caspase-3及VEGF mRNA表达的影响*
王 军,尚凤伟,朱登纳,王宝珍,张冬秀,张贞焕,马洁琼
郑州大学第三附属医院脑瘫康复科 郑州450052
△女,1963年7月生,博士,教授,主任医师,研究方向:小儿神经疾病的康复治疗,E-mail:swangjun@zzu.edu.cn
缺氧缺血性脑损伤(hypoxic-ischemic brain damage,HIBD)是围产期导致新生儿死亡及遗留神经系统后遗症的重要原因,目前各种治疗方法疗效有限。银杏内酯B(ginkgolide B,GB)是银杏叶提取物中主要的药效成分之一,为二萜类酸化合物,广泛用于心脑血管、中枢神经系统疾病。有研究[1]表明,GB 对短暂性及永久性局灶性大脑中动脉阻塞模型大鼠和小鼠均具有保护作用。Caspase-3 是介导细胞凋亡的关键分子,在凋亡信号传导的许多途径中发挥作用。血管内皮生长因子(vascular endothelial growth factor,VEGF)是一种内皮细胞特异的强效有丝分裂原,有促内皮细胞生长的作用,可诱导血管及淋巴管的生成,因此VEGF 的表达对改善脑缺血灶周围的侧支循环,促进脑功能的恢复具有重要意义。作者观察了GB对HIBD 新生大鼠脑组织Caspase-3 和VEGF mRNA表达的影响,为临床应用提供实验依据。
1 材料与方法
1.1 实验动物与材料 清洁级新生7 d 龄健康SD大鼠96 只,体质量12~16 g,由河南省实验动物中心提供;GB 购于中国科学院生物药品检定所;体积分数8%O2+体积分数92%N2混合气体购于北京普莱克斯气体公司;Trizol(Invitrogen 公司);逆转录试剂盒及荧光定量PCR 仪(SYBR GreenⅠ染料法),北京康为世纪公司;荧光定量PCR 仪,美国Applied Biosystems 公司。
1.2 实验分组 动物按随机数字表法分为假手术组(n=24)、模型组(n =24)、GB 低剂量组(n =24)及GB 高剂量组(n =24)。模型组、GB 低剂量组及GB 高剂量组采用经典Rice 法[2]制作HIBD 动物模型:乙醚麻醉后将动物置于手术台上,分离并两端结扎左侧颈总动脉,中间剪断,术后放回母鼠身边恢复0.5~1.0 h 后,放入常压缺氧箱中,箱内放置钠石灰,用以吸收动物排出的CO2,以1.0~1.5 L/min的速度向容器内输入混合气体,持续2.5 h 后,放回母鼠身边继续饲养。假手术组只分离不结扎左侧颈总动脉,不行缺氧处理。模型制作4 h 后,GB 低剂量组及GB 高剂量组分别以5 和10 mg/kg 腹腔注射GB,给药容积10 mL/kg,余2组给等量生理盐水,1次/d,共5 d。
1.3 标本取材 造模后第3、7、14 及28 天,各组分别随机抽取6 只大鼠处死,处死前称质量,断头取脑,取左侧脑组织分装于冻存管中,立即置液氮中快速冷冻,随后于-80℃冰箱保存。
1.4 脑组织Caspase-3 和VEGF mRNA 的检测采用荧光定量PCR 法。脑组织标本在液氮中研磨,按Trizol 试剂及逆转录试剂盒说明书抽提RNA,逆转录合成cDNA 后,进行PCR 扩增。根据GenBank中β-actin 及目的基因序列,利用Primer 5.0 设计引物,由上海生工生物工程技术服务有限公司合成(表1)。采用两步法PCR 反应,反应条件:95℃预变性10 min,(95℃变性15 s+60℃退火延伸1 min)×35 个循环,得到每个样品的Ct 值。采用2-ΔΔCt法计算目的基因的表达量,ΔΔCt=(Ct目的基因-Ct内参)实验组-(Ct目的基因-Ct内参)对照组。

表1 PCR 引物序列及产物
1.5 统计学处理 采用SPSS 17.0 进行数据分析,不同时间、同一时间点4组间脑组织Caspase-3 与VEGF mRNA 表达量的比较采用单因素方差分析,两两比较采用LSD-t 法检验,检验水准α=0.05。
2 结果
2.1 动物一般情况 动物缺氧过程中出现躁动、翻滚、皮肤发绀、头部颤动等表现。HIBD 后动物出现不同程度的行为学异常,如喂养困难、活动减少、体质量增长缓慢等。实验过程中没有动物死亡。
2.2 4组大鼠脑组织Caspase-3 与VEGF mRNA的表达 荧光定量PCR 产物琼脂糖凝胶电泳图见图1。模型组、GB 低剂量组及GB 高剂量组Caspase-3 mRNA 的表达均于造模后第3 天达最高,此后逐渐下降,第28 天时接近基线水平。这3组VEGF mRNA 的表达于造模后第3 天达最高,此后下降,模型组下降较快,GB 低剂量组及GB 高剂量组下降趋势相对缓慢。假手术组两个指标各时间点表达差异无统计学意义。见表2、3。

图1 实时荧光定量PCR 产物的琼脂糖凝胶电泳图

表2 4组大鼠脑组织Caspase-3 mRNA 的表达
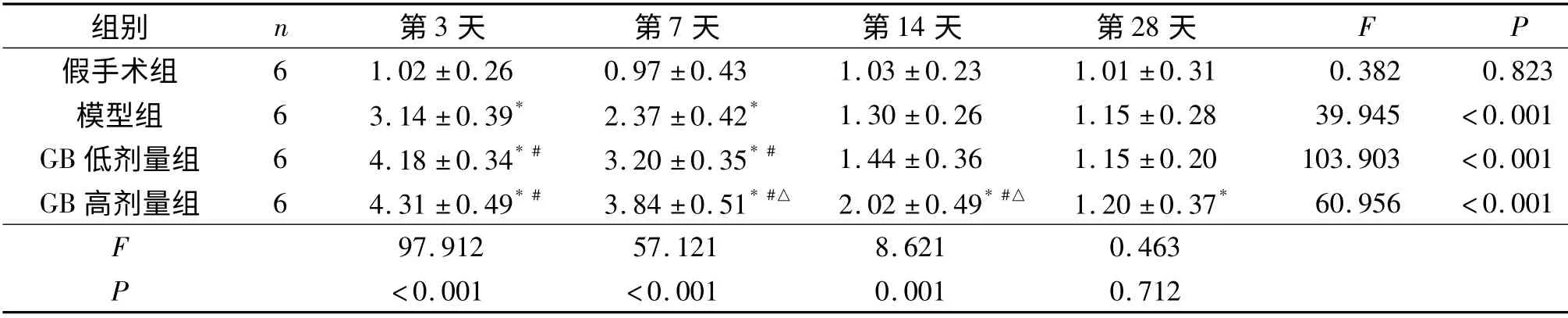
表3 4组大鼠脑组织VEGF mRNA 的表达
3 讨论
新生儿HIBD 是导致新生儿脑损伤及后遗脑性瘫痪的常见原因,近年来由于高危妊娠增多及新生儿抢救成功率的提高,HIBD 的发病率有增高趋势,但目前对此病的治疗效果不佳[3-5]。GB 是从银杏叶中提取的一种天然的血小板活化因子(plateletactivating factor,PAF)受体拮抗剂,是银杏内酯中神经保护作用最显著的成分之一,有抗氧化、抗炎及抗细胞凋亡作用[6-7]。季秋虹等[8]用GB 预处理原代培养的小鼠皮层神经元,再进行严重缺血损伤处理,观察神经元Caspase-3 蛋白表达的变化,发现GB 预处理可促进缺血神经元增殖,抑制Caspase-3 的活化,降低神经细胞凋亡比率。HIBD 后神经细胞中伴有多种凋亡相关基因的表达及蛋白的合成,Caspase-3 作为细胞凋亡最关键的效应蛋白酶,在损伤区的细胞凋亡过程中起决定性作用[9]。研究[10]表明正常人脑神经元中几乎无Caspase-3 蛋白表达,而在脑缺血时神经元中Caspase-3 蛋白表达明显升高[11-12]。
该研究结果显示,模型组大鼠HIBD 后第3 天脑组织Caspase-3 表达明显增加,此后虽逐渐降低,但直到术后第28 天仍高于假手术组;GB 高、低剂量组HIBD 后脑组织Caspase-3 表达较模型组明显降低,其中高剂量组降低更加显著。说明HIBD 后脑组织Caspase-3 表达上调,细胞凋亡增加;应用GB后可显著下调Caspase-3 的表达,减少细胞凋亡,从而减少脑损伤。Hostettler 等[13]在培养星形胶质细胞和少突胶质细胞时加入0.02~2.00 mg PAF,72 h后细胞死亡增多,加入GB 可显著减少细胞死亡,而各种浓度的PAF 均可使Caspase-3 表达增多,这与该研究结果相一致。作者的观察结果还显示HIBD诱导的细胞凋亡可持续至伤后4 周甚至更久,因此临床治疗此类疾病时可适当延长治疗的时间窗。
VEGF 是一类促进血管再生,增加血管通透性的细胞因子,调控其表达的因素很多,缺血或低氧是诱导VEGF 表达的最主要因素[14]。有研究[15]发现,GB 可显著上调星形胶质细胞VEGF mRNA 的表达。该研究发现,模型组大鼠HIBD 后,脑组织VEGF 的表达明显增加,术后第14 天才降至正常水平;GB 高、低剂量组脑组织同时间点VEGF 的表达较模型组增加,高剂量组的效果更显著,直到术后第28 天仍高于正常水平。脑缺血发生时,VEGF 表达增加对损伤脑组织起着多重修复作用,涉及促进血管形成、诱导神经发生、直接的神经营养和保护作用及抗凋亡等多重机制[16-18]。该研究结果提示:GB可能通过上调VEGF 的表达,促进脑损伤区血管的形成,改善细胞微环境,发挥神经营养及保护作用,并对损伤区神经干细胞的增殖迁移产生积极的影响,从而对损伤脑组织进行修复。
综上所述,GB 可以下调脑损伤诱导的Caspase-3 表达,上调VEGF 表达,从而降低脑损伤后细胞凋亡并改善损伤区微环境,促进脑损伤的修复,高剂量效果更加明显。这将为HIBD 的治疗提供新的思路,为GB 的临床应用提供了理论依据。
[1]黄贱英,孙建宁,梅世昌,等.银杏内酯B 对缺血/再灌脑损伤大鼠的保护作用[J].中国药理学通报,2008,24(2):269
[2]Rice JE 3rd,Vannucci RC,BrieHey JB.The influence of immaturity on hypoxic-ischemic brain damage in the rat[J].Ann Neurol,1981,9(2):131
[3]Selway LD.State of the science:hypoxic ischemic encephalopathy and hypothermic intervention for neonates[J].Adv Neonatal Care,2010,10(2):60
[4]邹峥,刘小惠,邹大卫.缺氧缺血性脑损伤[J].实用儿科临床杂志,2011,26(18):1446
[5]乔丽丽,沈伟勤,陈国宏,等.褪黑素对缺氧缺血性脑损伤新生大鼠的保护作用[J].实用儿科临床杂志,2011,26(15):1204
[6]Maclennan KM,Darlington CL,Smith PF.The CNS effects of Ginkgo biloba extracts and ginkgoide B[J].Prog Neurobiol,2002,67(3):235
[7]Xia SH,Fang DC.Pharmacological action and mechanisms of ginkgolide B[J].Chin Med J (Engl),2007,120(10):922
[8]季秋虹,吴小梅,李建成,等.银杏内酯B 抗缺血神经元凋亡的预适应作用[J].中风与神经疾病杂志,2008,25(5):520
[9]Adamczyk A,Kazmierczak A,Czapski GA,et al.Alpha-synuclein induced cell death in mouse hippocampal (HT22)cells is mediated by nitric oxide-dependent activation of caspase-3[J].FEBS Lett,2010,584(15):3504
[10]赵彦坡,秦洁,孙石磊.美金刚对大鼠脑缺血再灌注后Caspase-3 表达及丙二醛含量的影响[J].郑州大学学报:医学版,2011,46(5):748
[11]Nakajima W,Ishida A,Lange M,et al.Apoptosis has a prolonged role in the neurodegeneration after hypoxic ischemia in the newborn rat[J].J Neurosci,2000,20(21):7994
[12]Davoli MA,Fourtounis J,Tam J,et al.Immunohistochemical and biochemical assessment of caspase-3 activation and DNA fragmentation following transient focal ischemia in the rat[J].Neuroscience,2002,115(1):125
[13]Hostettler ME,Knapp PE,Carlson SL.Platelet activating factor induces cell death in cultured astrocytes and oligodendrocytes:involvement of Caspase-3[J].Glia,2002,38(3):228
[14]Tiyyagura SR,Pinney SP.Left ventricular remodeling after myocardial infarction:past,present and future[J].Mt Sinai J Med,2006,73(6):840
[15]徐倩,张艳军,刘洋,等.银杏内酯B 作用于星形胶质细胞对神经干细胞趋化影响的体外研究[J].天津中医药,2010,27(5):421
[16]Obrenovitch TP.Molecular physiology of preconditioninginduced brain tolerance to ischemia[J].Physiol Rev,2008,88(1):211
[17]Storkebam E,Larnbrechts D,Carmeliet P.VEGF:once regarded as a specific angiogenic factor,now implicated in neuropfotection[J].Bioessays,2004,26(9):943
[18]Namiecinska M,Marciniak K,Nowak JZ.VEGF as an angiogenic,neurotrophic,and neuroprotective factor[J].Postepy Hig Med Dosw,2005,59:573

