三亚岩相潮间带底栖海藻群落结构及其季节变化
陈自强,寿 鹿,廖一波,高爱根,曾江宁,陈全震
(国家海洋局海洋生态系统与生物地球化学重点实验室,国家海洋局第二海洋研究所,杭州 310012)
潮间带是海洋生态系统的重要栖息地类型,位于海陆过渡地带,能支撑很高的海洋生物多样性[1]。大型底栖海藻作为潮间带生态系统的重要组成部分,是岩相潮间带生态系统重要的物质基础,其种类组成直接影响着底栖生物群落的初级生产力,在近岸碳循环中起着重要作用[2-4]。国内外对于潮间带底栖海藻的生态学研究早期主要集中于藻类群落的区系划分、种类组成、分布特征等基础研究方面[5-6]。近年来,潮间带底栖藻类的研究向藻类生理生态、共生机制等更加微观的方向发展,并开始关注藻类群落内部的营养结构、与其它共生群落的相互影响以及在整个潮间带食物网中的作用[7-9]。
然而,由于调查取样的困难以及分类学的局限,我国南海区的基础资料陈旧,系统深入的研究仅见于中国科学院海洋所和南海所于20世纪60年代初和80年代所做的工作[10-11]。随着近20年来海岸开发、旅游业的发展以及当地人口的快速增长,三亚潮间带生态环境受到了人类活动的深刻影响[12-14],先前的资料已不能反映目前底栖海藻群落的实际情况。另外,水温和光照等季节相关的因素是影响大型海藻分布的主要影响因子之一[2],三亚地处热带,常年水温高、光照强,四季差异不大,所以相比温带海区,热带海区海藻群落的季节变化经常被忽略[15]。因此,本文通过对三亚岩相潮间带大型底栖海藻的调查,试图查明:(1)近年来三亚潮间带大型海藻的分布特征;(2)海藻群落是否存在明显的季节变化;(3)此区域大型海藻与我国其它海区在温度性质上的差异。旨在为我国南海南区大型藻类的多样性研究提供基础资料,为三亚潮间带藻类资源的保护以及合理利用提供依据。
1 材料与方法
1.1 研究区域概况
三亚地区地处大陆型岛屿海南岛的最南端,位于北纬 18°09′34″—18°37′27″,东经 108°56′30″—109°48′28″,邻近海域的地理气候和环境条件具有典型的热带海洋特征。潮汐为非正规全日潮,年均潮差小于1 m[16],潮间带以岩礁、珊瑚礁、石沼等岩相底质类型为主,底栖海藻资源丰富。
1.2 采样方法
根据底质类型,在三亚沿海设置6条岩相潮间带断面(图1)进行4季野外调查。其中,S1、S2断面分别位于亚龙湾东西两侧,S3位于榆林港湾口内部,S4位于鹿回头附近,S5、6分别位于天涯海角和南山寺附近开敞海区,6条断面均避开游人活动区域,受人为破坏相对较小。另外,6条断面中湾口和湾顶,遮蔽型和开敞型海岸均有涉及,以求更全面地反映出三亚潮间带的综合环境特征。采样分别于2008年1月、4月、8月和11月的大潮日进行,使用GPS定位断面位置,每条断面分高、中、低潮带进行采集。定量样品在每个潮带随机选取3—4个25 cm×25 cm样方。样方内海藻使用铲刀从附着根部刮下,清除附着沙石后装入塑封袋避光保存并做好标号。同时在各断面附近分潮带广泛采集定性样品,一并带回实验室进行分析鉴定。样品称重、计算和资料整理均按《海洋调查规范》[17]进行。
1.3 数据处理
采用优势度指数Y确定大型海藻群落生物量优势种类[18]:
使用以下3个多样性指数来表征大型海藻群落的多样性[19]:

式中,ni为种i在各断面的生物量总和;N为所有种的生物量总和;fi为种i在各断面的出现频率;S为采集生物的总种类数;Pi为第i种的生物的生物量占总生物量的比例。
采样断面图使用ArcGIS 9.3绘制。在SPSS13.0软件中采用Kolmogorov-Smirnov检验和Levene检验分别对数据进行正态性和方差齐性假设检验。如果数据同时满足正态性和方差齐性假设,则对4季生物量以及多样性指数值进行单因素方差分析(One-Way ANOVA),并进行Tukey′s post-hoc多重比较以检验季节间的生物量与多样性差异,显著性水平α=0.05。
聚类分析(CLUSTER)等多元统计分析方法比多样性指数更能灵敏地反应群落结构的变化[20]。方法如下:首先为降低生物量上占优势的个别物种对群落结构影响的权重,对原始生物量数据进行四次方根转换,而后建立不同物种的个体生物量在不同断面间的数据矩阵,并基于Bray-Curtis相似性指数构建各断面间的相似性矩阵,最后采用组平均法构建群落聚类图[21],群落的多元分析使用PRIMER 6.0软件包。另外,为便于分析群落结构,本文规定若断面间相似度>40%,可认为其较为相似。
种类的温度性质划分主要依据分类学文献和现有资料[22-25],并参考项斯端和阮积惠[5]的划分方法。

图1 三亚岩相潮间带大型海藻采样断面图Fig.1 Sampling sections for intertidal benthic macroalgae in Sanya
2 结果
2.1 种类组成的分布特征和季节变化
综合定量和定性数据,三亚岩相潮间带共鉴定出大型底栖藻类130种,其中红藻门41属67种(占总物种数的51.54%),是三亚岩相潮间带底栖海藻的主要构成成分,褐藻门16属31种(占23.85%)、绿藻门15属29种(占22.31%)、蓝藻门3属3种(占2.31%)。名录详见附录1。
从水平分布来看,各断面底栖海藻的四季平均物种数排序为S1>S6>S5>S3>S4>S2,物种数最多的S1断面平均有(21±7)种分布,而物种数最少的S2断面仅(7±2)种(图2)。其中,S1断面常见的种有日本仙菜Ceramium japonicum、海柏 Polyopes polyideoides、波利团扇藻 Padina boryana、砺菜 Ulva conglobata等,S2、S3 断面主要有波状软凹藻Chondrophycus undulates和宽扁叉节藻Amphiroa dilatata等,S4断面主要有喇叭藻Turbinaria ornata、石花菜 Gelidium amansii等,S5、S6断面以褐藻门海藻居多,如冠叶马尾藻 Sargassum cristaefolium、瓦氏马尾藻Sargassum vachellianum和波利团扇藻等。不同季节物种数的水平分布有所不同:春季种类数的最高值出现在S3断面(17种),最低值出现在S5断面(2种);夏季S1断面的物种数最高(24种),而S4断面最低(6种);秋季S1断面的物种数继续增加至29种,仍为6条断面中物种最丰富者,其它5条断面差别不大;冬季S5、S6断面的物种数达到峰值,分别为25种和30种,而S2、S3、S4断面的物种数最少,分别为6种、8种和6种。
从垂直分布来看,在调查区域的大部分断面中,低潮带种类数最多,主要有石花菜、日本仙菜、宽扁叉节藻和多种马尾藻属藻类。中潮带的物种相对较少,包括砺菜、礁膜 Monostroma nitidum、苔状鸭毛藻Symphyocladia marchantioides、大团扇藻Padina crassa等,而高潮带几乎没有藻类分布(仅在秋季S1断面出现了少量苔垢菜Calothrix crustacea,图2中省略)。中潮带与低潮带有共同物种分布,这种现象在夏季最为普遍,各条断面均有出现。

图2 三亚岩相潮间带底栖海藻物种数的四季水平分布Fig.2 The number of benthic algae species in different sampling sections of four seasons
底栖海藻物种数季节变化呈现夏、秋、冬3季多于春季的特征 (图3),秋季(60种)>冬季(58种)>夏季(54种)>春季(37种),且秋、冬、夏3季差异不大。红藻门种类数4季均占优势,春季出现最少(15种);其次为褐藻门,春夏秋3季均占据次席。除红藻门外,各门类种类数无明显季节变化。
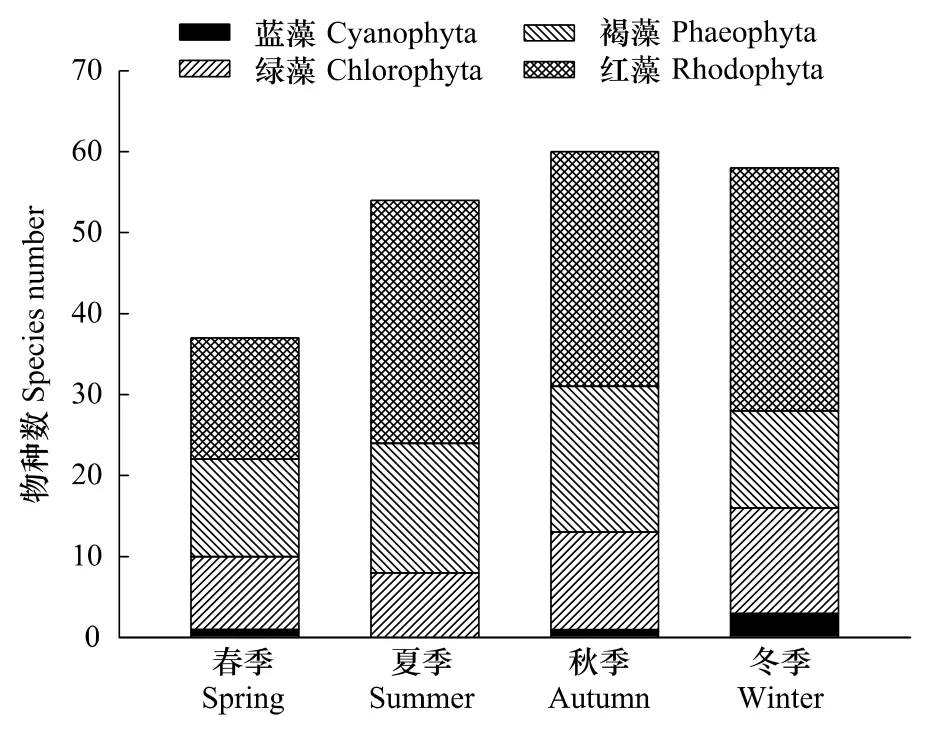
图3 三亚岩相潮间带不同类群底栖海藻的季节分布Fig.3 Seasonal distribution of benthic algae for different phyla in Sanya
2.2 种类的温度性质
由表1可见,三亚岩相潮间带大型底栖海藻区系全年以暖水性热带-亚热带种为主(占总种类的58.7%),其次为温水性种类(占总种类的41.3%)。
分季节来看,暖水性种类在夏秋两季分别占总物种数的60.4%和66.6%,温水种类比例相对较低;相比之下,暖水性种类在春冬两季出现的比例稍低为54.5%和49.1%。一些适温较低的温水种类,如刺松藻Codium fragile、节荚藻 Lomentaria hakodatensis、金膜藻Chrysymenia wrightii、扁江蓠Gracilaria textorii等仅在冬季出现。
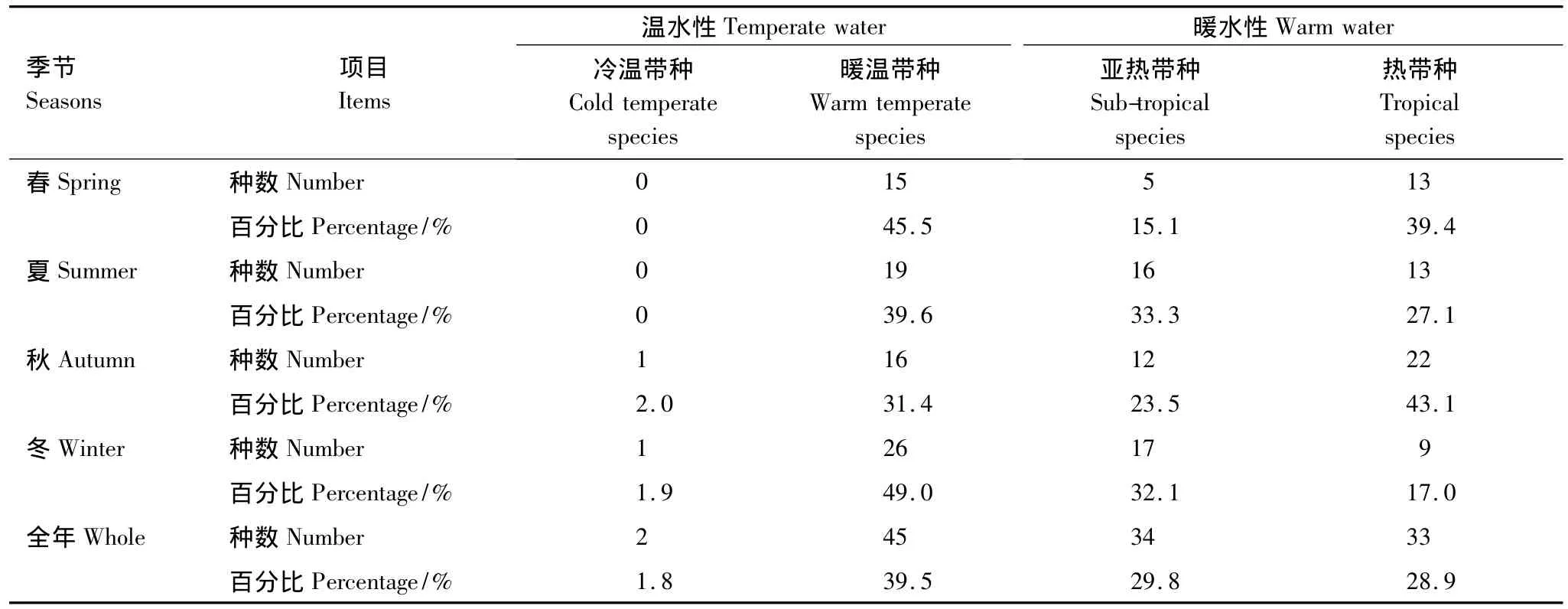
表1 三亚底栖海藻种类的温度性质Table 1 Temperature features of benthic algae in Sanya

图4 三亚岩相潮间带底栖海藻生物量分布(mean±SD)Fig.4 Distribution of benthic algae biomass in Sanya
2.3 生物量的分布特征和季节变化
不同季节三亚岩相潮间带大型底栖海藻生物量分布情况见图4(S4断面因海况不佳,缺秋冬季定量样品)。从平面分布来看,各断面大型海藻的4季平均生物量排序为:S6>S1>S2>S5>S3>S4,S6 断面平均生物量达 (762.62±507.86)g/m2,而生物量最低的S4断面,仅为(69.66±27.58)g/m2。从不同季节来看,4季的平均生物量有所不同,整个采样区域4个季节的平均生物量排序为:冬季>夏季>秋季>春季。其中,春秋两季平均生物量分别为(289.91±264.96)g/m2和(298.19±193.62)g/m2,而夏冬两季分别为(502.58±312.56)g/m2和(632.78±513.03)g/m2,约为春秋两季的两倍,但统计结果显示4季的生物量并无显著差异(P=0.392,F=1.056)。
2.4 优势种组成与季节变化
三亚岩相潮间带大型海藻群落优势种季节分布如表2所示。4季群落优势种(Y≥0.02)由红藻门和褐藻门物种组成。春、夏季各4种,分别占总生物量的73.10%和74.42%;秋季3种,占62.10%;冬季5种,占59.30%。其中波利团扇藻与日本仙菜是春冬两季共有优势种,波状软凹藻与冠叶马尾藻是夏秋两季共有优势种,而春夏与秋冬并无共同优势种。由4季群落优势种的温度性质表明,热带-亚热带性暖水种比例最大,优势度较高,且4季均有分布。
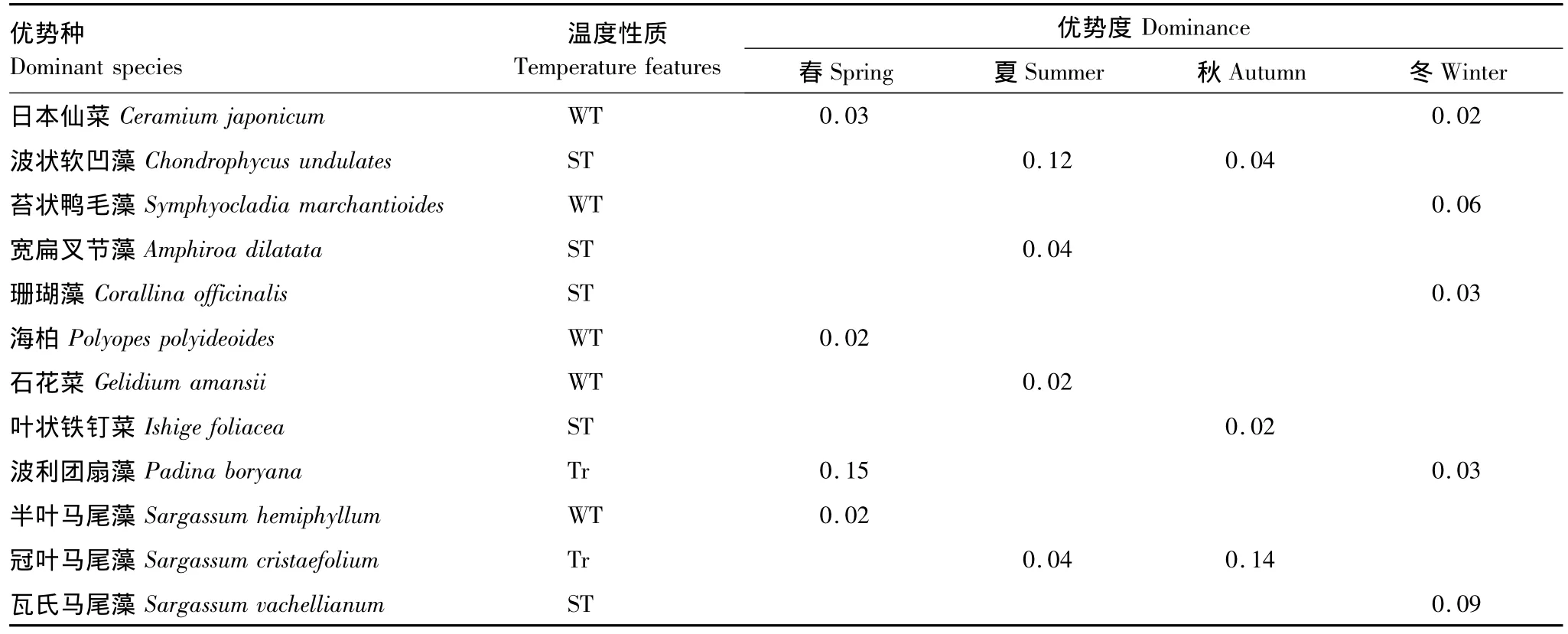
表2 三亚潮间带底栖海藻优势种四季分布及优势度Table 2 Dominant species of benthic algae and its dominance in four seasons
2.5 物种多样性指数
如表3所示,Shannon-Wiener物种多样性指数均值的季节排序:冬季(2.02±0.38)>秋季(1.43±0.75)>春季(1.40±0.43)>夏季(1.13±0.65),但4个季节间无显著差异 (P=0.166,F=1.901)。
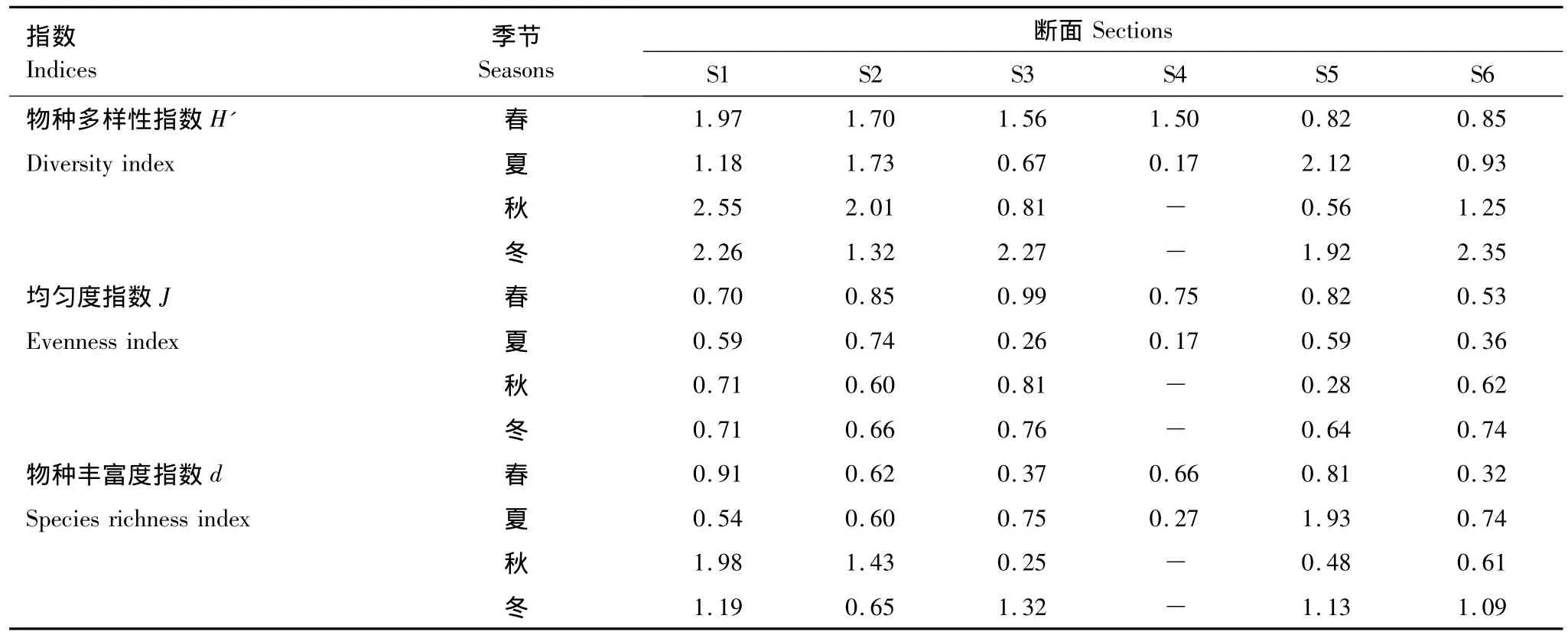
表3 三亚岩相潮间带各断面大型底栖藻类群落物种多样性指数Table 3 Biodiversity indices of benthic algae among 6 sections in Sanya
Pielou均匀度指数均值的季节排序:春季(0.77±0.14)>冬季(0.70±0.05)>秋季(0.61±0.18)>夏季(0.46±0.20),4个季节间差异显著,夏季明显低于春冬两季(P<0.05,F=3.812,Tukey′s test)。
Margalef物种丰富度指数的季节排序:冬季(1.07±0.23)>秋季(0.95±0.65)>夏季(0.80±0.53)>春季(0.61±0.21),但4个季节间无显著差异(P=0.458,F=0.906)。
2.6 大型藻类群落结构和多元数据分析
聚类分析结果显示,底栖海藻群落结构4个季差异较大:在相似度40%的水平上,春季,位于亚龙湾东西两岸的断面S1与S2相似性较高,均有较多波利团扇藻与砺菜出现;夏季,断面S2与S3相似度较高,波状软凹藻在两个断面均有大量分布;秋季各断面相似度较低,均小于40%;冬季相似度较高的断面为S5与S6,对相似性贡献较大的种有瓦氏马尾藻和苔状鸭毛藻等。
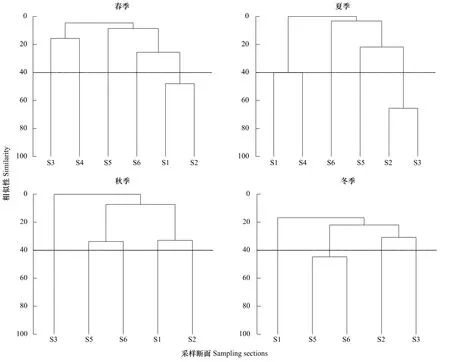
图5 三亚岩相潮间带底栖藻类聚类分析结果Fig.5 The results of CLUSTER in benthic algae community among the 6 stations in Sanya
3 讨论
3.1 种类组成与区系的温度性质
本次调查发现,三亚大型底栖海藻群落主要由红藻类群构成,物种数最为丰富,其次是褐藻、绿藻和蓝藻。这与之前的调查基本一致[11,15]。
从温度性质来看,三亚岩相潮间带大型底栖海藻区系与我国黄、渤海区以及浙江沿海有明显差异,而与广东沿海较为相近[5,24,26]。本次调查发现,尽管三亚位于海南岛最南端,而三亚潮间带海藻中热带种并没有出现张水浸研究中的高比例[27],在58.7%的暖水种中,亚热带性和热带性的种类分布平均,本文与丁兰平[24]、刘瑞玉[25]等的区系划分稍有区别,更倾向于将三亚附近海区海藻归为亚热带向热带过渡的区系。该海域是我国一些暖温带种的南限,又成为一些热带种的北限,形成了我国海藻南海南区独特的物种分布现象。
从季节分布来看,大型底栖藻类物种数季节性变化不很明显,但种类组成存在一定的季节差异。一些暖温带性种类仅在温度相对较低的冬季出现,说明尽管三亚附近水温季节变化不大,但冬季的水温已经是一些温带种的适温上限,这些种类难以在温度稍高的其它3季生存。另外,季节性的水温、光强变化可引起大型藻类在垂直分布上的迁移。尤其在夏季,由于水温升高、光照强烈,部分常见于中低潮带的海藻如角叉菜Choudrus ocellatus等喜阴的藻类会转移到潮下带生长。
从垂直分布来看,三亚地区气温高、光照强烈,长期暴露在空气中的高潮带几乎没有藻类生长,从中潮带开始,一些典型的潮间带海藻开始出现,低潮带物种则更为丰富。另外,由于三亚附近海域潮差小,加之部分断面坡度较缓,导致不同潮区的垂直界限相对模糊,一些延伸种从其占优的潮带延伸到其他潮带[2]。三亚岩相潮间带的延伸种多出现在中潮带下部和低潮带上部,主要为波状软凹藻、冠叶马尾藻、波利团扇藻等,这些藻类原本生长在低潮线附近[22-23],本次调查发现在中潮带下部也有分布。
与该地区历史数据比较,大型海藻种类数量并无明确增多或减少。1984年海南岛全岛沿海底栖海藻调查时,岩礁海岸记录135种[11],与本次调查相差无多。而同期另一项针对三亚海藻的调查中[28],由于采样区域小(调查区域位于大小东海、鹿回头、天涯海角三亚港附近),仅记录53种,远少于本次调查发现的物种数。总的来说,现有对海南岛大型底栖海藻的调查研究很少,针对三亚沿海的调查就更少,而且三亚位于海南岛最南端,大型藻类种类分布最广泛,丰富程度最高,分类学研究也最困难。基础数据缺乏,很难对长时间尺度上大型海藻群落的变化做出明确的结论。
3.2 生物量分布以及群落结构特征
三亚潮间带大型底栖海藻的生物量呈现出春秋两季低、夏冬两季高的趋势。群落中的优势种对生物量贡献很大,其季节变化的特点为:四季差异较大,没有四季共同优势种出现,2个季节的共同优势种有4种,但其优势度在不同季节存在差异。如波状软凹藻是夏季第一优势种,秋季其优势地位则被冠叶马尾藻取代,成为第二优势种。波利团扇藻冬季优势度并不高(0.03),春季却成为第一优势种。说明随季节变化,它们在群落中的功能地位发生变化。造成这种变化的主要原因是:由于适温性不同,一些热带和暖温带优势种分别在不同季节进入生长盛期。例如:苔状鸭毛藻是典型的暖温带性种类,其在山东沿海6—7月进入生长盛期[22],但在三亚冬季水温较低时大量繁殖,生物量最高,成为冬季的优势种。冠叶马尾藻属热带种类,每年3—4月开始长出幼芽,6—7月进入生长盛期,随后大量繁殖[22],在夏秋两季形成优势种,而后逐渐衰退,群落中的优势地位由其它藻类替代。瓦氏马尾藻在浙江沿海4—6月进入生长盛期[22],但在三亚,1月时生物量已经很高,并能延续到春夏两季。
从平面分布来看,海藻生物量和聚类分析结果与断面所处经度并无明显关系,而与断面受风浪大小、岩相底质类型以及人为活动影响关系密切。因为这些因素往往决定了该断面适宜生长的海藻种类,对大型海藻群落结构也会产生影响。例如在冬季,S5、S6断面群落的相似度较高,很可能是因为两断面位于三亚湾西部,同属于开敞型海区,受秋冬盛行的东北季风影响较大,适合个体粗大、喜风浪的马尾藻属海藻生长,如冠叶马尾藻和瓦氏马尾藻等。由于马尾藻属海藻通常在单位面积内具有较高的生物量,所以这也使S6断面冬季生物量明显高于其他断面。另外,S6断面潮间带主要由大块岩礁构成,且距岸较远,人为活动少,也是其生物量高的原因之一。相反地,亚龙湾东岸内侧的S2断面以及位于榆林港内部的S3断面受风浪影响相对最小,均适合一些喜静水藻类生长,所以S2、S3断面在西南季风盛行的夏季相似性较高。鹿回头S4断面平均生物量最小,这主要与人为活动有关。由于鹿回头中低潮带杂色蛤、团聚牡蛎等经济贝类附着较多,人为采捕现象普遍,某种程度上破坏了藻类的生长环境,导致鹿回头潮间带大型海藻生物量偏低。
3.3 多样性指数
从多样性指数的平均值上看,冬季的Shannon物种多样性和Margalef物种丰富度指数最高,这是因为,冬季三亚附近海区表层水温介于亚热带种与热带种的最适温区之间[29],是温带种的适温上限,很多热带种和温带种共同出现。而Shannon多样性和Pielou均匀度指数的最低值出现在夏季,这是因为,夏季水温相对较高,不适宜一些温带种的生长,另外,夏季优势度大于0.02的优势种生物量占总生物量的74.42%,影响了其它藻类的生长。
与浙江附近海区岩相潮间带相比[30],三亚潮间带物种多样性指数相对偏低,而总物种数却远远高出。除了两地的温度差异外,也与两地不同的底质环境有关:海南岛岩相潮间带大型海藻多数呈斑块化、镶嵌状分布[11],而且热带地区大型海藻藻株分布面积大,通常一块礁石上仅附着一种或几种藻类,造成有限的样方内种类相对单一,难以囊括该断面所有大型海藻种类,导致三亚潮间带多样性指数相较其他海区偏低。而物种数中包含了断面附近广泛采集的定性样本,物种数的丰富程度上远高于浙江附近海区,这与现有资料一致[24]。
致谢:胡锡钢、赵永强、江志兵等采集样本,孙建璋、胡月妹等协助鉴定部分样品,特此致谢。
Reference:
[1] Shou L,Gao A G,Zeng J N,Chen Q Z,Liao Y B,Xu X Q.The influence of the sediment environment on distribution of macrobenthos of the intertidal zone in Qushan Island.Chinese Journal of Zoology,2007,42(3):79-83.
[2] Zhang S Y,Liang J,Wang Z H,Wang K.Distribution characteristics of benthic algae in intertidal zone of Ma′an Archipelago of Zhejiang Province.Chinese Journal of Applied Ecology,2008,19(10):2299-2307.
[3] Zou D H,Gao K S.Effects of elevated CO2concentration on the photosynthesis and related physiological processes in marine macroalgae.Acta Ecologica Sinica,2002,22(10):1750-1757.
[4] Bruno F J,Boyer E K,Duffy J E,Lee C S,Kertesz S J.Effects of macroalgal species identity and richness on primary production in benthic Marine communities.Ecology Letters,2005,8(11):1165-1174.
[5] Xiang S D,Ruan J H.Checklist and the floral analysis of benthic seaweeds in Zhejiang Province.Journal of Zhejiang University(Science Edition),2002,29(5):548-557.
[6] Sun J Z,Ning X R,Le F F,Chen W D,Zhuang D G.Long term changes of biodiversity of benthic macroalgae in the intertidal zone of the Nanji Islands.Acta Ecologica Sinica,2010,30(2):106-112.
[7] Gaudêncio M J,Cabral H N.Trophic structure of macrobenthos in the Tagus estuary and adjacent coastal shelf.Hydrobiologia,2007,587(1):241-251.
[8] Diaz-Pulido G,Harii S,Mccook L J,Hoegh-Guldberg O.The impact of benthic algae on the settlement of a reef-building coral.Coral Reefs,2010,29(1):203-208.
[9] Sokołowskia A,Wołowicza M,Asmusb H,Asmusb R,Carlierc A,Gasiunaitéd Z,Grémaree A,Hummelf H,Lesutienéd J,Razinkovasd A,Renaudg P E,Richardh P,Kędrai M.Is benthic food web structure related to diversity of Marine macrobenthic communities?Estuarine,Coastal and Shelf Science,2012,108:76-86.
[10] Yang Z D.Primary studies on community ecology of benthic algae in Hainan Island.Studia Marina Sinica,1978(14):129-137.
[11] Jiang F K,Wu J F.Benthic algae of littoral zone in Hainan Island.Nanhai Studia Marina Sinica,1992(10):231-236.
[12] Mao L J,Zhang Y Z,Zhang Z K,Wei L,Ji X M,Zhu D K.Characteristics of sedimentary environments in Sanya bay of Hainan Island.Marine Geology& Quaternary Geology,2007,27(4):17-22.
[13] deBoer F W,Prins H T.Human exploitation and benthic community structure on a tropical intertidal flat.Journal of Sea Research,2002,48(16):225-240.
[14] Huang L M,Tan Y H,Song X Y,Huang X P,Wang H K,Si Z,Dong J D,Chen R Y.The status of the ecological environment and a proposed protection strategy in Sanya Bay,Hainan Island,China.Marine Pollution Bulletin,2003,47(1/6):180–186.
[15] Wang G Y,Wu H L,Yao X M,Feng Y Q,Wen Z,Xie G L,Peng H.Common bottom perch seaweed in Hainan Island.Journal of South China University of Tropical Agriculture,2010,1(2):175-182.
[16] Wang Y,Shen J W,Long J P.Ecological-sedimentary zonations and carbonate deposition,Xiaodonghai Reef Flat,Sanya,Hainan Island,China.Science China Earth Science,2011,41(3):362-374.
[17] Standardization Administration of the People′s Republic of China.GB/T 12763.6—2007.Specifications for oceanographic survey--Part 6:Marine biological survey.Beijing:China Standards Press.2007.
[18] Zhao Y J,Chen Q Z,Zeng J N,Shou L,Gao A G,Liao Y B.Distribution characteristics of intertidal zone macrozoobenthos in autumn and winter in Chemical Industrial Park and adjacent area,Jiaojiang Estuary.Acta Ecologica Sinica,2009,29(3):1578-1586.
[19] Sun J,Liu D Y.The application of diversity indices in Marine phytoplankton studies.Acta Oceanologica Sinica,2004,26(1):62-75.
[20] Zhou G,Zhang Z N.Rationale of the multivariate statistical software PRIMER and its application in benthic community ecology.Periodical of Ocean University of China,2003,33(1):58-64.
[21] Yang Q L,Lin G M.A multivariate analysis of variability of phytoplankton distribution in Xiamen seas during summer bloom period.Acta Ecologica Sinica,2007,27(2):465-476.
[22] Sun J Z.Anthology Research on Shellfish and Algae.Beijing:Marine Press,2006.
[23] Xia B M.Flora Algarum Marinarum Sinicarum,Tomus ii Rhodophyta.Beijing:Science Press,2004.
[24] Ding L P,Huang B X,Xie Y J.Advances and problems with the study of Marine macroalgae of China seas.Biodiversity Science,2011,19(6):798-804.
[25] Liu R Y.Checklist of Marine Biota of China Seas.Beijing:Science Press,2008.
[26] Zhao S F,Sun H J,Yuan Z J,Yang K.Resources of benthic algae from intertidal zone on Naozhou Island in spring.Journal of Shanghai Fisheries University,2006,15(3):322-327.
[27] Zhang S J.The species and distribution of seaweeds in the coast of China seas.Biodiversity Science,1996,4(3):139-144.
[28] Zhu H X,Li W X,Ding Z F.Resource investigation on macroalgae in Sanya,Hainan.Journal of Zhanjiang Ocean University,1989,9(1/2):116-120.
[29] Li W X,Zhu Z J,Liu F X.Phycology Introduction.Shanghai:Shanghai scientific& Technical Publishers,1982,232-235.
[30] Peng X,Xie Q L,Li S L,Chen S B,Qiu J B,Zhou Z M.Study on spatiotemporal distribution of intertidal benthic macro-algae and their diversity in southern Zhejiang Province.Journal of Tropical Oceanography,2010,29(3):135-140.
[1] 寿鹿,高爱根,曾江宁,陈全振,廖一波,徐晓群.底质环境对浙江衢山岛潮间带大型底栖动物分布的影响.动物学杂志,2007,42(3):79-83.
[2] 章守宇,梁君,汪振华,王凯.浙江马鞍列岛海域潮间带底栖海藻分布特征.应用生态学报,2008,19(10):2299-2307.
[3] 邹定辉,高坤山.高CO2浓度对大型海藻光合作用及有关过程的影响.生态学报,2002,22(10):1750-1757.
[5] 项斯端,阮积惠.浙江底栖海藻及其区系分析.浙江大学学报(理学版),2002,29(5):548-557.
[10] 杨宗岱.海南岛潮间带底栖海藻群落生态的初步研究.海洋科学集刊,1978(14):129-137.
[11] 蒋复康,吴进锋.海南岛沿海的底栖海藻.南海海洋科学集刊,1992(10):231-236.
[12] 毛龙江,张永战,张振克,魏灵,季小梅,朱大奎.海南岛三亚湾现代沉积环境.海洋地质与第四纪地质,2007,27(4):17-22.
[15] 王红勇,吴洪流,姚雪梅,冯永勤,文珍,谢桂连,彭惠.海南岛常见的大型底栖海藻.热带生物学报,2010,1(2):175-182.
[16] 王月,沈建伟,龙江平.海南岛三亚小东海珊瑚礁坪生态沉积分带和碳酸盐沉积作用.中国科学:地球科学,2011,41(3):362-374.
[17] 中国国家标准化管理委员会.GB/T 12763.6—2007.海洋调查规范——第6部分:海洋生物调查.北京:中国标准出版社,2007.
[18] 赵永强,陈全震,曾江宁,寿鹿,高爱根,廖一波.椒江口化工园区及其邻近区域潮间带大型底栖动物秋冬季分布特征.生态学报,2009,29(3):1578-1586.
[19] 孙军,刘东艳.多样性指数在海洋浮游植物研究中的应用.海洋学报,2004,26(1):62-75.
[20] 周红,张志南.大型多元统计软件PRIMER的方法原理及其在底栖群落生态学中的应用.中国海洋大学学报,2003,33(1):58-64.
[21] 杨清良,林更铭.厦门海域浮游植物夏季赤潮期间分布变异的多元分析.生态学报,2007,27(2):465-476.
[22] 孙建璋.孙建璋贝藻类文选.北京:海洋出版社,2006.
[23] 夏邦美.中国海藻志第二卷第三册红藻门.北京:科学出版社,2004.
[24] 丁兰平,黄冰心,谢艳齐.中国大型海藻的研究现状及其存在的问题.生物多样性,2011,19(6):798-804.
[25] 刘瑞玉.中国海洋生物名录.北京:科学出版社,2008.
[26] 赵素芬,孙会强,袁振江,杨琨.硇洲岛春季底栖海藻资源.上海水产大学学报,2006,15(3):322-327.
[27] 张水浸.中国沿海海藻的种类与分布.生物多样性,1996,4(3):139-144.
[28] 朱华贤,李伟新,丁镇芬.海南省三亚海藻资源调查.湛江海洋大学学报,1989,9(1/2):116-120.
[29] 李伟新,朱仲嘉,刘凤贤.海藻学概论.上海:上海科学技术出版社,1982,232-235.
[30] 彭欣,谢起浪,李尚鲁,陈少波,仇建标,周志明.浙南潮间带大型底栖藻类时空分布及多样性研究.热带海洋学报,2010,29(3):135-140.

