微囊藻毒素对陆生植物的污染途径及累积研究进展
靳红梅,常志州
(江苏省农业科学院农业资源与环境研究所,江苏省农业废弃物资源化工程技术中心,南京 210014)
微囊藻毒素(Microcystins,MCs)是水体中某些蓝藻(Cyanobacteria),特别是微囊藻(Microcystis)分泌产生的一类具有生物活性的环状七肽物质,是一种具有强烈致癌作用的肝毒素[1]。近年来,富营养化导致各水体中蓝藻水华的发生频率及严重程度都呈现增长的趋势[2],堆积的藻类细胞衰亡后会释放出大量的蓝藻毒素及其他有毒有害物质[3-5]。MCs是目前已经发现的污染范围最广、研究最多的一类蓝藻毒素[6],在其分子生物学[7]、环境归趋[4,8-10]、在水生生物中的富集[11-14]等方面已取得了进展,其多种特性已被揭示,也使得人们对其特点和危害有了更加深入的了解[15]。
藻细胞释放的MCs不仅对直接接触的水生生物造成严重的危害,而且会随着水圈与土壤圈和生物圈之间的物质交换进入陆生植物体内[16-17],进而通过食物链严重威胁到人类健康[15,18-20]。近些年,MCs对陆生植物的毒害和累积研究受到越来越多的关注,取得了一批重要的研究成果。我国是世界上蓝藻水华暴发最严重、分布最广、毒素种类最多的国家之一[21]。在已发现的80多种MCs异构体中[22],MC-LR(L为亮氨酸)和MC-RR(R为精氨酸)是淡水水体中普遍存在且危害较大的两种MCs[4](图1)。因此,本文重点介绍这两种类型的MCs进入陆生植物体的途径、毒性作用及其在作物体内的富集。在使用污染水源灌溉或土壤种植作物条件下,对正确评估MCs的生物安全风险有重要意义。
1 MCs进入陆生植物体内的主要途径
土壤是联系水体和生物之间的重要纽带,水体中的MCs不可避免地通过多种途径进入土壤,因此,MCs在土壤中的环境行为直接影响了其在陆生植物中的迁移和累积。MCs进入土壤界面的主要途径有:(1)使用蓝藻水华污染的水源进行灌溉[23-24];(2)机械收集蓝藻后不合理的堆放及还田等资源化处理[25];(3)人工湿地进行富营养化修复和河岸沙滤水处理工艺及粘土滤床水处理工艺等[26-27];(4)洪涝灾害将含有蓝藻水华和毒素的水带入土壤界面[1]。其中,前两种途径最为常见,也是本文关注的重点。
天然水体中的MCs有3种主要的存在形态,即溶解态(游离态)、细胞结合态和吸附态[1,18]。蓝藻分泌的大部分MCs易溶于水[28],但在藻类生长周期里的大部分时间,细胞结合态的MCs在水体中占绝大部分[29]。通过机械方法收集水面漂浮的水华以减轻污染日趋成为富营养化湖泊整治的主要手段。将大量采集的蓝藻生物量进行资源化利用,特别是当作有机肥料直接还田时,势必造成细胞结合态的MCs在土壤中的释放、迁移,甚至造成地下水污染,进而进入作物体内[18]。自然水体中细胞结合态的MCs大量释放一般出现在蓝藻水华大量衰亡的季节,或水体中使用了杀藻剂后。已报道的自然水体中 MCs的含量一般为0—10 μg/L[4,30-31],多数水体中溶解态 MCs的含量不会超过 1 μg/L[1]。尽管如此,用富营养化水体进行灌溉仍然会导致其中痕量的溶解态MCs迁移到作物体内[16,23]。在地表水丰富的地区(如我国南方地区),引湖水或河水入田是常用的灌溉措施;而在干旱地区,抽取地下水或利用水库水是灌溉水的主要来源。一旦这些水源受到蓝藻水华污染,用其灌溉均可能导致溶解态的MCs在陆生植物体内的累积。

图1 微囊藻毒素通用的化学结构式[1]Fig.1 Chemical structure of microcystins[1]
1.1 地表水灌溉
在我国,作为地表水重要来源的湖泊已有85%出现了不同程度的富营养化现象[32],是蓝藻水华发生最严重的水体。江苏太湖、云南滇池和安徽巢湖都暴发过严重的蓝藻水华,其他省市各水体也都有不同程度的暴发[33]。2005年在太湖五里湖和梅梁湾检测的表层水最大胞外MCs浓度分别为2.71 μg/L和6.66 μg/L[4];2009年—2010年太湖梅梁湾水体(表层、中层和下层的混合样品)中MCs浓度最高为0.78 μg/L,最低为0.14 μg/L[34];滇池海东湾 MCs的浓度在0.05—0.89 μg/L 之间,马村湾在0.03—0.48 μg/L 之间[35];安徽巢湖水体中 MCs浓度可达 17.29 μg/L[36];淀山湖夏季湖水中 MCs的浓度在 0.4—1.5 μg/L 之间[37];鄱阳湖水体 MCs 浓度最高为 1.037 μg/L[38]。
近年来,我国各地的河流和沟塘中蓝藻污染也明显增加。例如,淮河流域MC-RR浓度最高可达17.73 μg/L[39];赣江水样MCs浓度为0.04—1.36 μg/L[40]。在原发性肝癌高发地区江苏海门等地的许多河水和沟塘中也检测出了大量的 MCs,最高为 1.558 μg/L 和 0.3 μg/L[41]。
国内很多水库中均有MCs被检出的报道[42-47]。福建山仔水库10月份蓝藻水华产生的MC-LR浓度最高为 11.43 μg/L[43];官厅水库水体中 MC-LR 的平均浓度为 0.794 μg/L[44],7 月份 MCs 的最高值为 20 μg/L[47];密云水库9月份MC-LR和MC-RR的浓度分别为41 ng/L和18 ng/L[45]。甚至在喀斯特高原的深水水库中,MC-RR含量也可达2.84 μg/L[46]。因此,用富营养化的地表水进行灌溉意味着MCs进入农作物的可能性增大。
1.2 地下水灌溉
MC-RR和MC-LR均属于移动性较强的有机化合物[25],湖泊和河流中的MCs可能通过淋溶进入地下水系统[48]。粘性颗粒越少的土壤中,MCs越易迁移[25]。尽管土壤对 MCs有一定的吸附[17]和降解[49]作用,但是Eynard等也报道了在藻类暴发季节,土壤未能有效降解湖水中的MCs,最终导致地下水污染[27]。地下水系统长期处于厌氧条件,缺乏电子受体、碳源[50],特别是缺乏分解MCs的微生物,因此该系统的MCs存在的时间(约100 d)[50]远高于其在地表水中的存在时间(约28 d)[51]。Mohamed等通过对阿西尔地区的10口地下水井的水进行取样测定后发现,MCs浓度为0.3—1.8 μg/L[16],大多数超过WHO制定的饮用水中MCs的指导值[52];用此浓度的水灌溉附近农田的6种蔬菜,在它们体内均检测出MCs,含量为0.07—1.2 μg/g(鲜重)。因此,通过淋溶作用进入地下水的MCs也可能通过灌溉而进入陆生植物体内,从而对人体健康造成威胁。
1.3 施用蓝藻肥料
由于蓝藻水华污染在全球范围内日趋严重,各国都加大了对富营养化湖泊的整治力度,其中尝试之一是通过机械方法收集水面漂浮的水华以减轻污染[1]。自2007年我国太湖蓝藻严重暴发后,各科研单位通过一系列的蓝藻治理研究及实践工作证明,打捞蓝藻作为终端控制途径有效降低了水污染灾害,是改善水质的一种有效手段。打捞后的蓝藻作为肥料还田是其主要的资源化利用途径,但这势必造成细胞结合态的MCs在土壤中的释放、迁移,进而进入植物体[1,18]。
藻类生长周期里的大部分时间,溶解态MCs的含量维持在较低的水平,即使在我国滇池富营养化污染十分严重的季节,水体中溶解态的MCs含量也基本在1 μg/L以下[35,53],但是细胞内的毒素则会高出几个数量级[31]。打捞会使藻类快速死亡,造成细胞破裂后MCs大量释放并表现出毒性[54]。尽管土壤对MCs有一定的吸附和降解能力,但并不稳定,会随着土壤条件(如机械组成、有机质含量、pH值、环境温度等)发生变化[25]。MC-LR和MC-RR属于移动性较强的有机化合物[25],直接施用蓝藻作为土壤肥料是不安全的,很可能引起地下水污染。此外,MCs在完全降解前仍要在土壤中滞留一段时间,这也将对暴露在该环境下的土壤微生物和植物生长产生威胁。
为高效、安全地实现打捞蓝藻的资源化利用,避免二次污染,江苏省农业科学院根据其特点,已设计出较为完善的蓝藻好氧堆肥化处理工艺。蓝藻腐熟后MCs的降解率可达90%以上,即MC-LR和MC-RR的残留量分别在30 μg/kg(干重)和15 μg/kg(干重)以下(本研究室研究结果,待发表)。虽然好氧堆肥对MCs的生物降解十分有效[55],但是农田施用量较大,蓝藻肥料中残留的MCs很可能会对作物生长和人类健康产生安全风险[56],而国内外对蓝藻肥料施用的生物安全及MCs作用阈值等问题的研究尚处于起步阶段。
2 微囊藻毒素对陆生植物生长的影响
自Kós等首次报道了蓝藻粗提物对陆生植物白芥(Sinapis alba)幼苗生长有抑制作用以来[57],越来越多的研究表明(表1),即使是微量的MCs也会对陆生植物的种子萌发[58-59]、个体生长[60-62]、形态、生理生化性质等[58,62-63]产生影响,主要表现在幼苗发生变形、重量减轻、侧根减少、叶片的光合作用率降低等方面[58,62-63],甚至会抑制植物根系与微生物共生体的形成[58]。
进一步研究发现,MCs能强烈抑制植物中蛋白磷酸酶1和2A(PP1,PP2A)的活性[61,64],影响营养物质的吸收、迁移及根韧皮部的功能,由此影响茎叶的生长[60-62],干扰茉莉酸信号转换[65],影响一些特殊酶的活性,如脱氧核糖核酸酶(DNase)[66]、尿黑酸叶绿醇转移酶(HPT)[67]等。受MCs胁迫的植物会产生氧化应激反应[68],如增加超氧化物歧化酶(SOD)[69-72]、过氧化物氧化酶(POD)、[71-72]、抗坏血酸过氧化物酶(APX)、过氧化氢酶(CAT)[69-70]、谷胱甘肽 S 转移酶(GST)[72-73]、谷胱甘肽过氧化酶(GSH-Px)[72-73]等酶活性,及增加生育酚的含量[67]。
3 微囊藻毒素在陆生植物中的累积
早期MCs对陆生植物的影响研究主要侧重于用植物来进行毒性评价[18],大多数试验中MCs的暴露浓度远远高于环境水平;而定量地报道植物组织中MCs累积量的研究开展得较晚,数量也不多[17]。现有研究主要针对的陆生植物为蔬菜,对粮食作物和牧草也进行了少量研究。前期的研究认为,MCs对成熟植株的影响较幼苗要小[17],因而目前国内外对MCs在陆生植物体内累积效应的研究多见于幼苗。
3.1 微囊藻毒素在陆生植物幼苗中的累积量
国外对MCs在幼苗体内累积的定量研究开展得较早,且大部分是在室内进行的短期试验(表2)。多数的研究表明,植物幼苗体内MCs的含量与其在MCs环境中的暴露时间和暴露浓度呈显著正相关关系[68,77],但不同植物对各类毒素(MC-LR和MC-RR)的响应浓度不同。例如,十字花科植物所分泌的异硫氰酸(脂),可减轻MCs对植物产生的毒害[58]。

表1 微囊藻毒素类型和浓度对陆生植物的作用Table 1 Effect of type and concentration of microcystins on terrestrial plants
Kurki-Helasmo和Meriluoto[60]通过固体培养基对白芥(Sinapis alba)幼苗进行了7 d暴露试验,结果发现:MC-RR浓度为0.5—1 μg/mL的条件下,幼苗株高低于对照,但是株型没有多少变化;在大于5 μg/mL时,幼苗出现畸形茎。MC-RR和MC-LR对白芥生长的半数抑制量(IC50)分别为0.8 μg/mL和2 μg/mL。Järvenpää等[17]用含有MCs的水灌溉西兰花(Brassica oleracea var.italica)和白芥(Sinapis alba)后发现,灌溉水中MCs的浓度为1 μg/L 和10 μg/L 时,灌溉19—20 d 后(最终 MCs总量为2.6 μg、26 μg 和2.3 μg、23 μg)仅在幼苗根部检测到了 MCs,分别为0.9—2.4 μg/kg(鲜重)和2.5—2.6 μg/kg(鲜重)。Peuthert等[78]通过对11 种大田作物幼苗的暴露试验发现,在MC-LR浓度为5 μg/L的条件下放置24 h,对MCs吸收量最大的作物为苜蓿(Medicago sativa),其根中MCs含量约为88 μg/kg(鲜重),茎中约为44 μg/kg(鲜重);吸收量最小的作物为红豆(Vigna radiate(L.)R.Wilcz.),根中约为 8 μg/kg(鲜重),茎中约为 4 μg/kg(鲜重)。Saqrane 等[56]通过温室砂培试验发现,禾本科作物小麦(Triticum durum)在MC-LR浓度为0.5—1.05 mg/L的条件下暴露30 d后,除根中检测到MC-LR外,茎和叶中均未检测到MC-LR含量,而玉米(Zea mays)幼苗的根、茎、叶中均可检测到MC-LR;豆类对MC-LR的吸收量较这两种禾本科作物大,豌豆(Pisum sativum)和兵豆(Lens esculenta)在MC-LR浓度为4.2 mg/L时,对MC-LR的吸收量是前两种禾本科作物的2—16.9倍。
近几年,国内关于MCs在植物幼苗体内的累积研究也逐渐增多。虽然不同植物对MCs的耐受浓度不同,但其幼苗体内MCs的累积规律基本与国外研究一致。Chen等[68]发现,水稻(Oryza sativa)幼苗对MC-LR的耐受浓度为0.12 mg/L,而油菜(Brassica napus)幼苗在此浓度下已经开始萎蔫。将二者暴露在滇池蓝藻粗提物(MC-LR浓度为3 mg/L)10 d后发现,其幼苗中MC-LR的最大含量分别为651 μg/kg和5.4 μg/kg。通过对苹果苗的组织培养发现,在MC-LR浓度超过0.3 mg/L时,苹果苗的生物量显著降低[77]。江苏省农业科学院对作物幼苗中MCs的积累量方面进行了一系列的研究。通过对牧草的研究发现,白三叶(Trioflium repens)幼苗[79]对MC-RR的耐受浓度为0.05 mg/L,而黑麦草(Lolium perenn)[80]幼苗对MC-LR的耐受浓度为4 mg/L。通过对蔬菜的研究发现,油菜(Brassica napus)幼苗对MC-RR的耐受浓度为5 mg/L[70],青菜(Brassica chinensis)幼苗对MC-LR的耐受浓度为0.8 mg/L[69];而小白菜(Brassica rapa)和番茄(Solanum lycopersicum)对MC-LR的耐受浓度为0.5 mg/L,超过此浓度二者的种子发芽率显著降低,幼苗的苗高和根长均受到显著抑制[81]。
3.2 微囊藻毒素在陆生作物成株中的累积量
除了实验室条件下对植物幼苗进行暴露试验,自然条件下MCs在作物中的累积作用及其安全正受到越来越多的关注[76]。但该领域的研究开展得较晚,国外主要集中在使用含有藻类或痕量溶解态MCs的富营养化水源灌溉作物这方面,而国内目前仅见于耿志明等关于MCs在番茄(Solanum lycopersicum)中的积累研究[81](表2)。
1999年,Codd等首次报道了用含有Microcystis aeruginosa(MC-LR含量为3.23 mg/kg(干重))的水灌溉生菜(Lactuca sativa),收获后测定叶片基部MC-LR含量为0.094 mg/kg(干重),叶片末梢为0.883 mg/kg(干重),叶片中部为2.487 mg/kg(干重)[24]。但此后,鲜有MCs在陆生植物成株中累积的相关报道。直到2008年,Crush等用富营养化湖水(MCs总浓度约为1.6 mg/L)灌溉油菜(Brassica napa cv Winfred)、黑麦草(Lolium perenne cv Grasslands Samson)和白三叶(Trifolium repens cv Grasslands KopuⅡ)等作物后发现,其地上部MCs的累积量达到0.20—0.79 mg/kg(干重),根部达到0.12—1.45 mg/kg(干重)。随后,Mohamed等[16]报道了用MCs浓度(为0.3—1.8 μg/L)更低的井水灌溉6种蔬菜,结果发现蔬菜体内MCs含量与灌溉水中MCs的含量呈极显著正相关关系。尽管使用此类井水灌溉不会对作物生长产生明显影响,但是收获后作物体可食用部分的MCs含量达0.05—1.2 μg/g(鲜重)[16]。如果按每人每天食用量为0.5 kg(鲜重)计算,则每人一天可摄入的MCs为25—600 μg,远高于 WHO[52]及我国[82]推荐饮水中 MCs的上限标准值,对人类健康安全带来风险。
除了用污染的水源灌溉农田外,机械收集后的蓝藻当作有机肥料还田是造成胞内结合态的MCs在作物中累积的一个重要途径,但蓝藻肥料是否会对人类健康产生真正的威胁尚无确切的答案。围绕这一问题,本研究室开展了一系列的蔬菜砂培和土培试验,以研究蓝藻肥料的生物安全及MCs的作用阈值等问题。初步的研究表明,进入土壤的MCs含量可能因为生物降解、吸附和地表光解等因素而大幅降低。用初始蓝藻添加量为0.375 kg/kg(416 μg MCs/kg)的土壤种植青菜(Brassica chinensis),种子无法正常出苗;而放置30 d后,土壤中的MCs降低为39 μg/kg,青菜正常生长,且收获后其食用部分均未检出MCs含量(LC/MS仪器的检测下限为10 ng/kg)。如果施用25000 kg/hm2充分腐熟的蓝藻肥料(MC-LR和MC-RR的残留量分别为30 μg/kg(干重)和15 μg/kg(干重)),进入土壤的MC-LR和MC-RR的最大量分别为0.75 g/hm2和0.38 g/hm2,远低于湖水灌溉带入农田的MCs的量,青菜体内MCs的含量小于10 ng/kg(本研究室研究结果,待发表)。但施用蓝藻肥料是否会导致其它作物的可食用部分MCs含量超标,仍需要长期、深入和系统的研究。
3.3 微囊藻毒素的生物富集系数
生物富集系数(BCF)是指示化学物质在生物体内累积趋势的重要指标。已有文献报道中,MC-LR和MC-RR在植物地上部分的累积系数分别在0.021—1.63和0.40—9.87之间;MC-LR在植物地下部分的累积系数在0.82—8.8之间(表2)。总起来看,植物地下部分对MCs的吸收和累积量更大。MCs除了在黑麦草中的累积系数随着暴露量的增加而增加[80],其他研究均表明,陆生植物体内的BCF随着暴露量的增加而减小。这说明MCs的富集系数与单位鲜重的含量不成正相关,并不随着处理浓度的增加而增加。此外,MC-LR的生物富集系数显著高于MC-RR,原因仍需要进一步分析。
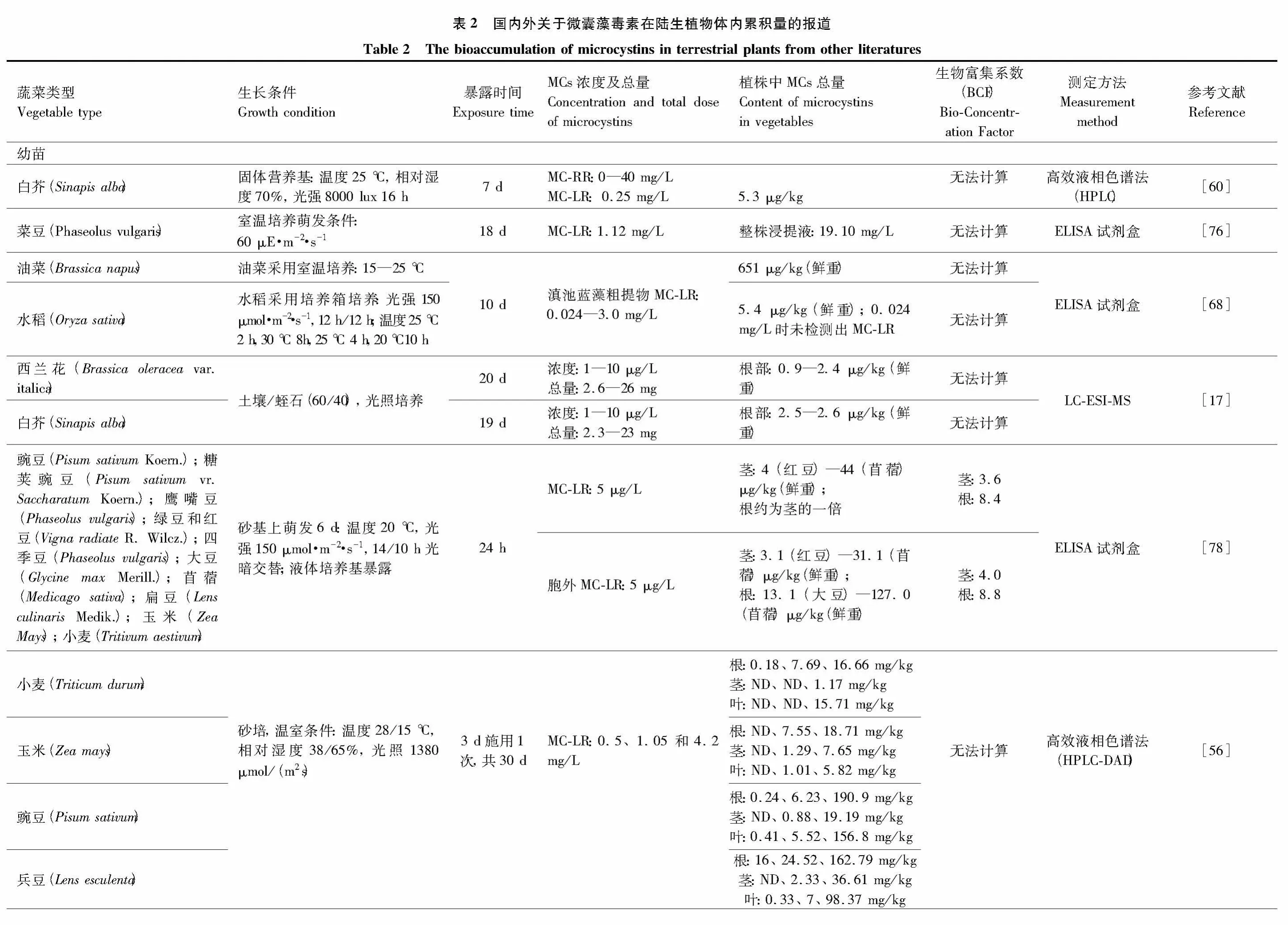
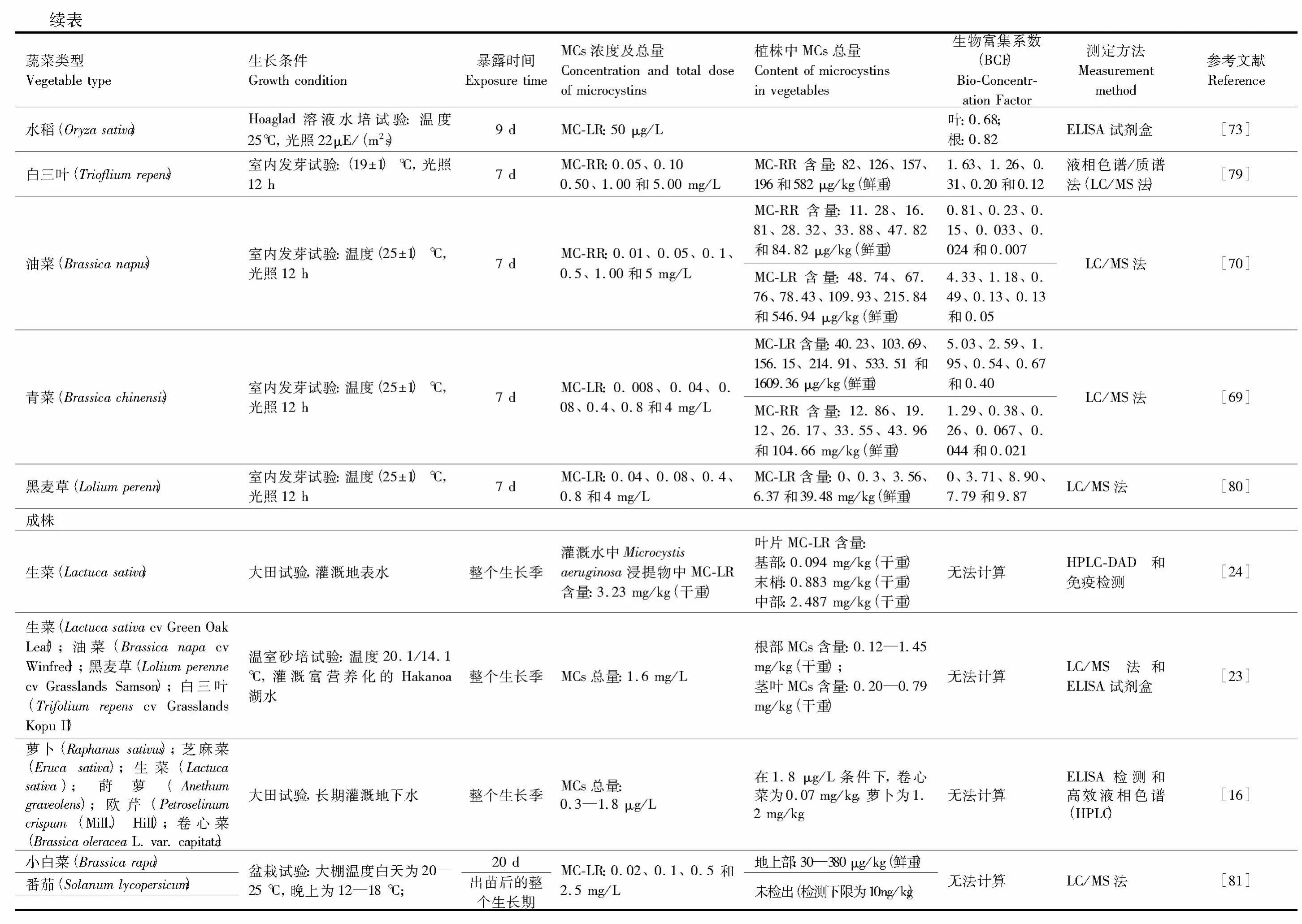
MCs对农作物的毒性效应较为复杂,不同结构的MCs表现出毒性差异,不同的植物类型和生长阶段对MCs的敏感度也不同。此外,不同的培养条件、测定方法[17]等外部因素,对植物体内MCs的检测量也有影响,可能导致其生物富集系数有误差。
4 展望
如何控制并有效治理蓝藻水华污染已成为世界各国共同面临的一个环境科学难题。日趋严重的富营养化污染已经导致我国成为蓝藻水华频发的地区,所产生的MCs严重威胁水生生态系统及人类健康。前期人们对MCs的研究更多地集中在毒素的产生、理化性质的分析检测、对哺乳动物的致毒机理、积累与迁移,以及对人类健康风险的研究。随着蓝藻污染水体的范围逐渐增大,MCs通过物质交换、灌溉等方式进入土壤,在陆生植物,特别是在作物中的累积日益引起人们的关注。因此,加强MCs对人类健康影响的风险评估,量化MCs的生物安全阈值,在MCs污染水域的农业生产中保证农产品质量等方面的研究亟待突破性进展。
通过前期的研究工作,已经认识到土壤在MCs由水体向人体的迁移转化过程中起着十分重要的作用,具有净化功能和传递功能。土壤可通过吸附作用和微生物降解进行MCs的净化,同时MCs可通过灌溉水或施用蓝藻肥料经土壤向作物传递,并在作物中累积。但尚有一些问题亟需解决,如对于MCs在土壤中的迁移转化机制及对土壤的生态效应认识尚浅,对于其降解能力的驱动因子研究不够深入;自然条件下,低浓度(不超过1 μg/L)MCs对农作物的影响未有深入研究;缺乏MCs污染水域周边土壤和作物中MCs含量的调查数据,无法估计MCs对人类健康影响的风险值;缺乏对蓝藻肥料中MCs含量的限制及其生物效应的研究;MCs污染程度与作物受害程度以及作物中累积量的剂量效应关系还不明确,等等。
针对目前研究的现状,作者认为在今后还需要重点进行以下几方面的研究:
(1)加强土壤在MCs迁移转化过程中的功能及作用机制研究。研究不同土壤类型、土壤性质对MCs的吸附-解吸特征,MCs在土壤中的生物降解作用和土表光解作用及其速率、机理、影响因素,以及土壤中MCs的生物效应(如MCs对土壤酶活性、微生物、动物和根系生长的影响),为MCs污染水体的土地处理提供理论、方法、工程设计和管理依据;
(2)阐明MCs的剂量-效应关系及其生态风险,建立基于生物安全风险的农业灌溉用水或蓝藻肥料中MCs的限值。调查研究MCs污染水域周边土壤-作物系统中MCs的含量、分布、传递及积累规律,为有效控制MCs在土壤-农作物系统中的迁移、生态风险和健康风险奠定基础;
(3)制定相关的标准,对蓝藻肥料制作的技术和方法进行规范,对其生物安全性进行评估。
[1] Song L R,Chen W.Production of microcystins in bloom-forming cyanobacteria and their environmental fates:a review.Journal of Lake Science,2009,21(6):749-757.
[2] Dittmann E,Wiegand C.Cyanobacterial toxins-occurrence,biosynthesis and impact on human affairs.Molecular Nutrition and Food Research,2006,50(1):7-17.
[3] Jiang J L,Song R,Ren J H,Wang X R,Yang L Y.Advances in pollution of cyanobacterial blooms-producing microcystins and their ecotoxicological effects on aquatic organisms.Progress in Chemistry,2011,23(1):246-253.
[4] Song L R,Chen W,Peng L,Wan N,Gan N Q,Zhang X M.Distribution and bioaccumulation of microcystins in water columns:a systematic investigation into the environmental fate and the risks associated with microcystins in Meiliang Bay,Lake Taihu.Water Research,2007,41(13):2853-2864.
[5] Chen W,Peng L,Wan N,Song L R.Mechanism study on the frequent variations of cell-bound microcystins in cyanobacterial blooms in Lake Taihu:implications for water quality monitoring and assessments.Chemosphere,2009,77(11):1585-1593.
[6] Yan H,Pan G,Zhang M M.Advances in the study of microcystion toxin.Acta Ecologica Sinica,2002,22(11):1968-1975.
[7] Meiβner K,Dittmann E,Börner T.Toxic and non-toxic strains of the cyanobacterium Microcystis aeruginosa contain sequences homologous to peptide synthetase genes.FEMS Microbiology Letters,1996,135(2/3):295-303.
[8] Chen W,Li L,Gan N Q,Song L R.Optimization of an effective extraction procedure for the analysis of microcystins in soils and lake sediments.Environmental Pollution,2006,143(2):241-246.
[9] Chen W,Song L R,Peng L,Wan N,Zhang X M,Gan N Q.Reduction in microcystin concentrations in large and shallow lakes:water and sediment-interface contributions.Water Research,2008,42(3):763-773.
[10] Tsuji K,Masui H,Uemura H,Mori Y,Harada K I.Analysis of microcystins in sediments using MMPB method.Toxicon,2001,39(5):687-692.
[11] Mitrovic S M,Allis O,Furey A,James K J.Bioaccumulation and harmful effects of microcystin-LR in the aquatic plants Lemna minor and Wolffia arrhiza and the filamentous alga Chladophora fracta.Ecotoxicology and Environmental Safety,2005,61(3):345-352.
[12] Pflugmacher S.Promotion of oxidative stress in the aquatic macrophyte Ceratophyllum demersum during biotransformation of the cyanobacterial toxin microcystin-LR.Aquatic Toxicology,2004,70(3):169-178.
[13] Pflugmacher S,Wiegand C,Beattie K A,Krause E,Steinberg C E W,Codd G A.Uptake,effects,and metabolism of cyanobacterial toxins in the emergent reed plant Phragmites australis(Cav.)Trin.ex Steud.Environmental Toxicology and Chemistry,2001,20(4):846-852.
[14] Pflugmacher S,Codd G A,Steinberg C E W.Effects of the cyanobacterial toxin microcystin-LR on detoxication enzymes in aquatic plants.Environmental Toxicology,1999,14(1):111-115.
[15] Wang H,Xu L H.The current developments and future directions in microcystins study.Acta Hydrobiologica Sinica,2011,35(3):504-515.
[16] Mohamed Z A,Al Shehri A M.Microcystins in groundwater wells and their accumulation in vegetable plants irrigated with contaminated waters in Saudi Arabia.Journal of Hazardous Materials,2009,172(1):310-315.
[17] Järvenpää S,Lundberg-Niinistö C,Spoof L,Sjövall O,Tyystjärvi E,Meriluoto J.Effects of microcystins on broccoli and mustard,and analysis of accumulated toxin by liquid chromatography-mass spectrometry.Toxicon,2007,49(6):865-874.
[18] Li S X,Fu D Q,Luo Y M.Environmental behaviour and risks of microcystins in soil.Asian Jouranl of Ecotoxicology,2009,4(3):324-331.
[19] De Figueiredo D R,Azeiteiro U M,Esteves S M,Gonçalves F J M,Pereira M J.Microcystin-producing blooms-a serious global public health issue.Ecotoxicology and Environmental Safety,2004,59(2):151-163.
[20] Zhang D W,Xie P,Liu Y Q,Qiu T.Transfer,distribution and bioaccumulation of microcystins in the aquatic food web in Lake Taihu,China,with potential risks to human health.Science of the Total Environment,2009,407(7):2191-2199.
[21] Campàs M,Szydlowska D,Trojanowicz M,Marty J L.Enzyme inhibition-based biosensor for the electrochemical detection of microcystins in natural blooms of cyanobacteria.Talanta,2007,72(1):179-186.
[22] Spoof L,Neffling M R,Meriluoto J.Fast separation of microcystins and nodularins on narrow-bore reversed-phase columns coupled to a conventional HPLC system.Toxicon,2010,55(5):954-964.
[23] Crush J R,Briggs L R,Sprosen J M,Nichols S N.Effect of irrigation with lake water containing microcystins on microcystin content and growth of ryegrass,clover,rape,and lettuce.Environmental Toxicology,2008,23(2):246-252.
[24] Codd G A,Metcalf J S,Beattie K A.Retention of Microcystis aeruginosa and microcystin by salad lettuce(Lactuca sativa)after spray irrigation with water containing cyanobacteria.Toxicon,1999,37(8):1181-1185.
[25] Chen W,Song L R,Gan N Q,Li L.Sorption,degradation and mobility of microcystins in Chinese agriculture soils:risk assessment for groundwater protection.Environmental Pollution,2006,144(3):752-758.
[26] Miller M J,Critchley M M,Hutson J,Fallowfield H J.The adsorption of cyanobacterial hepatotoxins from water onto soil during batch experiments.Water Research,2001,35(6):1461-1468.
[27] Eynard F,Mez K,Walther J L.Risk of cyanobacterial toxins in Riga waters(Latvia).Water Research,2000,34(11):2979-2988.
[28] Sharma V K,Triantis T M,Antoniou M G,He X X,Pelaez M,Han C,Song W H,O′Shea K E,de la Cruz A A,Kaloudis T,Hiskia A,Dionysiou D D.Destruction of microcystins by conventional and advanced oxidation processes:a review.Separation and Purification Technology,2012,91(3):3-17.
[29] Young F M,Thomson C,Metcalf J S,Lucocq J M,Codd G A.Immunogold localisation of microcystins in cryosectioned cells of Microcystis.Journal of Structural Biology,2005,151(2):208-214.
[30] Tsuji K,Setsuda S,Watanuki T,Kondo F,Nakazawa H,Suzuki M,Harada K.Microcystin levels during 1992-1995 for Lakes Sagami and Tsukui-Japan.Natural toxins,1996,4(4):189-194.
[31] Lahti K,Rapala J,Färdig M,Niemelä M,Sivonen K.Persistence of cyanobacterial hepatotoxin,microcystin-LR in particulate material and dissolved in lake water.Water Research,1997,31(5):1005-1012.
[32] Gan N,Mi L,Sun X,Dai G,Chung F L,Song L.Sulforaphane protects Microcystin-LR-induced toxicity through activation of the Nrf 2-mediated defensive response.Toxicology and Applied Pharmacology,2010,247(2):129-137.
[33] Xu C,Shu W Q.Pollution,detection and toxic effect of microcystins.Foreign Medical Sciences:Section of Hygiene,2005,32(1):56-60.
[34] Gao Z M,Zhao Z H,Zhang B,Zhang L.Seasonal variation of microcystins concentration and influencing factors in Meiliang Bay,Lake Taihu.Ecology and Environmental Sciences,2011,20(6/7):1063-1067.
[35] Pan X J,Chang F Y,Shen Y W,Liu Y D,Li D H,Li G B,Xiao B D.The correlation between the variation of microcystin content and environment factors in Dianchi Lake.Journal of Lake Science,2006,18(6):572-578.
[36] Yang H,Xie P,Xu J,Zheng L,Deng D,Zhou Q,Wu S.Seasonal variation of microcystin concentration in Lake Chaohu,a shallow subtropical lake in the People′s Republic of China.Bulletin of Environmental Contamination and Toxicology,2006,77(3):367-374.
[37] Lian M,Chen C W,Yu S Z,Liu Y.The distribution of microcystin and its influence factors in Dianshan Lake in summer.China Environmental Science,2000,20(4):323-327.
[38] Xu H B,Sun M,Sui H X,Li J P,Yan W X.Microcystin contamination of fish on Poyang Lake in Jiangxi province.Journal of Hygiene Research,2003,32(3):192-194.
[39] Tian D J,Zheng W W,Wei X,Chen H Y,He M F,Sun X,Zheng Y X,Zhang E P,Jiang S H,Pang L,Yang G H,Qu W D.Eutrophication of water bodies and pollutions of microcystins in water and sediments in X County in the Huai River Basin.Journal of Hygiene Research,2011,40(2):158-162.
[40] Jin J,Liu X Z,Li M J.Microcystins pollution in Gan River and Poyang Lake during springand summer.Journal of Public Health and Preventive Medicine,2007,18(4):4-6.
[41] Chen G,Yu S Z,Wei G R,Chen G C,Xu X Y,Huang Y H,Harada K-i,Ueno Y.Studies on microcystin contents in diff erent drinking water in highly endemic area of liver cancer.Chinese Journal of Preventive Medicine,1996,3(1):6-8.
[42] Wang C H,Lin S J,Han B P,Lin Q Q,Hu R.Distribution of microcytins in typical water supply reservoirs and lakes in Guangdong Province.Acta Hydrobiologica Sinica,2007,31(3):307-311.
[43] Wang F F,Tong C,Yang F,Chen Z L,Yang H Y.Spatial and temporal distribution of microcystins in the Fuzhou Shanzai Reservoir.Acta Scientiae Circumstantiae,2011,31(3):533-546.
[44] Li H M,Du G S,Jiang S J,Wu Y M,Wu D W,Yang Z S.The correlation of microcystins and water environment factors in Guanting Reservoir.Acta Ecologica Sinica,2010,30(5):1322-1327.
[45] Zheng H H,Qian C,Shao B,Zhu Z Q,Zheng D S,Liu Y M,Wei J R.Preliminary survey on water eutrophication and microcystins level in Beijing Miyun Reservoir.Journal of Hygiene Research,2007,36(1):75-77.
[46] Shen H N,Zhou J W,Yuan S.Study on seasonal change characteristics of microcystin content in Karst Plateau Deep-water Reservoir in dry period.Guizhou Agricultural Sciences,2011,39(4):205-207.
[47] Zhang J,Lian Q J,Zhou Y L,Bao Z H,Li Q J.Study on microcystins and their correlation with microcystis cell densities in Guanting Reservoir.Journal of Safety and Environmen,2006,6(5):53-56.
[48] Messineo V,Mattei D,Melchiorre S,Salvatore G,Bogialli S,Salzano R,Mazza R,Capelli G,Bruno M.Microcystin diversity in a Planktothrix rubescens population from Lake Albano(Central Italy).Toxicon,2006,48(2):160-174.
[49] Dillon P J,Miller M,Fallowfield H,Hutson J.The potential of riverbank filtration for drinking water supplies in relation to microsystin removal in brackish aquifers.Journal of Hydrology,2002,266(3-4):209-221.
[50] Holst T,Jørgensen N O G,Jørgensen C,Johansen A.Degradation of microcystin in sediments at oxic and anoxic,denitrifying conditions.Water Research,2003,37(19):4748-4760.
[51] Ishii H,Nishijima M,Abe T.Characterization of degradation process of cyanobacterial hepatotoxins by a gram-negative aerobic bacterium.Water Research,2004,38(11):2667-2676.
[52] World Health Organization.Guidelines for Drinking-Water Quality.4th ed.Geneva:WHO,2011.
[53] Zhang W H,Fang T,Xu X Q.Study on photodegradation of cyanobacterial toxin in blooms of Dianchi Lake.China Environmental Science,2001,21(1):1-3.
[54] Rapala J,Sivonen K,Lyra C,Niemelä S I.Variation of microcystins,cyanobacterial Hepatotoxins,in Anabaena spp.as a function of growth stimuli.Applied and Environmental Microbiology,1997,63(6):2206-2212.
[55] Lu X W,Yuhei I,Ding G J.Degradation of Microcystis viridis and microcystins with biological reactors.China Environmental Science,1999,19(2):138-140.
[56] Saqrane S,Ouahid Y,El Ghazali I,Oudra B,Bouarab L,del Campo F F.Physiological changes in Triticum durum,Zea mays,Pisum sativum and Lens esculenta cultivars,caused by irrigation with water contaminated with microcystins:a laboratory experimental approach.Toxicon,2009,53(7/8):786-796.
[57] Kos P,Gorzo G,Suranyi G,Borbely G.Simple and efficient method for isolation and measurement of cyanobacterial hepatotoxins by plant tests(Sinapis alba L.).Analytical Biochemistry,1995,225(1):49-53.
[58] El Khalloufi F,Oufdou K,Lahrouni M,El Ghazali I,Saqrane S,Vasconcelos V,Oudra B.Allelopatic effects of cyanobacteria extracts containing microcystins on Medicago sativa-Rhizobia symbiosis.Ecotoxicology and Environmental Safety,2011,74(3):431-438.
[59] Pflugmacher S,Jung K,Lundvall L,Neumann S,Peuthert A.Effects of cyanobacterial toxins and cyanobacterial cell-free crude extract on germination of alfalfa(Medicago sativa)and induction of oxidative stress.Environmental Toxicology and Chemistry,2006,25(9):2381-2387.
[60] Kurki-Helasmo K,Meriluoto J.Microcystin uptake inhibits growth and protein phosphatase activity in mustard(Sinapis alba L.)seedlings.Toxicon,1998,36(12):1921-1926.
[61] MacKintosh C,Beattie K A,Klumpp S,Cohen P,Codd G A.Cyanobacterial microcystin-LR is a potent and specific inhibitor of protein phosphatases 1 and 2A from both mammals and higher plants.FEBS Letters,1990,264(2):187-192.
[62] Pflugmacher S,Aulhorn M,Grimm B.Influence of a cyanobacterial crude extract containing microcystin-LR on the physiology and antioxidative defence systems of different spinach variants.New Phytologist,2007,175(3):482-489.
[63] Abe T,Lawson T,Weyers J D B,Codd G A.Microcystin-LR inhibits photosynthesis of Phaseolus vulgaris primary leaves:implications for current spray irrigation practice.The New Phytologist,1996,133(4):651-658.
[64] Peuthert A,Lawton L,Pflugmacher S.In vivo influence of cyanobacterial toxins on enzyme activity and gene expression of protein phosphatases in Alfalfa(Medicago sativa).Toxicon,2008,52(1):84-90.
[65] Kenton P,Mur L A J,Draper J.A requirement for calcium and protein phosphatase in the jasmonate-induced increase in tobacco leaf acid phosphatase specific activity.Journal of Experimental Botany,1999,50(337):1331-1341.
[66] M-Hamvas M,Máthé C,Molnár E,Vasas G,Grigorszky I,Borbely G.Microcystin-LR alters the growth,anthocyanin content and single-stranded DNase enzyme activities in Sinapis alba L.seedlings.Aquatic Toxicology,2003,62(1):1-9.
[67] Peuthert A,Pflugmacher S.Influence of the cyanotoxin microcystin-LR on tocopherol in Alfalfa seedlings(Medicago sativa).Toxicon,2010,56(3):411-417.
[68] Chen J,Song L,Dai J,Gan N,Liu Z.Effects of microcystins on the growth and the activity of superoxide dismutase and peroxidase of rape(Brassica napus L.)and rice(Oryza sativa L.).Toxicon,2004,43(4):393-400.
[69] Li H M,Xue Y F,Yi N,Li Y Q,Shi Z Q.Effects of microeystins on the growth of Chinese cabbage(Brassica chinensis L.)and its accumulation in seedlings.Jiangsu Journal of Agricultural Sciences,2009,25(3):680-684.
[70] Yi N,Xue Y F,Li H M,Liu Z P,Li Y Q,Shi Z Q.Effects of microcystins on the growth and activities of antioxidant enzymes in rape seedlings.Acta Botonica Boreali-Occidentalia Sinica,2009,29(6):1207-1213.
[71] Yin L,Huang J,Huang W,Li D,Wang G,Liu Y.Microcystin-RR-induced accumulation of reactive oxygen species and alteration of antioxidant systems in tobacco BY-2 cells.Toxicon,2005,46(5):507-512.
[72] Gehringer M M,Downs K S,Downing T G,Naudé R J,Shephard E G.An investigation into the effect of selenium supplementation on microcystin hepatotoxicity.Toxicon,2003,41(4):451-458.
[73] Prieto A,Campos A,Cameán A,Vasconcelos V.Effects on growth and oxidative stress status of rice plants(Oryza sativa)exposed to two extracts of toxin-producing cyanobacteria(Aphanizomenon ovalisporum and Microcystis aeruginosa).Ecotoxicology and Environmental Safety,2011,74(7):1973-1980.
[74] Siegl G,MacKintosh C,Stitt M.Sucrose-phosphate synthase is dephosphorylated by protein phosphatase 2A in spinach leaves:evidence from the effects of okadaic acid and microcystin.FEBS Letters,1990,270(1/2):198-202.
[75] Shin T,Shoji M,Masa-aki O,Kenzo N.Inhibitors of protein phosphatases 1 and 2A block the sugar-inducible gene expression in plants.Plant Physiology,1994,106(2):567-574.
[76] McElhiney J,Lawton LA,Leifert C.Investigations into the inhibitory effects of microcystins on plant growth,and the toxicity of plant tissues following exposure.Toxicon,2001,39(9):1411-1420.
[77] Chen J Z,Dai J,Zhang H Y,Wang C Y,Zhou G Q,Han Z P,Liu Z L.Bioaccumulation of microcystin and its oxidative stress in the apple(Malus pumila).Ecotoxicology,2010,19(4):796-803.
[78] Peuthert A,Chakrabarti S,Pflugmacher S.Uptake of microcystins-LR and-LF(cyanobacterial toxins)in seedlings of several important agricultural plant species and the correlation with cellular damage(lipid peroxidation).Environmental Toxicology,2007,22(4):436-442.
[79] Xue Y F,Li H M,Yi N,Li Y Q,Shi Z Q.Effects of MC-RR on the seed germination and characteristics of physiology and biochemistry in Trifolium repens seedlings.Acta Prataculturae Sinica,2009,18(6):180-185.
[80] Li H M,Gan X Y,Deng L,Li J L,Shi Z Q,Xue Y F,Yi N,Li Y Q.The accumulation of MC-LR in ryegrass(Lolium perenne L.)seedlings and effects of MC-LR on the growth of seedlings.Journal of Agro-Environment Science,2010,29(1):49-53.
[80] Geng Z M,Gu Y Y,Wang P.Effects of microcystin on growth and development of pakchoi cabbage and tomato and its accumulation in them.Acta Agriculturae Jiangxi,2011,23(9):21-24.
[82] Ministry of Health of the People′s Republic of China,Standardization Administration of China.GB 5749-2006 Standards for Drinking Water Quality.Beijing:China Standard Press,2007.
参考文献:
[1] 宋立荣,陈伟.水华蓝藻产毒的生物学机制及毒素的环境归趋研究进展.湖泊科学,2009,21(6):749-757.
[3] 姜锦林,宋睿,任静华,王晓蓉,杨柳燕.蓝藻水华衍生的微囊藻毒素污染及其对水生生物的生态毒理学研究.化学进展,2011,23(1):246-253.
[6] 闫海,潘纲,张明明.微囊藻毒素研究进展.生态学报,2002,22(11):1968-1975.
[15] 王昊,徐立红.微囊藻毒素研究的当前进展和未来方向.水生生物学报,2011,35(3):504-515.
[18] 李士杏,付登强,骆永明.微囊藻毒素在土壤中的环境行为及污染风险.生态毒理学报,2009,4(3):324-331.
[33] 许川,舒为群.微囊藻毒素污染状况、检测及其毒效应.国外医学:卫生学分册,2005,32(1):56-60.
[34] 高振美,赵中华,张波,张路.太湖梅梁湾水体微囊藻毒素含量的季节变化特征及其影响因素研究.生态环境学报,2011,20(6/7):1063-1067.
[35] 潘晓洁,常锋毅,沈银武,刘永定,李敦海,李根保,肖邦定.滇池水体中微囊藻毒素含量变化与环境因子的相关性研究.湖泊科学,2006,18(6):572-578.
[37] 连民,陈传炜,俞顺章,刘颖.淀山湖夏季微囊藻毒素分布状况及其影响因素.中国环境科学,2000,20(4):323-327.
[38] 徐海滨,孙明,隋海霞,李建平,严卫星.江西鄱阳湖微囊藻毒素污染及其在鱼体内的动态研究.卫生研究,2003,32(3):192-194.
[39] 田大军,郑唯韡,韦霄,张皓,陈涵一,何民富,孙新,郑玉新,张二鹏,蒋颂辉,庞磊,杨功焕,屈卫东.淮河流域某县水体富营养化及水体、底泥微囊藻毒素污染状况研究.卫生研究,2011,40(2):158-162.
[40] 金静,刘小真,李明俊.赣江及鄱阳湖春夏两季微囊藻毒素的污染研究.公共卫生与预防医学,2007,18(4):4-6.
[41] 陈刚,余顺章,卫国荣,陈公超,徐小英,黄裕华,Ken-ichi Harada,Yoshio Ueno.肝癌高发区不同饮用水类型中微囊藻毒素含量调查.中华预防医学杂志,1996,3(1):6-8.
[42] 王朝晖,林少君,韩博平,林秋奇,胡韧.广东省典型大中型供水水库和湖泊微囊藻毒素分布.水生生物学报,2007,31(3):307-311.
[43] 王菲凤,仝川,杨芳,陈祖亮,杨红玉.福州山仔水库水华微囊藻毒素时空分布特征.环境科学学报,2011,31(3):533-546.
[44] 李慧敏,杜桂森,姜树君,吴玉梅,武佃卫,杨忠山.官厅水库的微囊藻毒素及其与水环境的相关性.生态学报,2010,30(5):1322-1327.
[45] 郑和辉,钱城,邵兵,朱志勤,郑德生,刘玉敏,魏建荣.北京密云水库富营养化和微囊藻毒素污染水平初步调查分析.卫生研究,2007,36(1):75-77.
[46] 沈红娜,周建威,袁帅.干旱期喀斯特高原深水水库微囊藻毒素含量的变化特征.贵州农业科学,2011,39(4):205-207.
[47] 张娟,梁前进,周云龙,包智泓,李启军.官厅水库水体中微囊藻毒素及其与微囊藻细胞密度相关性研究.安全与环境学报,2006,6(5):53-56.
[53] 张维昊,方涛,徐小清.滇池水华蓝藻中藻毒素光降解的研究.中国环境科学,2001,21(1):1-3.
[55] 吕锡武,稻森悠平,丁国际.有毒蓝藻及藻毒素生物降解的初步研究.中国环境科学,1999,19(2):138-140.
[69] 李慧明,薛延丰,易能,李优琴,石志琦.藻毒素对青菜生长的影响及其在幼苗体内的积累.江苏农业学报,2009,25(3):680-684.
[70] 易能,薛延丰,李慧明,刘兆普,李优琴,石志琦.微囊藻毒素对油菜幼苗生长及抗氧化酶活性的影响.西北植物学报,2009,29(6):1207-1213.
[79] 薛延丰,李慧明,易能,李优琴,石志琦.微囊藻毒素(MC-RR)对白三叶种子萌发及幼苗生理生化特性影响.草业学报,2009,18(6):180-185.
[80] 李慧明,干晓宇,邓蕾,李建龙,石志琦,薛延丰,易能,李优琴.微囊藻毒素(MC-LR)在黑麦草幼苗体内的积累及对其生长的影响.农业环境科学学报,2010,29(1):49-53.
[81] 耿志明,顾迎迎,王澎.微囊藻毒素对小白菜、番茄生长发育影响及其在它们体内积累的研究.江西农业学报,2011,23(9):21-24.
[82] 卫生部和国家标准化管理委员会.GB 5749—2006生活饮用水卫生标准.北京:中国标准出版社,2007.

