气质联用法测定花色蛤中扑草净残留量
宗万里
(威海市产品质量监督检验所,山东 威海264209)
扑草净为氮苯类内吸性传导除草剂,化学名称为4,6-双异丙胺基-2-甲硫基-1,3,5-三嗪,对人、畜、鱼、蜜蜂低毒,且施药后残效期长,为1个月左右,此外扑草净还有致突变作用。2012年,日本厚生省从山东省出口的3个批次活杂色蛤中检出扑草净,全部销毁处理。据了解,养殖户为清除养殖池内的海藻,大量向水体中使用化学药品(主要成分为扑草净),长期积累导致最终产品中扑草净残留量超标。严重影响了我国对外水产品的出口贸易,因此有必要加强对花色蛤中的扑草净残留量进行检测与监控,目前测定食品扑草净残留量常用的检测方法主要有气相色谱法[1-2]、气相色谱-质谱联用法[3-9]、液相色谱-串联质谱法[10]。本实验使用正己烷直接提取花色蛤中扑草净残留量后,经固相萃取柱净化,样品处理液注入气质联用仪进行分析检测,取得了较好的分析效果,建立了一种较为快速的测定花色蛤中的扑草净残留量的气相色谱质谱联用法。
1 材料与方法
1.1 试剂与仪器
正己烷:分析纯,国药集团化学试剂有限公司;扑草净标准品:≥99.3%,0.25g,Dr.Ehrenstorfer GmbH;30ml具塞刻度试管;漩涡振荡器:MS3 Digital,IKA公司;料理机,九阳股份有限公司;气质联用仪:GCMSQP2010 Plus,日本岛津公司;毛细管色谱柱:Rxi-5ms(30mm,0.25mm,0.25μm),RESTEK;分析天平:FC204型,精度为0.1mg,上海精密科学仪器有限公司;全自动氮吹浓缩仪:XT-NS1,上海新拓分析仪器科技有限公司;固相萃取小柱,CNWBOND FLORISIL SPE TUBES,1g/6ml,上海安普。
1.2 色谱条件
载气(氦气)流速为 1ml/min,用恒速率控制方式,速率为36.7cm/sec;SPL进样口,不分流进样,进样时间为1min,分流比设为5:1;SPL进样口温度:200℃;柱温箱温度程序:初始温度60℃,保持1min,以30℃/min升至220℃,保持10min。
1.3 质谱条件
离子源温度:230℃;接口温度:280℃;溶剂延迟时间5min;检测器电压:使用调谐电压;
SCAN方式质量数范围:50~350;sim定量方式选择监测离子碎片:241,226,186,104;定量离子为:241。
1.4 溶液配制
1.4.1 标准溶液的制备
准确称取50mg扑草净标准品至50ml容量瓶中,用甲醇定容,得1mg/ml的标准溶液。
再从1mg/ml的标准溶液中分别吸取0.5ml加入到50ml容量瓶中,用甲醇定容至刻度得10μg/ml的标准溶液。再从10μg/ml的标准溶液中分别吸取0.25, 0.5, 1,2.5, 5ml加入到5个不同的50ml容量瓶中,用甲醇定容至刻度,得0.05, 0.1,0.2,0.5,1.0μg/ml的标准溶液。每个质量浓度取1μL注入气质联用仪进行分析。
1.4.2 样品前处理
1.4.2.1 提取
准确称取经料理机粉碎的待测花色蛤肉10g于30ml具塞刻度试管中,用30.0ml正己烷分三次提取,每次使用漩涡振荡器充分振荡提取样品,收集三次提取溶液后用全自动氮吹浓缩仪于50℃浓缩至近干,再加入2ml正己烷溶解浓缩液。
1.4.2.2 净化
取FLORISIL固相萃取小柱,加入1柱管体积正己烷对小柱活化,加入2ml样品处理液,再加入2ml正己烷洗脱杂质,最后用丙酮洗脱并定容至2ml。
2 结果与讨论
2.1 样品前处理
由于扑草净易溶于正己烷等有机溶剂,且正己烷不易溶于水,本文采用正己烷直接浸泡提取花色蛤肉中扑草净的残留量,之后使用硅藻土固相萃取小柱对正己烷提取液进行净化以除去正己烷中可能会溶有的脂肪等杂质。经过净化后,样品处理液直接注入气质联用仪中进行检测。
2.2 色谱图
在1.2及1.3节色谱及质谱条件下, 得到扑草净标准样品的scan方式下的总离子流图,扑草净的质谱图,sim方式下的总离子流图、未知样品的总离子流图、加标未知样品的总离子流图,如图1~图5所示。扑草净的出峰时间为9.122min,加标样品谱图干净,无干扰。在该色谱条件下,实验结果良好。
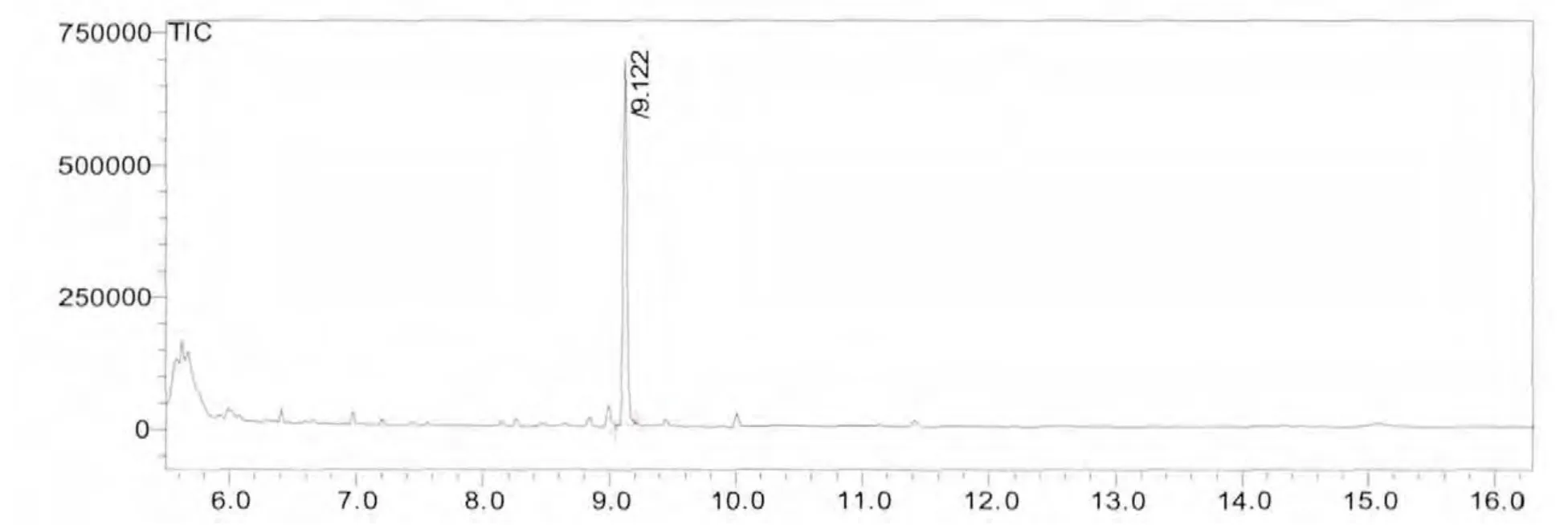
图1 标准样品的scan方式下的TIC色谱图Fig.1 TIC chromatogram of prometryne standard sample
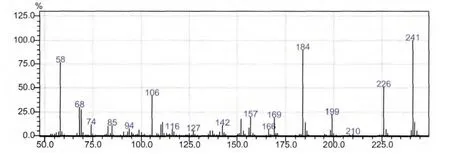
图2 标准样品的质谱图Fig.2 mass spectrum of standard sample

图3 标准样品SIM方式下的TIC色谱图Fig.3 TIC chromatogram of standard sample in SIM mode

图4 未知样品sim方式下的TIC色谱图Fig.4 TIC chromatogram of unknown Color clams sample in SIM mode
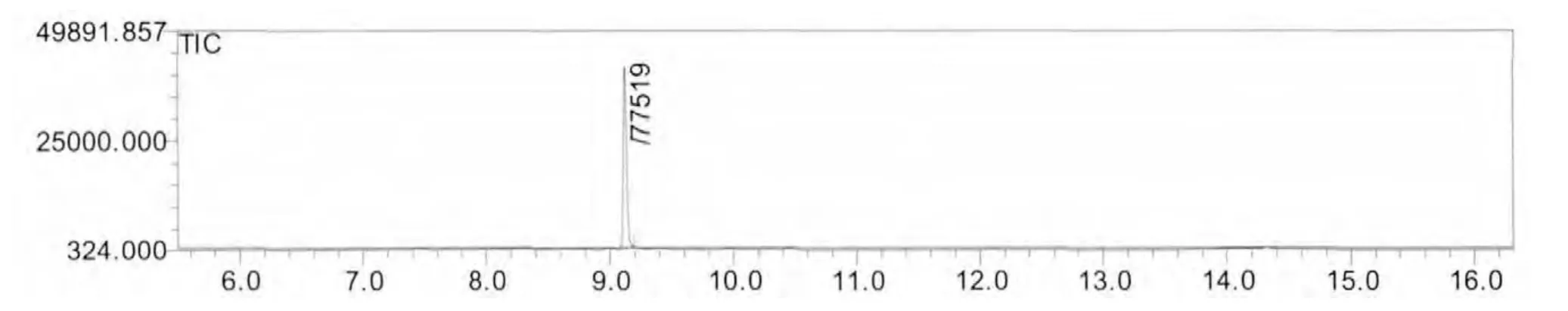
图5 加标未知样品sim方式下的TIC色谱图Fig.3 TIC chromatogram of unknown Color clams sample added with prometryne in SIM mode
2.3 标准曲线和最低检出限
在实验条件下,以峰面积y为纵坐标,质量浓度x(μg·ml-1)为横坐标绘制标准曲线,得线性方程,以基线噪声3倍峰面积对应的质量浓度为检出限(S/N=3)[11],回归方程、相关系数及检出限见表1,线性曲线如图6所示。
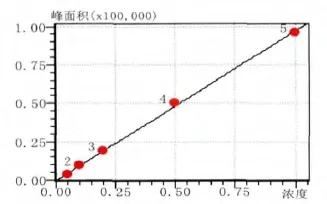
图6 扑草净线性曲线Fig.6 curve line of prometryn

表1 回归曲线的基本参数Tab. 1 Basic parameter of regression equation
2.4 精密度和加标回收实验
取不含扑草净的花色蛤样品进行加标回收实验,向5g样品中分别添加100μg/ml扑草净标准溶液25、50、100μL,即样品中扑草净含量为分别为0.5、1、2mg/kg。按上述1.4.2样品处理方法进行样品处理,重复6次。按1.2及1.3节色谱及质谱条件进行测定,精密度和回收率计算结果见表2。由表2可知,采用本方法所得数据满足检测要求。
3 结论
通过实验建立了正己烷直接浸泡提取法测定花色蛤中扑草净含量的气相色谱-质谱联用检测方法,该法前处理简单,方法的最低检出限为0.00022mg/kg,远远低于国外0.01mg/kg的限量要求,测试结果稳定且准确度较高,能够满足检测要求。该方法节省了检测时间,可操作性强,能够为扑草净的检验与监测提供科学依据与技术支持。

表2 样品添加回收和精密度实验Tab. 2 Spiked recovery and precision
[1]国家质量监督检验检疫总局.GB/T 18629-2002 食品中扑草净残留量的测定方法[S].北京:中国标准出版社,2002.
[2]蒋世熙,钱亚玲,芦秀静.水中扑草净的气相色谱法测定.[J]环境污染与防治.1992,14(2):43-44.
[3]国家质量监督检验检疫总局.SN/T 1968-2007 进出口食品中扑草净残留量检测方法 气相色谱-质谱法[S].北京: 中国标准出版社,2007.
[4]王太全,曾正宏,张丹,杨瑞章,徐帮兴,陈勇.分散固相萃取-气相色谱-质谱法测定肉制品中残留的扑草净、禾草丹[J]肉类工业,2009,4:43-45.
[5]吴明根,李婷,郑承志. 轮叶党参根的扑草净残留量分析[J].植物保护,2010,36(6):100-102.
[6]陈鸿,曾正宏.凝胶渗透色谱-气相色谱-质谱法测定鮰鱼片中残留的禾草丹、呋喃硫威、扑草净[J].科技风,2010,5:170-171.
[7]李淑娟,陈冬东,李晓娟,安娟,蔡会霞,李建中,唐英章.气相色谱-质谱法测定食品中扑草净的残留量[J].中国卫生检验杂志,2007,17(12):2138-2140.
[8]杨云,栾伟,罗学军,李攻科.微波辅助萃取-固相微萃取联用气相色谱-质谱法测定土壤中的扑草净[J].分析化学,2004,32(6):775-778.
[9]杨云,栾伟,李攻科.微波辅助萃取气相色谱-质谱联用测定蔬菜中的扑草净[J].分析试验室,2003,22(4):75-78.
[10]陈溪,刘梦遥,曲世超,黄大亮,张晓林,刘莹.海产品、底泥、海水中扑草净药物残留量的液相色谱-串联质谱检测[J].化学通报,2013,76(2):183-186.
[11]中华人民共和国卫生部.GB/T 5009.1—2003 食品卫生检验方法理化部分 总则[S].北京:中国标准出版社,2003.