束花石斛和黄花石斛的光合特性研究
朱巧玲,冷佳奕,叶庆生
(华南师范大学生命科学学院,广东省植物发育生物工程重点实验室,广东广州510631)
石斛属(Dendrobium)是兰科中最大的属之一,已被列入《濒危野生动植物种国际贸易公约》(CITES)附录中,全球约有1 500~1 600 种,是全球最具观赏价值的四大兰花之一. 我国特有的野生石斛都是春天开花的春石斛. 对金钗石斛、霍山石斛、铁皮石斛等的光合作用、生长和栽培做过一些研究[1-4],但对野生石斛的光合特性的研究缺乏系统性的研究.兰科植物根据叶片的厚薄将兰花分为厚叶兰和薄叶兰.一般认为,厚叶兰属CAM 植物,如蝴蝶兰;薄叶兰属C3植物,如兰属植物,兰科植物还未发现有C4类型[5-10]. 我国的野生石斛有70 多个种,分9个组[11],其中大花石斛组(Sect. Eugenaanthe)最为丰富,占已有种的50%以上,有很好的观赏价值和药用价值.但关于我国野生石斛的光合途径尚未有统一的定论.本文以大花石斛组的束花石斛和黄花石斛为材料,对它们的光合特性进行了系统研究,为石斛属植物的资源保护和利用提供实验依据.
1 材料与方法
1.1 材料
实验材料石斛采集自云南高黎贡山的野生种:大花组的束花石斛(D.chrysanthum)和黄花石斛(D.dixanthum),用树皮盆栽于遮阳率小于50%的塑料温室大棚中,白天(30±2)℃,夜间(25±3)℃,湿度65~90%,每星期施用1 次3 倍稀释的Hoagland 营养液.所有实验测定均选取顶部向下的第4 片成熟叶片,3个重复.
1.2 实验方法
1.2.1 叶片显微结构观察 叶片解剖结构采用光学显微镜观察和扫描显微镜观察.
1.2.2 叶绿素含量的测定 按WINTERMANS &DE MOTS[12]方法测定.
1.2.3 RuBPCase( EC 4.1.1.39) 、PEPCase( EC 4.1.1.31) 、GO( EC 1.1.3.1) 酶液提取和活性的测定 2 种石斛植株叶片各0.2 g 放入预冷的研钵中,加入1.5 mL 预冷的100 mmol /L Tris- HCL 缓冲液(含10 mmol /L MgCl2、5 mmol/L 巯基乙醇,1 mmol/L EDTA,12.5% 甘油和1% 聚乙烯吡咯烷酮,pH 7.4),迅速研磨,匀浆经4 层纱布过滤后4 ℃下15 000 r/min 离心25 min,取上清液用于酶活性的测定.
RuBPCase、PEPCase 和GO 活性的测定按叶庆生[7]的方法测定.蛋白质含量测定采用考马斯亮蓝法测定酶提取液中蛋白质含量,以牛血清蛋白作标准曲线.
1.2.4 光合特性测定 用便携式光合测定仪LI-6400(Li-Cor,USA),同时测定净光合速率(Pn)、气孔阻力(Gs)、胞间CO2浓度(Ci)、蒸腾速率(Tr)、有效光辐射(PAR)、大气温度(Tair)等各种指标,3~9次重复,每次重复测定3~5 片,取平均值.
光响应曲线:测量时间为晴天上午9:30—11:30,利用LI-6400 自动光响应曲线测定功能,将LI-6400 内置红蓝光源(6400-02B)在0~1 200 μmol/(m2·s1)设定一系列PAR 梯度分别测定对应梯度叶片Pn,将Pn和PAR 的成对值作出相应曲线,得到LCP、LSP 等相关参数;将200 μmol/(m2·s1)以内的PAR 和Pn的成对值进行直线回归,求得Pn-PAR 响应曲线的初始斜率即为光合作用的AQY.测定时CO2浓度设为(380 ±10)μmol/mol,叶片温度:(25 ±0.5)℃,相对湿度为(70 ±15)%.
CO2响应曲线:利用LI-6400 便携式光合测定系统的注入系统(6400-01)设定CO2浓度,控制PAR 在(800 ±10)μmol/(m2·s),温度为(25 ±0.5)℃,RH:(70 ±15)%,在0~1 500 μmol/mol 范围内设定CO2浓度梯度,分别测定Pn,将Pn和PAR的成对值作出相应曲线,得到CCP、CSP 及相关参数;将200 μmol/(m2·s)以内的CO2浓度和Pn的对应值进行直线回归,初始斜率即为RuBPCase 的CE.CO2光饱和点时的Pn为RuBP 再生速率.
温度响应曲线:用LI-6400 便携式光合测定系统的叶室调温系统(6400-13),在18~34 ℃温度范围内,从低到高测定各温度梯度的Pn值,测定时PAR 设为(800 ±10)μmol/(m2·s),CO2浓度控制为(380 ±10)μmol/mol,相对湿度为(70 ±15)%左右.
净光合速率Pn日变化和季节变化测定:日变化测定于5月中旬选择3个晴天从7:00—19:00,每隔1 h 用LI-6400 便携式光合测定系统测定Pn等光合作用相关参数;季节变化于3—10月每月中旬选择3个晴天,于10:00—11:00 在自然条件下用LI-6400 便携式光合测定系统测定Pn等光合作用相关参数.
1.2.5 叶绿素荧光参数日变化的测定 于5—7月选择3个晴天,用德国WALZ 公司生产的PAM2100叶绿素荧光仪选取生长健康,长势一致的石斛植株的功能叶片进行测定,每种植株测定3~5 片叶,每片叶选取1个圆形区域(area of interest. AOI,直径1 cm)进行测定和统计. 叶绿素荧光参数分别为:Fv/Fm(PS II 最大原初光能转换效率);Yield (PS II实际光化学效率);Fo(初始荧光强度)等,各数值及其对应的荧光图像在饱和脉冲过程中被ImagingWin软件实时记录.
2 结果与讨论
2.1 束花石斛、黄花石斛叶片的超微结构
电镜观察发现束花石斛和黄花石斛叶肉组织内的叶绿体内淀粉颗粒等较多且大;叶片叶脉主脉发达,侧脉细小. 横切面上,叶脉维管束排列为圆环状,叶脉的维管束鞘薄壁细胞较小,排列清晰,不含叶绿体,没有花环型结构. 叶肉细胞中叶绿体数目较多.2 种石斛叶片解剖结构表现出C3植物特征(图1A、B).
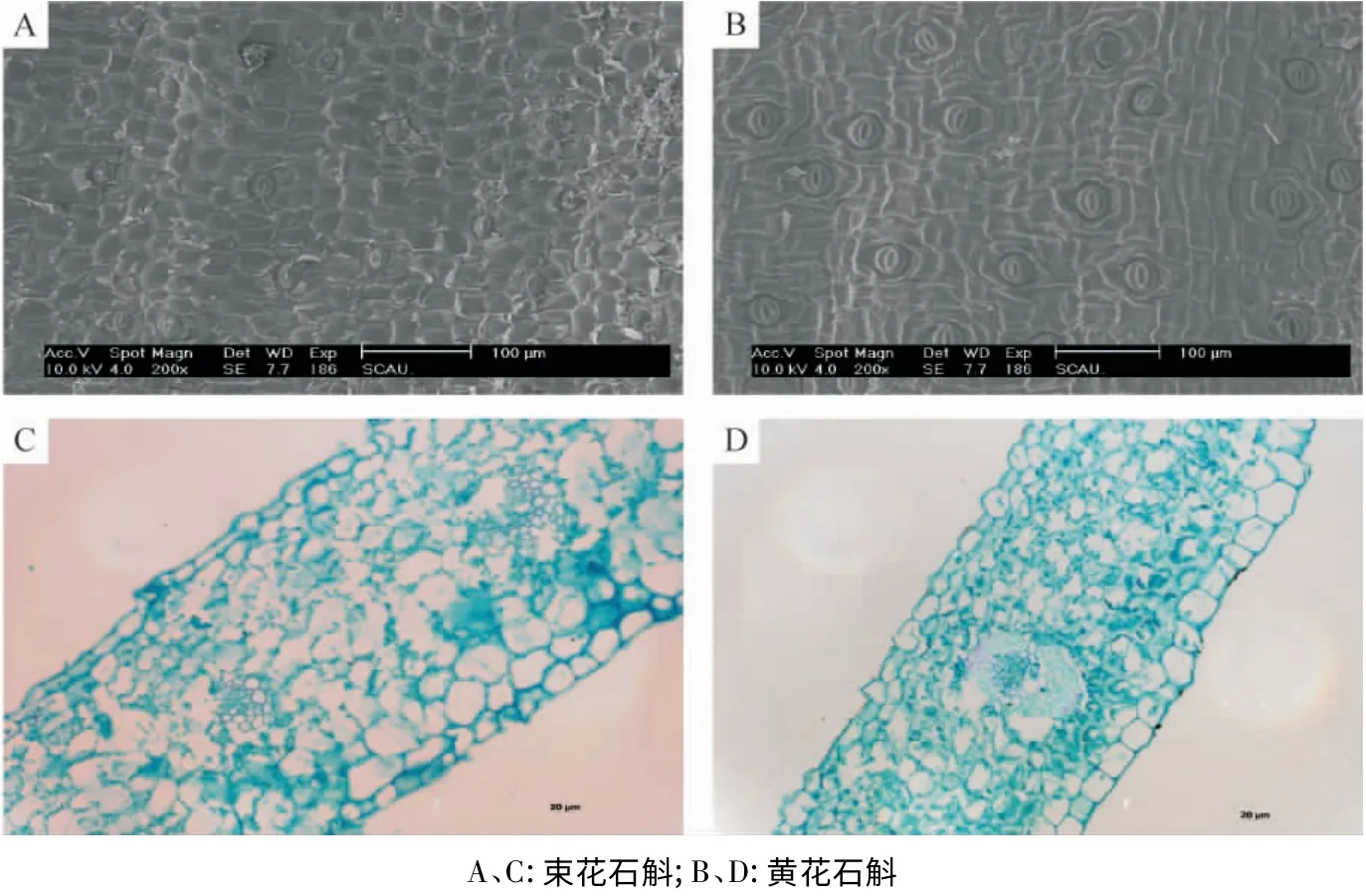
图1 束花石斛、黄花石斛叶片下表面扫描电镜图(A、B)和叶片横切面石蜡切片图(C、D)Figure 1 Electron microscope images of the lower surface (A,B)and paraffin section of cross-section (C,D)of D.chrysanthum and D.dixanthum
束花石斛和黄花石斛叶片都为背腹型叶,厚度约为300~400 μm,相对于蝴蝶兰等厚叶兰(CAM植物,叶片厚度约为3 000 μm)属于薄叶兰类型.叶片上表面无气孔分布,有角质层,叶片上表面细胞比较整齐分布,都呈近长方形排列.叶片下表面细胞均为不规则形状,大小不等,气孔分布于下表面(图1C、D).2 种石斛叶片的气孔密度比较高,大约达到97~123个/mm2,气孔结构为椭圆形,下陷,大小约为20~30 μm,上覆有蜡质的气孔盖. 叶肉组织发达,分化为栅栏组织与海绵组织,但不是很明显. 栅栏组织由1~2 层排列整齐的圆柱状细胞构成,厚约为60 μm,外层细胞排列紧密,染色较深,呈异细胞状,内层细胞染色较浅,含丰富的叶绿体;海绵组织细胞排列疏松,厚约40 μm 也含有较多的叶绿体.
2 种石斛叶片的气孔密度较高,气孔密度大,吸收CO2量多,有利于植物光合作用;有研究指出,气孔密度、栅栏组织厚度与海绵厚度的比值与Pn值表现出一定的相关性[13-14].石斛叶片表皮细胞排列紧密,叶肉栅栏组织发达,含有较多的叶绿体的结构有利于它们在森林荫蔽环境下的光合作用,是长期自然适应的结果.
2.2 束花石斛和黄花石斛光合速率(Pn)对光强、CO2 和温度的响应
束花石斛、黄花石斛叶片的Pn-PAR 曲线呈相似的变化趋势(图2).PAR 为0~300 μmol/(m2·s)内,随着PAR 的增强,Pn呈线性迅速增大,PAR 为300~800 μmol/(m2·s)时,Pn增加趋缓.当PAR 为800 μmol/(m2·s)时,Pn达到最大,PAR 继续增加,Pn则略有下降;2 种石斛兰的最大光合速率(Pn)约6.0 μmol/(m2·s)左右,光补偿点为5.0~8.0 μmol/(m2·s),光饱和点在850~900 μmol/(m2·s)(表1).上述结果表明,石斛兰的LSP 和LCP 相对低,具有阴生或半阴生植物的特点,这与其适于生长在较荫处的生活习性相适应. 表观量子效率(AQY)是叶片光能利用效率的一个重要指标,反映叶片对弱光的利用能力.2 种石斛兰叶片的AQY 在0.022左右,表明束花石斛和黄花石斛的光能利用效率比较低,光合作用时对光量子要求较高,对弱光的利用潜能也比较大.
2 种石斛兰的净光合速率Pn对CO2浓度变化的响应也基本相同(图2,表1),CO2补偿点(CCP)在80.00~90.00 μmol/mol;CO2浓度在0~700 μmol/mol 范围内,随着CO2浓度的升高,Pn快速增加;当CO2浓度达到800 μmol/mol 左右时,Pn达到最大,约为8.0~10.0 μmol/(m2·s),表明束花石斛、黄花石斛的CO2饱和点(CSP)在850~900 μmol/mol.2 种石斛兰叶片的羧化效率分别为0.018 和0.022,即石斛兰光合作用时每固定1个CO2分子需要的CO2分子数约为45~55,说明它们的羧化效率低,增加CO2浓度可以显著提高它们的光合速率.

图2 束花石斛和黄花石斛的光强、CO2 浓度和温度响应曲线Figure 2 Response curves of light intensity,CO2 and temperature in the leaves of D.chrysanthum and D.dixanthum
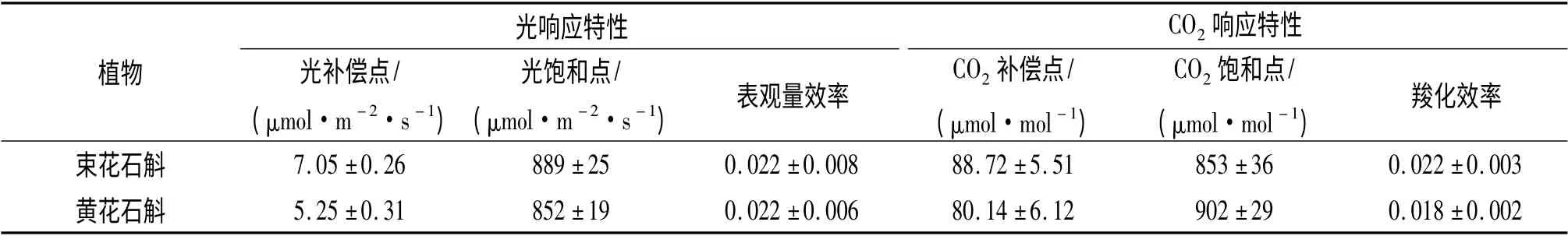
表1 束花石斛和黄花石斛叶片的光响应特性和CO2 响应特性Table 1 Characteristics of light and CO2 responses of the leaves of D.chrysanthum and D.dixanthum
温度是植物光合速率的主要影响因子. 束花石斛、黄花石斛的Pn在18~26 ℃范围随着温度的升高而呈线性上升(图2),当温度在26 ℃左右时,最大Pn在5.0~6.0 μmol/(m2·s),当温度超过30 ℃后,Pn随着温度的升高而下降. 这些结果表明石斛兰的光合作用最适温度约为26~30 ℃.这与霍山石斛、铜皮石斛的光合作用最适温度在25~30 ℃的结果基本一致[15].
2 种石斛兰叶片的光饱和点到了最大日照强度(1 800~2 200 μmol/(m2·s1))的40%~50%,为半阴生植物特征.此外,2 种石斛叶片的羧化效率在0.02 左右,对低CO2浓度的利用率比较低.因此,增加CO2浓度可以提高它们的光合速率,有利于石斛兰生长.温度一方面通过影响Ci间接影响Pn,另一方面影响叶片内光合作用相关酶的活性,每种植物的光合作用都有其能够适应的温度范围与最适宜的温度范围[16-17].本研究的2 种石斛兰光合作用最适温度在26~30 ℃之间,这表明它们适合在热带亚热带地区生长.
2.3 束花石斛和黄花石斛叶片的光合速率日变化特征
束花石斛和黄花石斛的净光合速率Pn日变化都具有相同的变化趋势,呈双峰曲线(图3),从7:00 开始,Pn呈快速线性上升趋势,11:00 左右光合速率达到最大,它们最大净光合速率Pn在5.0~6.0 μmol/(m2·s),随后下降,13:00—14:00 达到最低点,表现出明显的“光合午休”现象. 这是因为13:00—14:00,外界环境中的光强和温度的不断升高,超出2 种石斛光合作用的最高点,强光和高温对植株的胁迫作用,导致气孔关闭或部分关闭从而引起了“光合午休”现象的发生.14:00 以后,植物的光合速率又有所上升,15:00 左右出现Pn的第2个峰,但光合速率比上午的第1个峰要低得多,以后Pn快速下降.此外,继续的测定表明,2 种石斛在夜间都没有CO2吸收,这些表明束花石斛和黄花石斛不是CAM 植物而应该是C3光合途径植物.
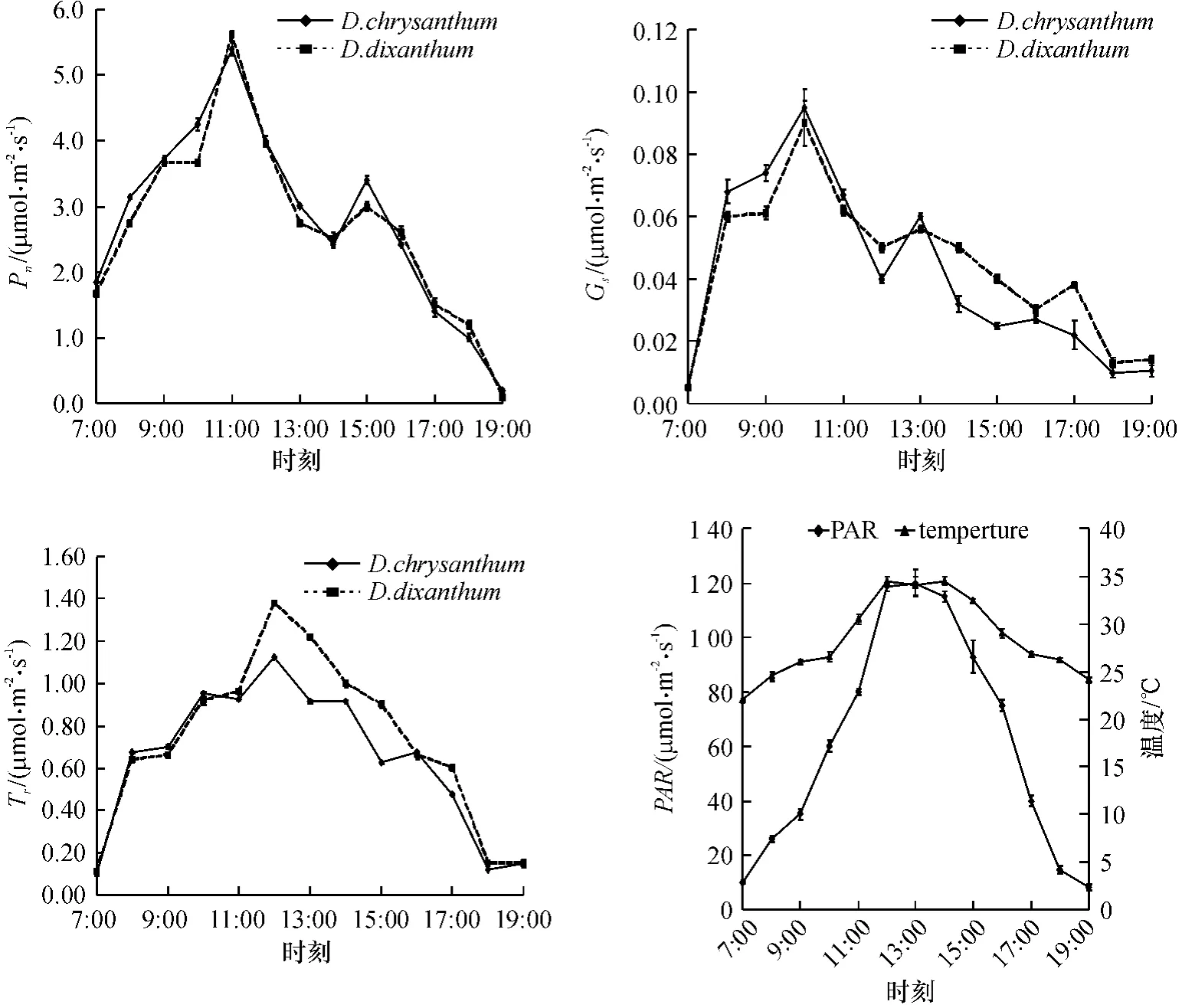
图3 束花石斛和黄花石斛的净光合速率、气孔导度和蒸腾速率日变化Figure 3 Diurnal variation of Pn,Gs and Tr in the leaves of D.chrysanthum and D.dixanthum
2 种石斛光合速率日变化的“午休”现象,是环境条件和叶片的生理因素相互作用的综合结果. 从外界环境的光强和温度日变化情况看(图3),在7:00—11:00,Pn的增加和PAR、温度呈正相关,11:00 以后光强和温度的继续上升超过了光合作用的最适条件,使得气孔孔缩小或部分关闭从而使得气孔阻力(Gs)增大、蒸腾速率(Tr)下降(图3),导致Pn下降,从而出现了“光合午休”现象.此现象实际上是植物的一种光保护机制,避免中午因过高的光强和温度对植株光合机构遭到破坏.2 种石斛的光合作用日变化特点与兰属植物的研究结果也是基本相似的[7-8].
2.4 束花石斛、黄花石斛叶绿素荧光相关参数日变化
2 种石斛叶片的Fv/Fm日变化趋势相似,全天基本呈“V”型(图4). 早上7:00—11:00 随着光照强度和气温的增加,Fv/Fm逐渐下降,在13:00 下降到一天中的最小值.之后随着光强和温度的逐渐降低,Fv/Fm值迅速回升.这表明石斛兰光合作用的器官在中午光强和温度较高下其光合活性受到了暂时的抑制,但光合器官并没有受到损伤.
2 种石斛的Fo的日变化趋势也基本一致,全天呈波动下降状态(图4).从早上7:00 开始,Fo均呈缓慢下降趋势,大约都在13:00 左右达到最低值,表明此时热耗散增加[18-21],但束花石斛15:00 左右又有一小的上升波峰,之后又趋于下降.这些结果均表明,2 种石斛叶片都可以通过增强非辐射能量耗散来消耗过剩的光能,从而使光合机构免受破坏.
束花石斛、黄花石斛的Yield日变化在中午13:00 左右出现一低谷,之后又逐渐上升(图4).Yield日变化幅度在0.35~0.65 之间变动.
叶绿素荧光参数可以反映光合机构内部一系列重要的调节过程. Fv/Fm的降低是判断植物受光抑制的重要标准[19-22],2 种石斛的Fv/Fm值变化呈“V”型,表明它们光合作用的器官的光合活性受到了暂时的抑制,但未受到损伤. Fo的日变化表明它们都可以通过增强非辐射能量耗散来消耗过剩的光能,从而使光合机构免受破坏.
2.5 束花石斛、黄花石斛叶绿素含量和光合关键酶活性的变化
束花石斛、黄花石斛叶片总Chl 含量约为1.50 mg/g 左右,Chl(a/b)的比值在2.50~2.60 之间变化(表2).HOLDEN[23]广泛地比较了C3植物和C4植物的叶绿素a/b 值,结果认为,C4植物比C3植物具有较高的叶绿素a/b 值,特别是在单子叶植物中,差别更为明显,因为在单子叶C4植物维管束鞘细胞中叶绿体的叶绿素a/b 值比叶肉细胞高. C4植物甘蔗叶片的叶绿素a/b 值高达4 以上.石斛属也是单子叶植物,2 种石斛叶片表现出典型的C3植物叶绿素Chl(a/b)比值特点.
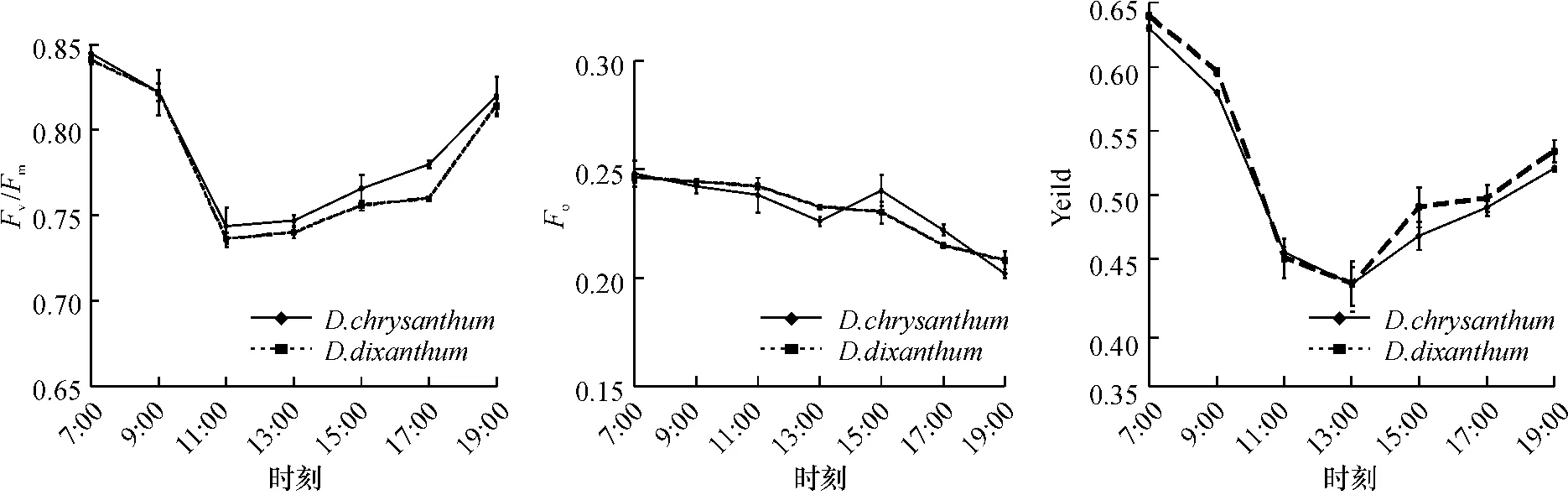
图4 束花石斛和黄花石斛叶绿素荧光相关参数日变化Figure 4 The daily curve of chlorophyll fluorescence parameters in D.chrysanthum and D.dixanthum
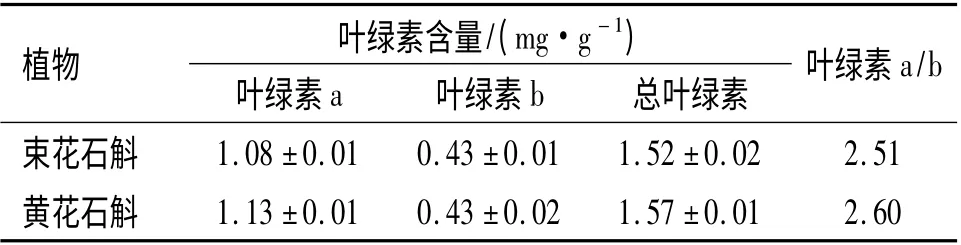
表2 束花石斛和黄花石斛叶绿素含量的变化Table 2 The chlorophyll content and ratio of leaves of D.chrysanthum and D.dixanthum
酶活性的测定结果表明(表3),2 种石斛兰的PEPCase 活性非常低,分别为1. 17 和1. 21 nmol/(mg·min). PEPCase 是C4和CAM 植物的主要标志酶之一,在C4植物甘蔗叶片中活性高达100 nmol/(mg·min)以上,而在C3植物中PEPCase 活性极低.这一研究结果与EDWARDS 等[24]的结果以及作者测定兰属植物的结果也是一致的[7-8],说明2 种石斛应该是C3光合途径植物,不太可能是C4和CAM 植物. 而它们都具有较高的RuBPCase 和GO 活性,说明它们是典型的C3光合途径植物,且具有较高的光呼吸.
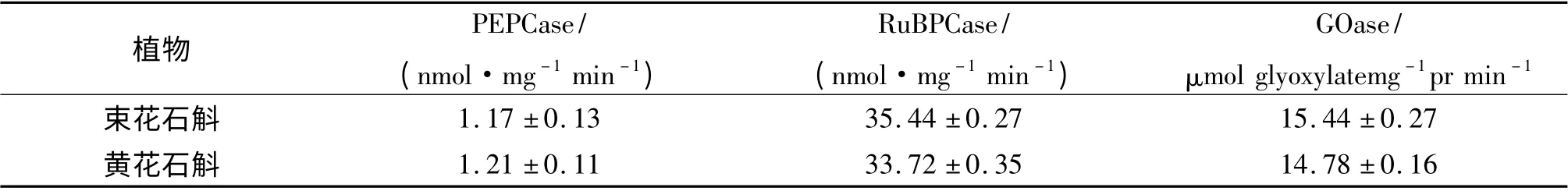
表3 束花石斛和黄花石斛叶片光合关键酶活性Table 3 The activities of key emzymes of phtotosynthesis in leaves of D.chrysanthum and D.dixanthum
2.6 束花石斛、黄花石斛光合速率的年变化
束花石斛、黄花石斛叶片的光合作用Pn季节变化规律比较相似(图5),呈单峰曲线,3月以后,Pn逐渐增加,6—7月Pn达到最高,9月以后缓慢下降,11月以后下降较快.2 种石斛在6—7月光合作用最强,这可能与这个季节环境温度和光强都较为适合石斛的光合作用以及叶片的生长成熟等等因素有关.1—2月和11—12月Pn值比较低,可能是因此段时间环境温度、光强较低,且石斛兰叶片尚在发育过程中,造成光合强度较低表现为Pn较低. 石斛兰Pn季节变化总之5—8月是石斛兰生长发育旺盛期.

图5 束花石斛和黄花石斛净光合速率年变化Figure 5 Pn Annual change of D. chrysanthum and D. dixanthum
总之,对束花石斛和黄花石斛叶片的结构、光合特性、标志性酶活性等的研究结果表明:两者属于典型的C3植物.
[1]徐云鹃,于力文,吴庆生,等. 安徽省霍山县3 种石斛的光合特征[J].应用生态学报,1993,4(1):18-21.
[2]丑敏霞,朱利泉,张玉进,等. 不同光照强度和温度对金钗石斛生长的影响[J]. 植物生态学报,2001,23(5):325-330.
[3]苏文华,张光飞. 金钗石斛光合作用特征的初步研究[J].中药材,2003,26(3):157-159.
[4]苏文华,张光飞. 铁皮石斛叶片光合作用的碳代谢途径[J].植物生态学报,2003,27(5):631-637.
[5]HEW C S,YE Q S,PAN R C. Pathway of carbon fixation in some thin- leaved orchids[J]. Lindleyana,1989,4(3):154-157.
[6]叶庆生,潘瑞炽,丘才新.墨兰叶片结构及光合作用的研究[J].植物学报,1992,34(10):771-776.
[7]叶庆生,潘瑞炽,丘才新.墨兰光合途径的研究[J].植物学报,1993,35(6):441-446.
[8]叶庆生,潘瑞炽,丘才新. 兰属植物光合途径的研究[J].热带亚热带植物学报,1996,6(1):25-29.
[9]潘瑞炽,叶庆生. 国兰生理[M]. 北京:科学出版社,2006.
[10]PAN R C,YE Q S,HEW C S. Physiology of cymbidium sinense:A review[J]. Scientia Horticlturea,1997,70:123-129.
[11]陈心启,吉占和,罗毅波. 中国野生兰科植物彩色图鉴[M].北京:科学出版社,1999.
[12]WINTERMANS J,DE- MOTS A. Spectrophotometric characteristic of chlorophyll a and chlorophyll b and their pheophytins in ethanol[J]. Biochim Biophys Acta,1965,109:448-453.
[13]许大全.光合作用及其有关过程对长期高CO2浓度的响应[J].植物生理学通讯,1994,30(2):81-87.
[14]BLANKE M M. Comparative SEM study of stomata and surface morphology in apple[J]. Angewandte Botanik,1987,61:433-438.
[15]蔡永萍,李玲,李合生,等.霍山县3 种石斛叶片光合光合作特性及其对光强的响应[J]. 中草药,2005,36(4):586-590.
[16]曹军胜,刘广全. 刺槐光合特性的研究[J].西北农业学报,2005,14 (3):519-524.
[17]张方,迟伟,金成哲,等.高粱C4型磷酸烯醇式丙酮酸羧化酶基因的分子克隆及其转基因水稻的培育[J].科学通报,2003,48:1542-1546.
[18]DEMMIG-ADAMS B,ADAMS III WW. Photoprotection and other responses of plants to high light stress[J]. Ann Rev Plant Physiol Plant Mol Biol,1992,43:599-626.
[19]KRAUSE G H,WEIS E. Chlorophyll fluorescence as a tool in plant physiology II:Interpretation of fluorescence signals[J]. Photosynth Res,1984,5:139-157.
[20]KRAUSE G H,WEIS E. Chlorophyll fluorescence and photosynthesis:The basics[J]. Ann Rev Plant Physiol Plant Mol Biol,1991,42 :313-349.
[21]CRITCHLEY C,RUSSELL A W. Photoinhibition of photo synthesis invivo:The role of protein turnover in photo system II[J]. Physiol Plant,1994,92:188-196.
[22]POWLES S B. Photoinhibition of photosynthesis induced by visible light[J]. Ann Rev Plant Physiol Plant Mol Biol,1984,35:15-44.
[23]HOLDEN M. Chloroplast pigment in plants with the C4-dicaboryllic acid pathway of photosynthesis[J]. Photosynthetica,1973,7:14-49.
[24]EDWARDS G,WALKER D.C3,C4:Mechanisms,Cellular and Environmental Regulation of Photosynthesis[M]. Oxford:Blackwell,1983:542.

