超声诊断直径≥1 cm胆囊病变性质的Logistic回归分析
陈晓然 CHEN Xiaoran
唐少珊 TANG Shaoshan
于冬梅 YU Dongmei
刘 站 LIU Zhan
胆囊隆起样病变(apophysis lesions of gallabladder,ALG)是来源于胆囊壁并向胆囊腔内局限性突起的一类病变的总称,成人患病率约为5%[1]。超声是诊断胆囊疾病的首选影像检查方法,但其在判断病变性质上仍有一定的局限性。本研究通过对165例直径≥1 cm胆囊隆起样病变建立二分类Logistic回归模型,筛选有助于鉴别此类病变良、恶性的主要相关超声特征,探讨这些超声特征鉴别诊断直径≥1 cm胆囊隆起样病变良、恶性的价值。
1 资料与方法
1.1 研究对象 选择2006-01~2012-04在中国医科大学附属盛京医院接受手术治疗的165例直径≥1 cm胆囊隆起样病变患者,其中男60例,女105例;年龄21~80岁,平均(45.5±12.1)岁;病变最大径1.0~5.8 cm,平均(1.46±0.76)cm。所有患者术前均行二维超声及彩色多普勒超声检查,术后均经病理证实。
1.2 仪器与方法 使用Toshiba Aplio或GE Logiq 9彩色多普勒超声诊断仪,使用宽频凸阵探头,中心频率为3.5 MHz。记录病变数量、大小、形态、基底、内部回声、有无合并胆囊结石、胆囊壁回声是否连续及彩色多普勒血流显像(CDFI)是否检出血流信号。
1.3 二分类Logistic回归模型的建立 以术后病理结果为“金标准”,以病理结果良、恶性作为因变量,Logistic回归赋值分别为0和1,将下述超声特征作为自变量建立Logistic模型(纳入标准:P<0.05,排除标准:P>0.1),采用前进法进行逐步回归。赋值标准:X1为性别(男=0;女=1),X2为年龄(直接使用记录值),X3为病灶数量(≥2个=0;单发=1),X4为病灶大小(多发者取最大者)(直接使用测量值),X5为形态(规整=0;欠规整=1),X6为基底宽窄(窄 =0;宽=1),X7为是否合并胆囊结石(否=0;是=1),X8为胆囊壁是否连续(是=0;否=1),X9为CDFI是否检出血流信号(未检出明显血流=0;可检出血流=1)。
1.4 统计学方法 采用SPSS 13.0软件,对回归参数估计值采用Wald χ2检验,用ROC曲线评价Logistic回归模型的预测能力,并拟合散点图得出logit(P)作为鉴别良、恶性的临界值[2],P<0.05表示差异有统计学意义。
2 结果
2.1 病理结果 165例病变中,恶性16例,其中腺肌症恶变1例,腺瘤恶变6例,腺癌9例;良性149例,其中胆固醇性息肉105例,腺瘤28例,腺肌增生症10例,结石2例,化生性息肉1例,慢性胆囊炎2例,增生性息肉1例。
2.2 良、恶性病变灰阶超声及CDFI表现 良性病灶形态多规整,11例呈分叶状,107例呈条状,27例呈球状,4例呈半球状;恶性组病灶形态多不规整,6例簟伞型,4例胆囊壁局部隆起,6例不规则状;良性组104例有或似有细蒂与胆囊壁相连,恶性组15例为宽基底;良性组病灶CDFI血流检出率为11.4%(17/149),恶性组检出率为81.2%(13/16),两组检出率比较,差异有统计学意义(χ2=42.375, P<0.05)。
2.3 Logistic回归分析结果 以超声特征的评分为自变量,以病理类型良、恶性为因变量,构建二分类Logistic回归模型,采用前向似然比法进行逐步回归(表1)。二分类Logistic回归分析最后一步筛选出3个自变量:形态、基底宽度和CDFI是否检出血流信号,其模型为:Logit(P)=6.545+2.864X5+3.504X6+1.973X9。
以模型判断直径≥1 cm胆囊隆起样病变概率的预测值为预报值,以病理结果为“金标准”,绘制ROC曲线(图1),ROC曲线下面积为0.979,标准误为0.013,95% CI(0.953, 0.999),说明本研究预报较为准确(图2~4)。拟合的散点图(图5)示,以logit(P)值≥0.20判断为恶性、<0.20判断为良性作为标准时,准确度、敏感度、特异度分别为97.0%、93.8%、97.3%。
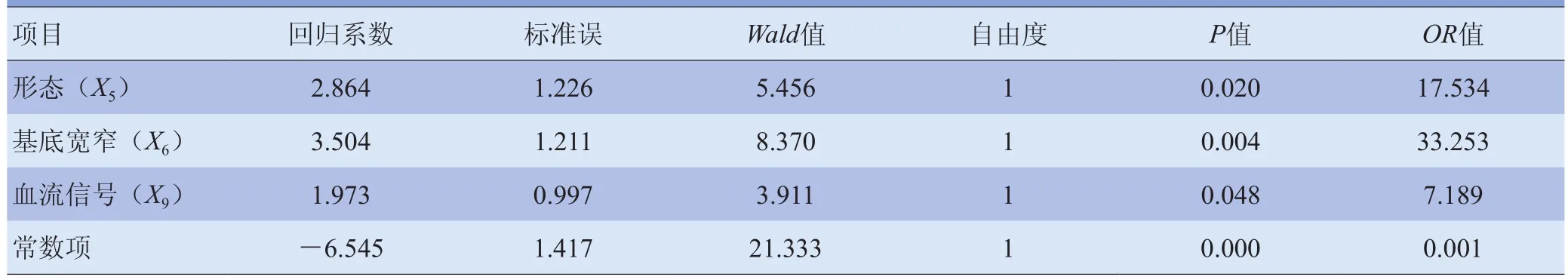
表1 二分类Logistic回归模型分析结果
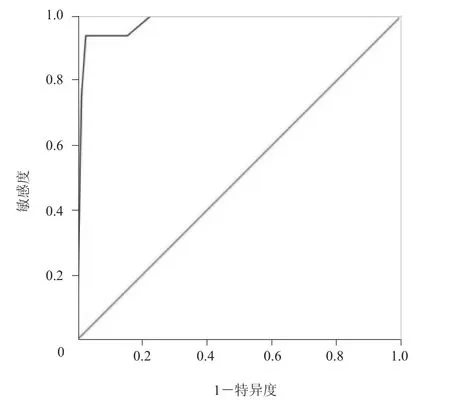
图1 Logistic回归模型对直径≥1 cm胆囊隆起样病变良、恶性预报能力的ROC曲线
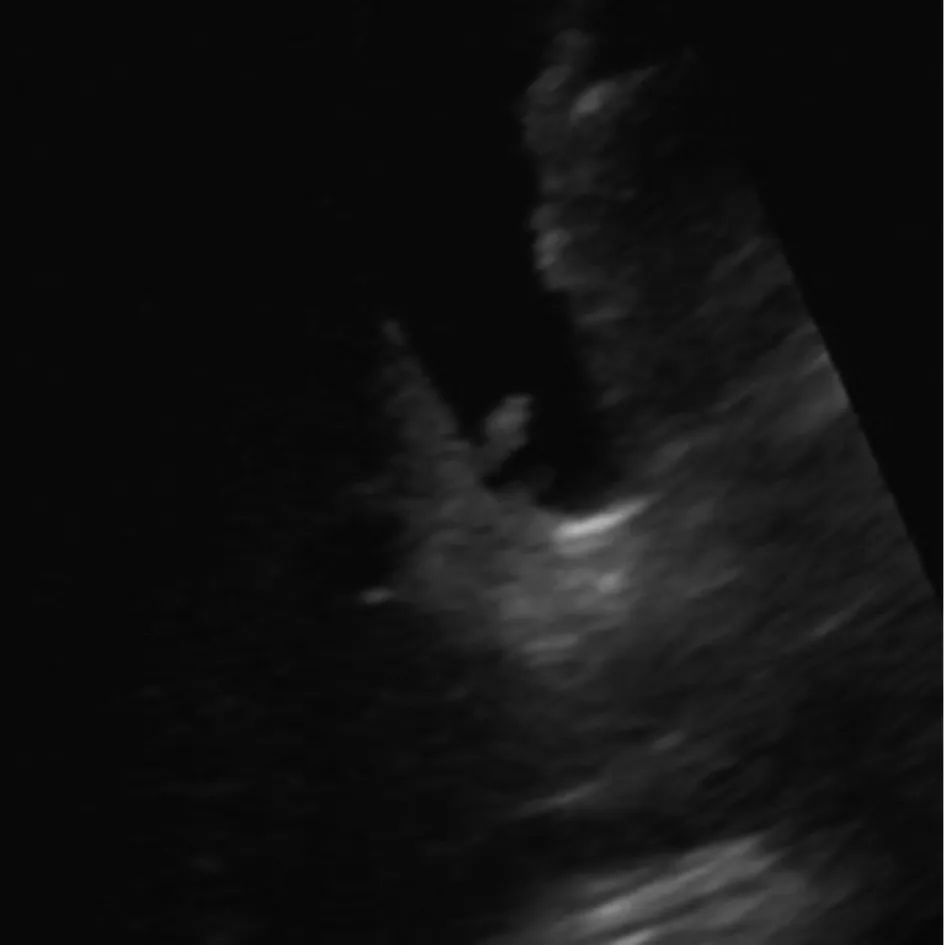
图2 胆囊近颈部附壁可见1.2 cm×0.7 cm中等回声突起(箭),形态规整(0分),基底窄(0分),CDFI未检出明显血流信号(0分),预测概率P=0.0014,病理证实为胆囊胆固醇性息肉
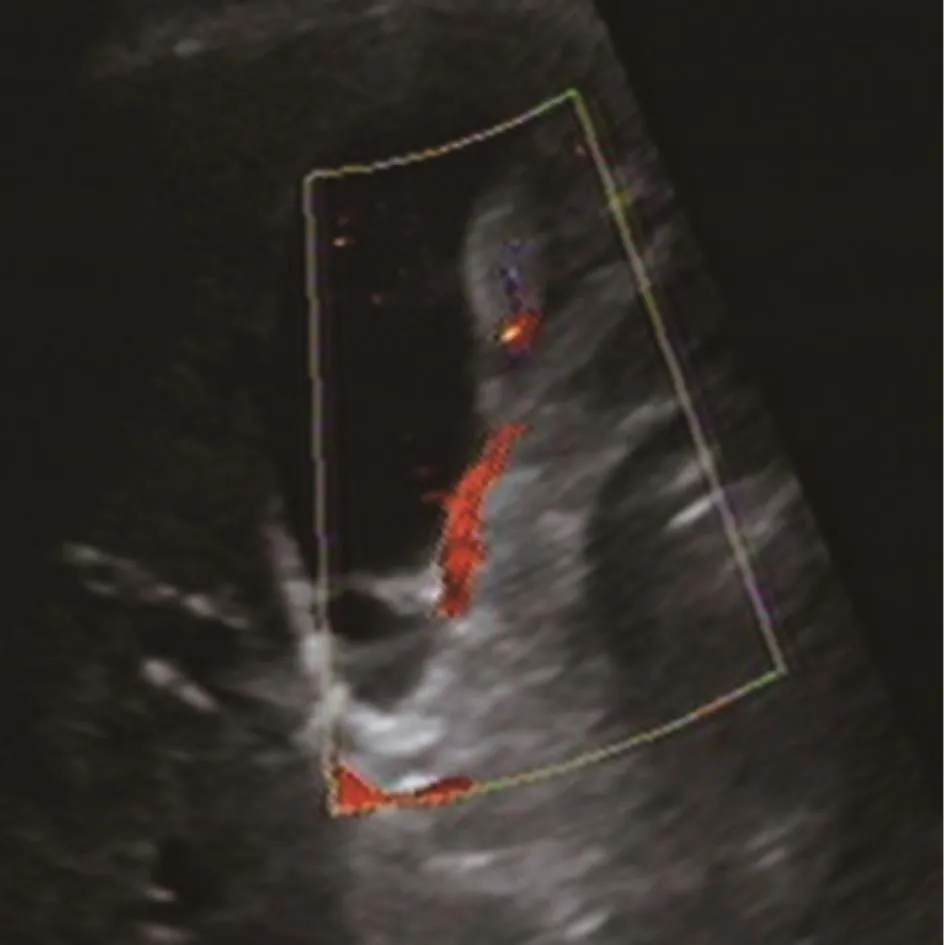
图3 胆囊内见2.7 cm×1.0 cm中等回声团(箭),形态规整(0分),基底窄(0分),CDFI可检出静脉血流信号(1分),预测概率P=0.0099,病理证实为胆囊管状腺瘤
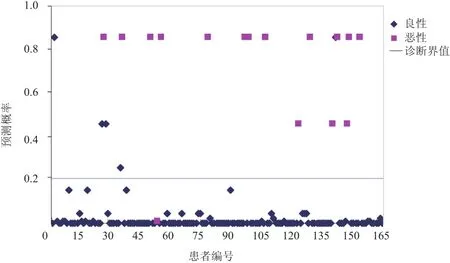
图5 Logistic回归模型的拟合情况
3 讨论
胆囊隆起样病变是基于形态学定义的一组疾病,病变直径≥1 cm、单发、广基底、无蒂、胆囊壁局限性增厚、年龄>60岁、合并胆囊结石、随访中病变体积增长速度较快,患者出现胆囊癌的危险性增高,应行手术治疗[3,4]。部分>1 cm或伴有结石的胆囊息肉在病理上表现为局灶上皮中-重度非典型增生,存在恶变倾向[5]。因此,对于直径>1 cm胆囊隆起样病变,为了防止漏诊胆囊癌、延误病情,临床上一旦发现多采取手术切除。不同病理类型的病变其临床治疗方案及预后不同[6]。对于术前考虑为良性的胆囊隆起样病变,目前临床上最常采用微创腹腔镜胆囊切除术,但部分患者术后出现“胆囊切除术后综合征”,即原有症状仍然存在,或再次出现上腹部不适、隐痛、消化不良等多种症状[7]。因此,对术前诊断考虑为良性胆囊隆起样病变的病例,手术切除的必要性值得商榷,特别是直径≥1 cm胆囊隆起样病变的术前定性诊断,对临床选择治疗方案尤为重要。
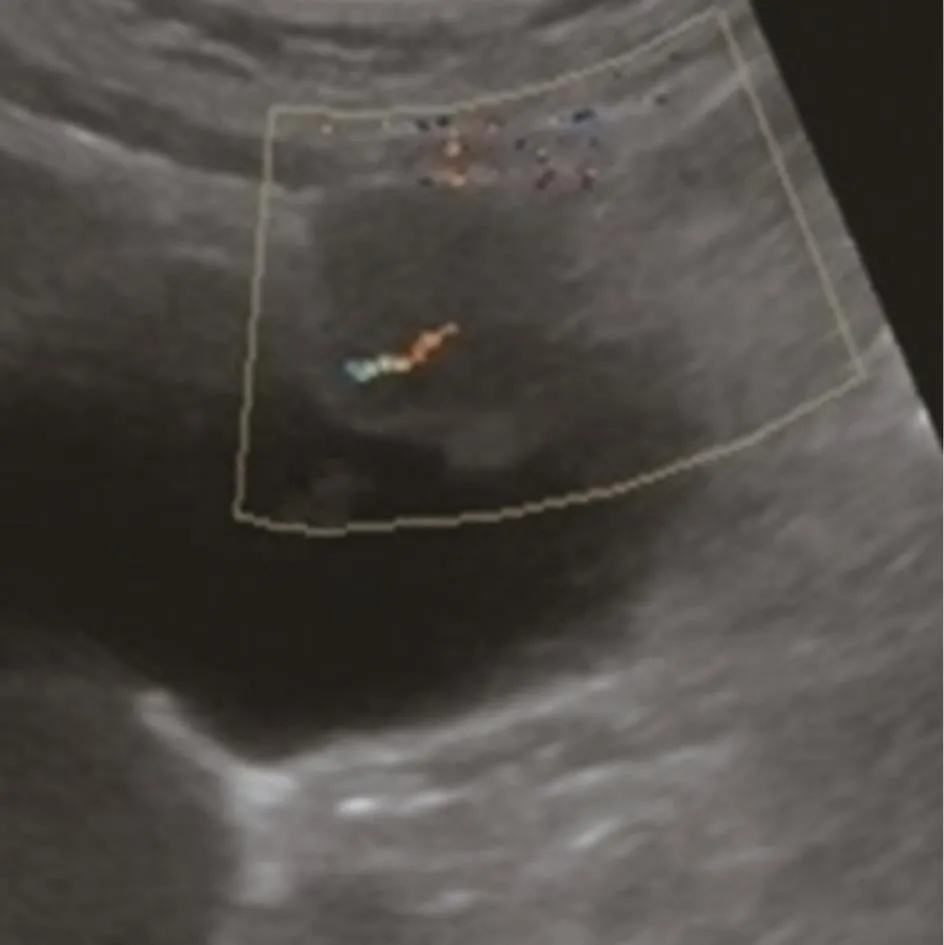
图4 胆囊底部可见3.0 cm×2.0 cm实性肿物(箭),形态不规整(1分),基底较宽(1分),CDFI检出血流(1分),预测概率P=0.8577,病理证实为胆囊腺癌(低分化)浸润全层
本研究中进入Logistic回归模型的超声特征有病灶形态、基底宽窄和CDFI是否检出血流信号。在病灶形态上,良、恶性胆囊隆起样病变区别较大:良性病变有分叶状、条状、球状和半球状,较为规整,而恶性病变有簟伞型、胆囊壁局部隆起和不规则形状;良性病变多有细蒂与胆囊壁相连,而恶性病变绝大部分为宽基底。本研究中病灶形态及基底宽窄的回归系数较高,分别为2.864、3.504,提示病灶形态及基底宽窄在良、恶性病变的鉴别诊断中起重要作用。
CDFI作为评价胆囊占位性病变血供的一种无创手段,可以通过检测病灶内的血供情况判断病灶的病理性质。CDFI观察胆囊隆起样病变病灶内的血流情况,在息肉、腺瘤等良性病变中血流显示率低,而在早期恶性隆起样病变中有较高的血流显示率,敏感性可达88%[8]。Obuz等[9]研究发现,检出血流信号鉴别早期胆囊恶性病变与良性胆囊隆起样病变的敏感度为84.6%,特异度为80.0%,提示CDFI是判断胆囊隆起样病变良、恶性的有效方法。本研究中良性病变CDFI血流检出率为11.4%,恶性病变检出率为81.2%,OR为7.189,即恶性病变的CDFI血流检出率约为良性病变的7倍。与多数恶性肿瘤血供特征相同,胆囊癌亦为动脉供血。胆囊癌血流丰富的病理基础是肿瘤内血管异常增生,胆囊动脉及其分支增粗、扩张,进而血流量增加;且肿瘤越大,血流越丰富。
本研究中Logistic回归模型的ROC曲线下面积为0.979,表明筛选出来的形态、基底宽窄和CDFI是否检出血流信号3个自变量对鉴别直径≥1 cm胆囊隆起样病变的良、恶性更具有相关性,因此,在临床诊断工作中观察胆囊病变时可以重点观察这3个特征,结合其他特征判断病变的性质。当回归值以0.2为临界值时,P≥0.20判断为恶性,<0.20判断为良性,准确度、敏感度和特异度分别为97.0%、93.8%、97.3%,能较好地预测直径≥1 cm胆囊隆起样病变的良、恶性,由此可以将Logistic回归方程作为一个计算机程序,构建鉴别此类病变良、恶性的计算机辅助诊断系统,为临床工作者作出更加科学、准确的诊断提供参考[10]。
本研究的不足之处是对于病灶基底宽窄的定义,由于目前国际上尚无统一标准,本研究的判断较为主观。此外,本研究样本量较小,特别是恶性病例数偏少,样本量及人群发病率等因素会对Logistic回归模型的准确度产生影响,故对直径≥1 cm胆囊隆起样病变超声鉴别诊断良、恶性的二分类Logistic回归模型尚需大样本、多中心研究证实。近年来,国内外对不同病理类型的胆囊隆起样病变超声造影特征的研究逐渐增多,超声造影可以提高疾病的诊断准确性,是常规超声造影的有益补充,尤其在鉴别诊断胆囊病变良、恶性中具有一定的优越性[11-13]。本研究未能将超声造影指标纳入自变量,将在后续研究中进一步探讨。
总之,二分类Logistic回归分析能够筛选出对鉴别诊断直径≥1 cm胆囊隆起样病变良、恶性有意义的超声特征;病变形态、基底宽窄及CDFI是否检出血流信号对鉴别诊断病变的良、恶性有重要价值。
[1] Myers RP, Shaffer EA, Beck PL. Gallbladder polyps:epidemiology, natural history and management. Can J Gastroenterol, 2002, 16(3): 187-194.
[2] 唐熙, 王丰. 乳腺实性肿块超声良恶性鉴别诊断的Logistic回归模型. 中华医学超声杂志(电子版), 2010, 7(6): 1023-1028.
[3] Koga A, Watanabe K, Fukuyama T, et al. Diagnosis and operative indication for polypoid lesions of the gallbladder.Arch Surg, 1988, 123(1): 26-29.
[4] Terzi C, Sökmen S, Seçkin S, et al. Polypoid lesions of the gallbladder: report of 100 cases with special reference to operative indications. Surgery, 2000, 127(6): 622-627.
[5] 何婉媛, 王文平, 毛枫, 等. 彩色多普勒超声对胆囊疾病的诊断价值. 中国超声医学杂志, 2003, 19(8): 610-613.
[6] Gallahan WC, Conway JD. Diagnosis and management of gallbladder polyps. Gastroenterol Clin North Am, 2010, 39(2):359-367.
[7] Madácsy L, Fejes R, Kurucsai G, et al. Characterization of functional biliary pain and dyspeptic symptoms in patients with sphincter of Oddi dysfunction: effect of papillotomy. World J Gastroenterol, 2006, 12(42): 6850-6856.
[8] 肖子深. 超声和CT诊断胆囊息肉样病变的对照分析. 中国医学影像技术, 2002, 18(7): 667-668.
[9] Obuz F, Altay C, Sagol O, et al. Erratum to: MDCT fi ndings in neuroendocrine carcinoma of the gallbladder: case report.Abdom Imaging, 2011, 32(1): 105-107.
[10] 王丰. 应用高频和彩色多普勒超声鉴别甲状腺结节良恶性的Logistic回归模型. 中国医学影像学杂志, 2010, 18(5):474-477.
[11] Xie XH, Xu HX, Xie XY, et al. Differential diagnosis between benign and malignant gallbladder diseases with real-time contrast-enhanced ultrasound. Eur Radiol, 2010, 20(1): 239-248.
[12] Inoue T, Kitano M, Kudo M, et al. Diagnosis of gallbladder diseases by contrast-enhanced phase-inversion harmonic ultrasonography. Ultrasound Med Biol, 2007, 33(3): 353-361.
[13] Numata K, Oka H, Morimoto M, et al. Differential diagnosis of gallbladder diseases with contrast-enhanced harmonic gray scale ultrasonography. J Ultrasound Med, 2007, 26(6): 763-774.

