MRI对剖宫产术后子宫瘢痕妊娠的诊断价值
李彩霞 LI Caixia
常慧贤 CHANG Huixian
金 艳 JIN Yan
剖宫产术后子宫瘢痕妊娠(CSP)指剖宫产术后再次妊娠,妊娠囊或胚囊着床于既往子宫切口瘢痕处,是异位妊娠最罕见的一种[1]。CSP是剖宫产的重要远期并发症之一,近年来随着剖宫产率的升高,其发病率也逐年上升。CSP的临床表现缺乏特异性,易漏诊或误诊。若临床诊断不明,以宫内早期妊娠行人工流产或药物流产时,可能发生子宫破裂、大出血,甚至危及生命;若及时诊断,及时处理,则可以有效降低并发症的发病率,保留患者的生育功能。因此及时诊断、及时治疗至关重要。目前应用MRI诊断CSP国内报道少见,本文回顾性分析我院经临床病理证实为CSP的10例患者的MRI表现,以期为CSP的早期诊断提供依据。
1 资料与方法
1.1 研究对象 2010-12~2012-05河南省焦作市第二人民医院收治住院的临床资料完整的剖宫产术后子宫瘢痕妊娠患者10例,年龄26~36岁,平均(29.2±3.6)岁。既往剖宫产次数1~2次,均为子宫下段横切口剖宫产。此次瘢痕妊娠距上次剖宫产时间间隔2~10年,平均(4.5±1.3)年;患者均有停经史,停经时间42~91 d,平均(58.2±12.8) d。阴道不规则出血4例,药物流产后出血不净、出血量增加就诊1例,人工流产后阴道出血1例,轻微下腹痛4例。尿人绒毛膜促性腺激素(HCG)均阳性,血HCG明显升高,为161.4~191664.0 IU/L。10例均经手术及病理证实。患者均无心、肺、肝、肾等慢性疾病。
1.2 仪器与方法 采用GE HDx 1.5T超导型MR仪,使用体部表面线圈,自耻骨联合下缘扫描至子宫底部。FSE序列行轴位T1WI,TR/TE 440/8 ms,层厚6 mm, 间距1 mm,矩阵 512×512,视野(FOV) 28 mm; 压脂快速恢复快速自旋回波(FRFSE)序列行轴位T2WI,TR/TE 3640/136 ms,层厚6 mm,间距1 mm,矩阵 512×512,FOV 28 mm;FRFSE序 列 行 矢 状 位 T2WI,TR/TE 3200/132 ms,层厚3 mm,间距0.5 mm,矩阵 512×512,FOV 26 mm;压脂FRFSE序列冠状位T2WI,TR/TE 3740/134 ms,层厚5 mm,间距1 mm,矩阵 512×512,FOV 38 mm。7例行DWI检查,b值=700 s/ mm2,TR/TE 4000/70 ms,矩阵 256×256,FOV 40 mm。
1.3 治疗与病理 10例中6例临床均行介入子宫动脉栓塞术,术中见双侧子宫动脉增粗、迂曲,盆腔中央相当于胎盘植入处子宫肌层局灶性造影剂浓染、外溢。行氨甲蝶呤灌注治疗,明胶海绵动脉栓塞,1周后行清宫术,血HCG降至正常后出院。4例保守治疗,局部运用氨甲蝶呤及口服米非司酮,尿HCG转阴后再行宫腔镜下清宫术,刮出物病理提示为蜕变绒毛组织。出院后每周检测1次血HCG水平,未行病灶清除术者每周行1次B超检查,直至血HCG转阴(<51 IU/L)和病灶消失;电话随访月经复潮时间。
2 结果
①病变部位:病灶均位于子宫前下壁子宫峡部,局部可见剖宫产瘢痕,呈稍长T1稍短T2信号影,邻近瘢痕处可见妊娠囊(图1D、2D)。②病灶大小及形态:病灶呈圆形或类圆形;本组病例最小病灶大小约15 mm×12 mm×16 mm,最大约50 mm×32 mm×37 mm(图 2)。③病变边界:7例MRI显示病灶边界清晰,表现为妊娠囊包膜完整,为等或稍长T1等长T2环形信号影,T2WI序列显示更清晰(图1);3例境界模糊,妊娠囊包膜不完整,表现为等或稍长T1信号,稍长、等或稍短T2信号(图2)。④病灶内信号特点:病灶内信号不均匀,表现为混杂长T1混杂长T2信号影,其中可见多发囊泡状长T1长T2信号影。⑤与子宫瘢痕、宫腔、宫颈管及邻近子宫壁关系:7例妊娠囊位于子宫峡部瘢痕上,主要向宫腔内生长,植入子宫壁较浅,与局部子宫肌层分界清晰,子宫壁相对较厚;3例妊娠囊种植于瘢痕深部,向子宫肌层生长或同时向子宫肌层及宫腔生长(图1、2)。妊娠囊植入子宫肌层比较深,与局部肌层粘连较严重,较小妊娠囊甚至完全生长于瘢痕处子宫肌层内。妊娠处子宫壁明显较薄,较大妊娠囊可突出于子宫轮廓外压迫膀胱。⑥扩散加权成像(DWI):7例行DWI表现为不均匀增高影(图1C、2C)。⑦其他:子宫体积增大,子宫内膜增厚(图1D、2D)。子宫腔内可见长T1长T2信号积液或稍短T1长T2、短T1短T2、等T1长T2信号积血。
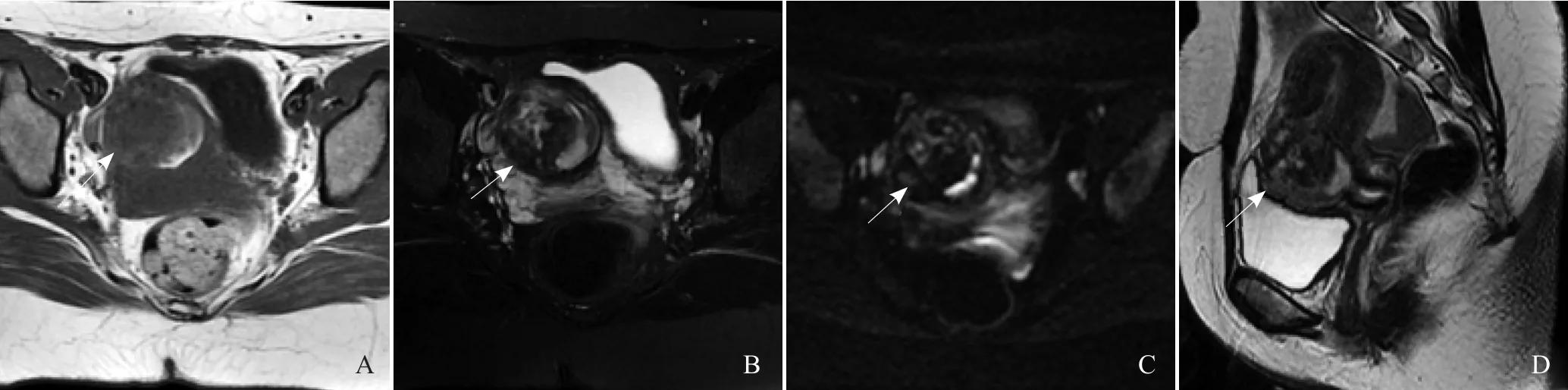
图1 患者女,30岁,停经61 d,行剖宫产术2次。A、B为横轴位T1WI和压脂T2WI,宫腔内可见类圆形长T1长T2妊娠囊(箭),大小约48 mm×39 mm×47 mm,囊壁光整,内信号不均匀,见多发囊泡状长T1长T2信号影;C. DWI序列,表现为不均匀高信号(箭);D.矢状位T2WI,妊娠囊位于子宫峡部瘢痕上,同时向子宫肌层及宫腔生长,妊娠囊植入子宫肌层比较深,局部肌层菲薄,向前压迫充盈的膀胱,子宫内膜增厚(箭)
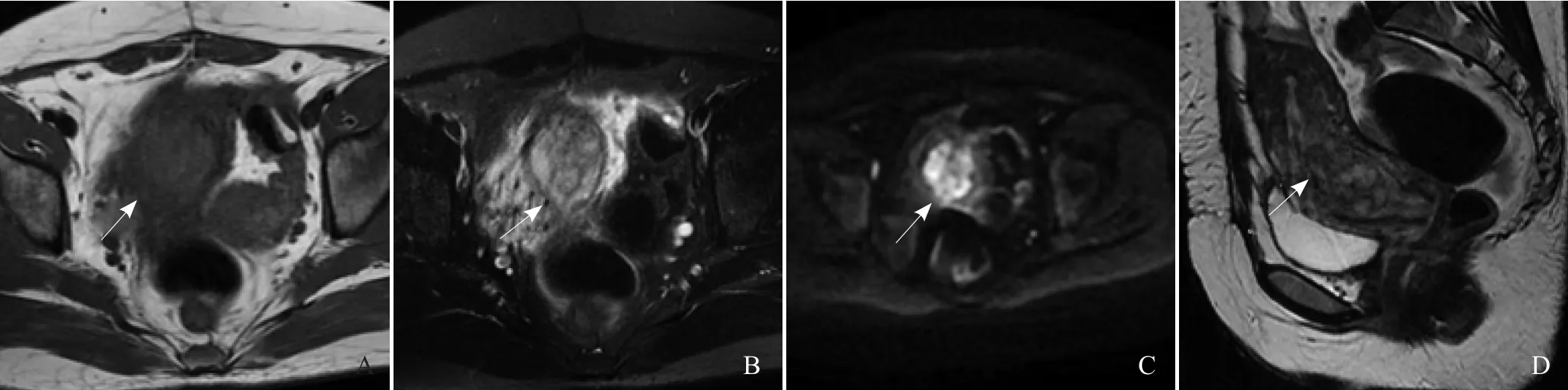
图2 患者女,34岁,停经74 d,阴道不规则出血15 d,药物流产后持续阴道流血3 d,2年前行剖宫产术2次。A、B为横轴位T1WI和压脂T2WI,子宫体积增大,内膜增厚,子宫前壁局限性变薄,信号不均,局部见长圆形长T1长T2妊娠囊(箭),大小约50 mm×32 mm×37 mm,向肌壁和宫腔内生长,宫腔面毛糙;C. DWI序列,表现为不均匀高信号(箭);D. 矢状位T2WI,妊娠囊植入子宫肌层比较深,局部肌层菲薄,向前压迫膀胱(箭)
3 讨论
3.1 病因及发病机制 CSP病因尚不明确,多认为与手术损伤子宫内膜,子宫切口愈合不良,形成瘢痕有关。再次妊娠时孕卵穿透瘢痕处的微小裂隙并在瘢痕处着床发育,由于瘢痕处无正常肌层和内膜,底蜕膜发育不良或缺损,子宫肌层被滋养细胞直接侵入,使绒毛与子宫肌层粘连植入,甚至穿透子宫肌层,到达浆膜层[2]。由于局部血管异常丰富,手术瘢痕缺乏正常子宫肌层又不能有效止血,所以清宫时极易出现难以控制的大出血。
3.2 MRI表现特点 超声是目前诊断CSP的首选影像学方法,经阴道超声较腹部超声检查准确率高,但孕妇要慎行阴道检查,且超声很难对肌层及宫旁组织的病变进行全面评价[3]。
目前MRI检查只是作为超声诊断存在疑问或为进一步明确诊断时的补充手段。而MRI的高度软组织分辨率和多序列、多参数、多方位成像特点,在评估盆腔脏器结构方面具有独特优势,对临床诊断具有重要指导意义[4]。MRI可以通过任意方位成像清晰显示子宫下段前壁内的妊娠囊,分辨子宫内膜腔、剖宫产手术瘢痕和孕囊的关系,还可以进一步明确孕囊的位置、子宫肌层的厚度及是否有绒毛侵入邻近脏器,并通过测量孕囊的大小,观察病灶内信号特点、病灶与周围组织的解剖关系及子宫周围有无出血,是保守治疗及治疗期间的有效监测手段[5]。另外,MRI能准确提示病灶的定位穿刺部位,对病变进行疗效评估有较高的参考价值[6]。
本研究中剖宫产术后子宫瘢痕妊娠表现为以下两种形式[7]:一种是孕囊种植于子宫峡部瘢痕上,主要向宫腔内生长,植入子宫壁较浅,与局部子宫肌层分界清晰,子宫壁最薄处相对较厚,可发展为活产[8],但也增加了植入部位大出血危险;另一种是孕囊种植于瘢痕深部,向子宫肌层生长或同时向子宫肌层及宫腔生长,妊娠囊植入子宫肌层较深,局部肌层明显变薄,胎盘植入,与局部肌层粘连较严重,较小妊娠囊甚至完全生长于瘢痕处子宫肌层内。妊娠处子宫壁最薄处明显较薄,较大妊娠囊可突出于子宫轮廓外压迫膀胱,甚至突破子宫肌层侵及膀胱肌层,早期即可出现子宫穿孔、破裂或难以控制的大出血。
本研究10例中6例临床均行介入子宫动脉栓塞术,采用氨甲蝶呤灌注治疗;4例局部运用氨甲蝶呤及口服米非司酮,其中1例入院前药流后阴道不规则流血,1例人工流产后阴道流血,均手术成功,出血量少,提示应对有剖宫产史的早孕患者行超声或MRI检查除外CSP。
3.3 鉴别诊断 ①难免流产:子宫增大,孕囊脱落入子宫峡部宫腔内,但胎囊变形,胎儿多已死亡,孕囊可不侵及肌层,子宫峡部前壁切口处肌层未见改变,血供不丰富,HCG水平下降,同时伴阵发性腹痛,阴道出血等。②宫颈妊娠:宫颈管膨大,内可见孕囊,宫颈内口紧闭,子宫前壁下段肌层完整,子宫峡部切口处血供不丰富。③恶性滋养细胞肿瘤:与瘢痕妊娠影像上均表现为肌层信号混杂,血供丰富,鉴别较困难。应注意结合临床病史和血HCG的动态变化进行鉴别,滋养细胞肿瘤患者多在产后葡萄胎清宫后半年发病,血HCG异常增高还可形成卵巢黄素化囊肿或远处肺转移,而CSP有剖宫产史,停经史再结合HCG检测可以诊断[9]。
总之,CSP确诊后应立即住院,终止妊娠[10]。由于CSP发病率较低,临床罕见,目前尚无统一的治疗方案,主要治疗方法有药物治疗、介入子宫动脉栓塞术、手术治疗及联合治疗等。
[1] Fylstra, Donald L. Ectopic pregnancy within a cesarean scar: a review. Obstet Gynecol Surv, 2002, 57(8): 537-543.
[2] Ash A, Smith A, Maxwell D. Caesarean scar pregnancy. BJOG,2007, 114(3): 253-263.
[3] Jurkovic D, Hillaby K, Woelfer B, et al. First-trimester diagnosis and management of pregnancies implanted into the lower uterine segment cesarean section scar. Ultrasound Obstet Gynecol, 2003, 21(3): 220-227.
[4] Lam G, Kuller J, Mcmahon M, et al. Use of magnetic resonance imaging and ultrasound in the antenatal diagnosis of placenta accrete. J Soc Gynecol Investig, 2002, 9(1): 37-40.
[5] 张弦, 代敏, 严志汉, 等. MRI对剖宫产子宫瘢痕妊娠的影像分析. 实用放射学杂志, 2011, 27(9): 1380-1382.
[6] 石华亮, 庞倩芸, 卢再鸣. 剖宫产瘢痕妊娠的MRI特点及MRI对其诊治指导价值. 中国临床医学影像杂志, 2011,22(1): 51-54.
[7] Vial Y, Petignat P, Holfeld P. Pregnancy in a cesarean scar.Ultrasound Obstet Gynecol, 2000, 16(6): 592-593.
[8] El-Matary A, Akinlade R, Jolaoso A. Caesarean scar pregnancy with expectant management to full term. J Obstet Gynaecol,2007, 27(6): 624-625.
[9] 宋玲, 龚明, 余本英. 经腹及经阴道超声联合应用对剖宫产术后切口瘢痕妊娠的价值. 上海医学影像杂志, 2010, 26(6):571.
[10] Ozkan S, Calişkan E, Ozeren S, et al. Three-dimensional ultrasonographic diagnosis and hysteroscopic management of a viable cesarean scar ectopic pregnancy. J Obstet Gynaecol Res,2007, 33(6): 873-877.

