金龟甲对蓖麻叶挥发物的触角电位和行为反应
李为争,杨 雷,申小卫,袁莹华,原国辉,罗梅浩,郭线茹
(河南农业大学植物保护学院,郑州 450002)
金龟甲对蓖麻叶挥发物的触角电位和行为反应
李为争,杨 雷,申小卫,袁莹华,原国辉*,罗梅浩,郭线茹
(河南农业大学植物保护学院,郑州 450002)
为了探明金龟甲偏爱选择有害非寄主植物蓖麻的原因,应用触角电位(EAG)仪和“Y”型嗅觉仪,分别测定了华北大黑鳃金龟、暗黑鳃金龟和铜绿丽金龟雌、雄虫对5种蓖麻叶挥发物的触角电位和选择行为反应。EAG测定结果表明,3种金龟甲雄虫对各处理挥发物的EAG反应值均比参照挥发物顺-3-己烯-醇强。华北大黑鳃金龟对邻苯二甲酸二丁酯和肉桂醛的EAG反应值相对较高,暗黑鳃金龟对苯甲醇的EAG反应值相对较高,铜绿丽金龟对邻苯二甲酸二丁酯和苯甲醇的EAG反应值相对较高。选择行为反应测定结果表明,当顺-3-己烯-醇与其他挥发物配对测试时,华北大黑鳃金龟对邻苯二甲酸二丁酯和肉桂醛2种蓖麻叶挥发物表现出明显的选择偏好,暗黑鳃金龟对蓖麻叶挥发物苯甲醇表现出明显的选择偏好,铜绿丽金龟则更偏好选择蓖麻的绿叶气味物质顺-3-己烯-醇。总之,蓖麻叶的挥发性物质与引诱金龟甲偏爱选择密切相关,且偏爱的挥发物因金龟甲的种类而异。
金龟甲;蓖麻;植物挥发物;触角电位(EAG);“Y”型嗅觉仪
精确定位寄主植物对植食性昆虫的种群繁衍具有重要的生物学意义[1]。通常将寄主植物分为取食寄主和产卵寄主两大类,植食性昆虫的成虫主要从取食寄主中获得生长发育所需的营养物质,而在产卵寄主上繁殖其后代[2]。一般来说,植食性昆虫的取食寄主和产卵寄主的种类十分有限,两者的范围往往也不完全一致。因此,植食性昆虫适时寻找到合适的取食寄主和产卵寄主,是其生命历程中尤为重要的环节[3]。在长期的进化过程中,植食性昆虫已经发展出了一系列特殊的行为和生理机制来识别和选择满足自身及其后代需要的植物,通过其灵敏的嗅觉、视觉、触觉和味觉系统感知寄主植物或非寄主植物的存在,从而做出趋向寄主植物或逃避非寄主植物的选择行为[4]。然而,也有一些例外,有些植食性昆虫会取食不适合自己的非寄主植物,或者将卵产在不适合其后代生存的非寄主植物上[5- 6],这种“错误”选择非寄主植物的现象有何特殊的生物学意义?
华北大黑鳃金龟Holotrichiaoblita、暗黑鳃金龟H.parallela和铜绿丽金龟Anomalacorpulenta是北方旱作区重要的农林地下害虫,成虫在植物或杂草的根际土壤中产卵,幼虫(蛴螬)在土壤中取食植物的地下部分[7]。我国农民在生产实践中发现,种植于田间的蓖麻Ricinuscommunis可大量诱杀多种金龟甲成虫[8],而从严格意义上说,蓖麻并不是金龟甲的寄主植物。进一步研究表明,3种金龟甲对蓖麻叶片均表现出比大豆、花生、甘薯等寄主植物明显的选择趋性[9- 11]。但蓖麻植株和叶片粗提物不仅对其幼虫有触杀毒性,而且成虫少量取食后也表现出中毒反应[12]。其他相关研究也表明,蓖麻植株和叶片提取物对天幕毛虫Malacosomaneustria和烟蚜Myzuspersicae[13]、斜纹夜蛾Prodenialitura和菜蛾Plutellaxylostella[14]、菜青虫Pierisrapae[15]、草地贪夜蛾Spodopterafrugiperda[16]和瓜绢螟Diaphaniaindica[17]等多种害虫也具有触杀毒性,其活性成分为蓖麻碱和毒蛋白,可作为新型的植物源杀虫剂[18],且蓖麻碱主要存在于蓖麻植株上部的新鲜叶片中[19]。金龟甲为什么会有这种趋向蓖麻叶片的“自杀行为”?金龟甲趋向这种有害非寄主植物的行为机制是什么?显然,探明这些问题不仅对于深入了解植食性昆虫与非寄主植物的关系,全面解析植食性昆虫与植物的关系等具有重要的理论意义,而且可以为发展金龟甲行为调控技术和创制成虫仿生行为调控产品,变地下害虫的地下防治幼虫为地上防治成虫等提供科学依据。
1 材料与方法
1.1 供试昆虫
选择华北大黑鳃金龟、暗黑鳃金龟和铜绿丽金龟3种金龟甲作为供试昆虫。每年6—8月金龟甲成虫发生高峰期,在河南农业大学科教园区农作物田采集成虫,鉴定种类和区分雌雄后带回室内分别饲养。饲养前取田间土壤过20目筛,烘干至恒重后均匀混入蒸馏水,将土壤含水量控制在18%—20%,然后放入l11 cm×w10 cm×h17 cm的养虫盒内,土壤厚度10 cm左右。每盒放入成虫约40头,饲喂新鲜花生叶片。
1.2 供试挥发物
供试挥发物共5种。包括邻苯二甲酸二丁酯(莱阳市双双化工有限公司)、肉桂醛(武汉盛世精细化学品有限公司)、顺-3-己烯-醇(北京舒伯伟化工仪器有限责任公司)、苯甲醇(天津市科密欧化学试剂开发中心)和2-苯乙醇(国药集团化学试剂有限公司),均是作者在前期研究中从蓖麻叶二氯甲烷索氏提取物中鉴定出的主要成分[20]。其中顺-3-己烯-醇也是其他植物中常见的绿叶气味,在昆虫与植物关系中具有重要作用[21],且已证明对多种金龟甲具有引诱活性[22- 24]。因此,本研究将顺-3-己烯-醇作为触角电位和行为反应测定的参照挥发物,另外4种挥发物作为处理挥发物。供试挥发物均为分析纯,分别分散于石蜡油(天津市凯通化学试剂有限公司)中,配制成0.01 mol/L溶液,密封保存于4℃下备用。
1.3 触角电位测定
采用触角电位仪测定。触角电位仪(MY-15)由微电极交/直流放大器(Syntech AC/DC UN-06)、刺激气流控制器(Syntech CS-05)和微动操作仪(Syntech MP-15)组成,两根Ag/AgCl电极分别作为参比电极和记录电极。取健康活泼的金龟甲成虫,选取一根触角由基部切下,并切除触角端部末梢,立即将离体触角两端用导电胶粘在两根电极上,然后调试仪器,待基线平稳后进行测定。
测定时取处理挥发物20 μL均匀滴加在5 cm×4 mm长形滤纸条上,纵向对折后放入进样管。然后对触角进行气味脉冲刺激,连续洁净空气的流量为80 mL/min,刺激气体流量为30 mL/min,每次刺激时间为0.2 s,两次刺激间隔30 s以上。随机抽取供试挥发物样品进行测试,均以20 μL石蜡油为对照,以顺-3-己烯-醇为标准参照物。共测试3种金龟甲,每种金龟甲均按雌、雄虫分别进行测试,每种挥发物测试10根触角,同一挥发物在每根触角上重复测试3次。
1.4 行为反应测定
采用“Y”型嗅觉仪测定。嗅觉仪主臂和侧臂长均为20 cm,内径4 cm,两侧臂夹角75°。主臂端与循环水真空抽气泵连接,抽气速度调节为600 mL/min。用硅胶管将两侧臂分别与盛放样品的玻璃管、活性炭管串联起来。两个玻璃管分别放置滴有处理和对照挥发物的滤纸条,作为气味刺激源。根据金龟甲昼伏夜出的活动习性,全部测定安排在20∶00—23∶00进行。测定室空气洁净,温度为(25±2)℃,相对湿度为70%±5%,用红光作为观察光源。
测定时取处理挥发物20 μL滴加在上述长形滤纸条上,放入处理玻璃管内,对照玻璃管则放入滴加有20 μL石蜡油和顺-3-己烯-醇的滤纸条,分别作为对照和参照。然后在距主臂端口3 cm处放入1头饥饿24 h的金龟甲,连续观察10 min。若金龟甲进入任一侧臂内并停留1 min以上则记为已选择,若滞留在主臂内则记录为无选择。共测试3种金龟甲,每种金龟甲均按雌、雄虫分别进行测试,每种挥发物重复测试100头金龟甲。
1.5 数据分析
用Syntech公司提供的软件对不同处理的触角电位反应值进行标准化校正,然后按下列公式计算触角电位反应相对值:

按下列公式计算金龟甲对不同挥发物的选择反应频率:

采用Duncan′s多重比较法分析金龟甲对不同挥发物触角电位反应的差异显著性。用2测验分析金龟甲对Y形管两支臂样品选择频率的差异,无效假设为两支臂装载的气味化合物活性相当时,金龟甲进入两支臂的概率相等。因自由度为1,故计算2值时需进行连续性矫正,公式如下:
2 结果与分析
2.1 金龟甲对不同挥发物的触角电位反应
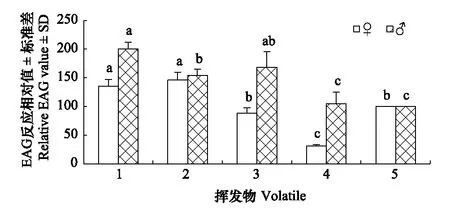
图1 华北大黑鳃金龟对不同挥发物的触角电位反应Fig.1 EAG responses of Holotrichia oblita to different volatiles 1: 邻苯二甲酸二丁酯;2: 肉桂醛;3: 2-苯乙醇;4: 苯甲醇;5: 顺-3-己烯-醇(参照); 同一性别的柱形图上方不同小写字母表示对不同挥发物的反应差异在0.05水平上显著
华北大黑鳃金龟对蓖麻不同挥发物的触角电位反应见图1。从图1可以看出,雌虫对不同挥发物的EAG反应相对值均低于雄虫,其中雌虫对肉桂醛的EAG反应相对值最高,达146.01%,其次为邻苯二甲酸二丁酯,达135.12%,两者差异不显著,但与其他处理的差异均达到显著水平。雄虫对邻苯二甲酸二丁酯的EAG反应相对值最高,达200.34%,其次为2-苯乙醇,达168.43%,它们与苯甲醇和顺-3-己烯-醇处理的差异均达到显著水平。雌雄虫平均相对EAG反应值最高的是邻苯二甲酸二丁酯,其次是肉桂醛,而对两种芳香族醇类化合物苯甲醇和2-苯乙醇的EAG反应则存在着性别差异,雄虫的反应远强于雌虫。
暗黑鳃金龟对蓖麻不同挥发物的触角电位反应见图2。从图2可以看出,雌雄虫对同一挥发物的EAG反应相对值没有明显差别,但同一性别对不同挥发物的反应值却明显不同,苯甲醇能激发雌虫和雄虫最高的EAG反应相对值。其中,雌虫对苯甲醇的EAG反应相对值达167.86%,与其他挥发物处理的差异均达到显著水平,其次为肉桂醛(136.95%);雄虫对苯甲醇的EAG反应相对值为149.95%,与其他挥发物处理的差异均达到显著水平,其次为肉桂醛(125.31%)和邻苯二甲酸二丁酯(123.31%)。
铜绿丽金龟对蓖麻不同挥发物的触角电位反应见图3。从图3可以看出,除了苯甲醇处理外,其他处理激发的雌虫和雄虫的触角电位反应值之间差别不大,平均反应值最强的物质是邻苯二甲酸二丁酯,雌雄虫EAG反应相对值分别为144.45%和143.86%。此外,雄虫对苯甲醇的反应值(143.70%)与邻苯二甲酸二丁酯相当,且显著强于雌虫的反应值。其他处理间的反应值的差异则未达到显著性水平。
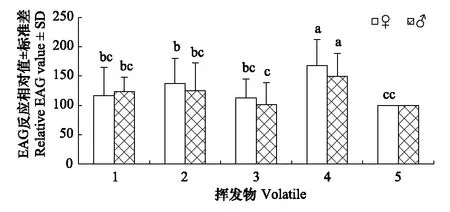
图2 暗黑鳃金龟对不同挥发物的触角电位反应Fig.2 EAG responses of Holotrichia parallela to different volatiles
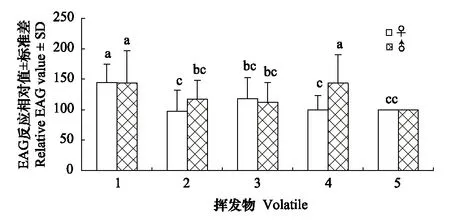
图3 铜绿丽金龟对不同挥发物的触角电位反应Fig.3 EAG responses of Anomala corpulenta to different volatiles
综合比较供试挥发物可以看出,触角电位活性最强的挥发物是蓖麻叶片中含量最高的邻苯二甲酸二丁酯,尤其是雄虫的选择反应较强。综合比较供试金龟甲可以看出,3种金龟甲雄虫对各处理挥发物的EAG反应值均高于参照挥发物顺-3-己烯-醇,雌虫的EAG反应值则因金龟甲或挥发物的不同而有所变化,但绝大多数处理也高于参照挥发物顺-3-己烯-醇,其中华北大黑鳃金龟雌雄虫对供试蓖麻挥发物的触角电位反应相对较强,而暗黑鳃金龟和铜绿丽金龟相对较弱。
2.2 金龟甲对不同挥发物的选择行为反应
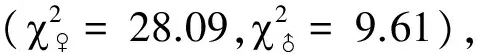
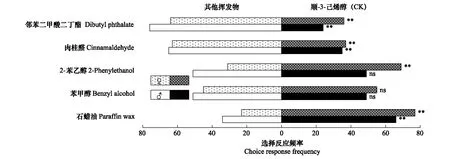
图4 华北大黑鳃金龟对不同挥发物的行为反应Fig.4 Behavioral responses of Holotrichia oblita to different volatiles条形图后的“**”和“*”分别表示两配对测试样品被选择频次的卡方测验结果在1%和5%水平上差异显著,“ns” 表示卡方测验结果差异不显著

图5 暗黑鳃金龟对不同挥发物的行为反应Fig.5 Behavioral responses of Holotrichia parallela to different volatiles
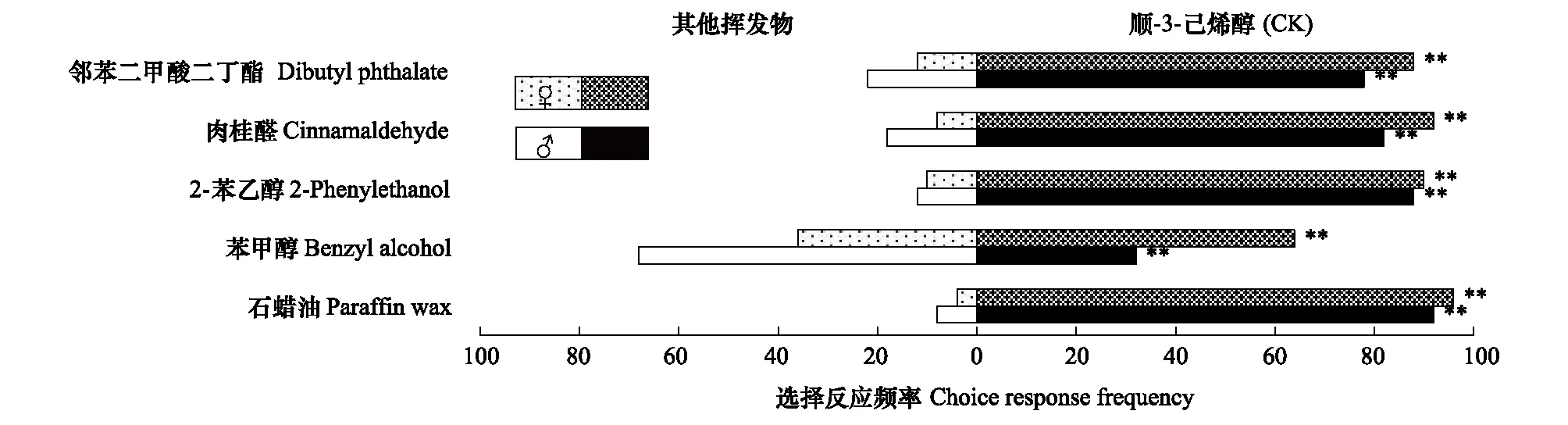
图6 铜绿丽金龟对不同挥发物的行为反应Fig.6 Behavioral responses of Anomala corpulenta to different volatiles
综合比较金龟甲对5种蓖麻叶挥发物的选择行为反应可以看出,不同金龟甲对不同挥发物的选择偏好不同。就供试化合物的作用范围而言,苯甲醇和邻苯二甲酸二丁酯的引诱活性较为广谱,肉桂醛仅对华北大黑鳃金龟表现出较强的引诱活性,2-苯乙醇的综合表现最差。就金龟甲对不同供试挥发物的选择偏好看,华北大黑鳃金龟对邻苯二甲酸二丁酯和肉桂醛表现出明显的选择偏好,暗黑鳃金龟对苯甲醇表现出明显的选择偏好,而铜绿丽金龟则更偏好选择绿叶气味物质顺-3-己烯-醇。
3 讨论
植食性昆虫表现出对有害非寄主植物的偏爱选择是一类少见的现象。已有的报道多见于鳞翅目蛾类,如豆荚野螟Marucatestulalis喜欢将卵产在非寄主植物菽麻Crotalariajuncea上,但幼虫取食菽麻后死亡率达75%以上,可在田间种植菽麻诱杀豆荚野螟[25]。欧洲山芥Barbareavulgaris叶片中含有三萜皂角苷[26],是一种对菜蛾幼虫有拒食活性的化合物[27],但菜蛾雌成虫却喜欢选择在这种非寄主植物上产卵[6]。香根草Vetiveriazizanioides在自然界很少遭受昆虫侵害,因为香根草油具有较强的驱虫活性[28],但斑禾草螟Chilopartellus成虫非常喜欢在这种植物上产卵,而幼虫取食叶片后则大量死亡[29]。通常将这种偏爱选择有害非寄主植物的现象称为消极的偏爱与表演[30],将这类诱集植物称为致死性诱集植物,可直接用于害虫的诱杀防治[31]。我国在田间种植蓖麻诱杀金龟甲已有数十年的历史,最近研究表明,以蓖麻作为伴生植物可作为实施地下害虫绿色防控的重要措施,但如何在田间科学配置蓖麻,还有很多问题需要深入研究[32]。
有关植食性昆虫偏爱选择有害非寄主植物的原因目前还不明确。一般认为,当非寄主植物与寄主植物上的化学信息或物理信息极其相似时,有些昆虫会被这些非寄主植物的“假象”所“蒙骗”,从而做出“错误”判断,将卵产在自己或其后代不适合生存的非寄主植物之上[33]。研究表明,蓖麻叶的挥发性物质与引诱金龟甲偏爱选择密切相关,且偏爱的挥发物因金龟甲的种类而异,华北大黑鳃金龟偏爱选择邻苯二甲酸二丁酯和肉桂醛,暗黑鳃金龟偏爱选择苯甲醇,铜绿丽金龟偏爱选择顺-3-己烯-醇,但究竟蓖麻中哪种或哪些挥发物起着关键的“蒙骗”作用还有待进一步探讨。由于蓖麻对金龟甲具有毒性,金龟甲趋向蓖麻不是为了取食[9- 11],初步推测金龟甲偏爱选择蓖麻可能与其求偶、交配等繁殖行为有关。综合分析已经鉴定出的齿爪鳃金龟属Holotrichia雌性信息素可以发现,华北大黑鳃金龟雌性信息素的主要成份为甘氨酸甲酯和脯氨酸甲酯[34],暗黑鳃金龟为L-异亮氨酸甲酯[35],而蓖麻叶片挥发物中也含有包括邻苯二甲酸二丁酯在内的大量酯类物质[36]。此外,本试验结果还表明,雄虫对蓖麻挥发物的选择反应频率明显高于雌虫,而雄虫是感受性信息素的虫态[8],这是否意味着“性信息素误导”是造成两种鳃金龟偏爱选择蓖麻的主要原因?有待进一步研究予以证实。丽金龟属Anomala的雌性信息素多具有呋喃类的母核结构,如铜绿丽金龟雌性信息素的主要成份为5-十四烷基二氢2(3H)-呋喃酮[37],因供试蓖麻挥发物中缺少该类物质,所以对铜绿丽金龟的引诱活性以顺-3-己烯-醇最强,是不是因为蓖麻中这一绿叶气味含量多于寄主植物所致,也有待进一步研究予以明确。至于金龟甲为什么表现出偏爱选择蓖麻的“自杀行为”,这种冒险行为是否可以通过提高交配成功率得到补偿?也值得进行深入研究。
触角电位和嗅觉行为反应测定是评价化学物质对昆虫生物活性的常用方法。前者测定的是昆虫触角对化学信号刺激的电生理反应,后者测定的是昆虫对化学信号的嗅觉定向行为表现[38]。本研究综合采用触角电位和行为测定两种技术,比较了3种金龟甲雌雄虫对来自蓖麻的不同挥发物的反应,发现华北大黑鳃金龟和暗黑鳃金龟的电生理反应和行为选择反应的测试结果基本一致,而铜绿丽金龟两方面的测试结果一致性程度最低,除了雄虫对苯甲醇的电生理反应和行为活性吻合外,其他测试均是电生理测试中挥发物活性强于参照,但行为测试却不如顺-3-己烯-醇的引诱力。这可能是因为触角电位反映的是嗅觉感受器对特定化合物反应电压的强弱,而最终输出的行为反应则要经历嗅觉受体至大脑嗅叶之间的神经编码和投射、中枢神经系统对神经电生理信号的综合评判以及大脑依据评判结果对运动器官的调控,这3个过程均有可能造成神经电生理信号的重新整合。因此,通常情况下用触角电位技术初步筛选活性物质,用嗅觉仪评价这些活性物质的生物学作用。
[1] Bruce T J A, Wadhams L J and Woodcock C M. Insect host location: a volatile situation. Trends in Plant Science, 2005, 10(10): 269- 274.
[2] Schoonhoven L M, van Loon J J A and Dicke M. Insect-plant biology (2nd Edition). New York: Oxford University Press, 2005: 135- 168.
[3] Finch S and Collier R H. Host-plant selection by insects---a theory based on “appropriate/inappropriate landings” by pest insects of cruciferous plants. Entomologia Experimentalis et Applicata, 2000, 96(2): 91- 102.
[4] Bernays E A and Chapman R F. Host-plant selection by phytophagous insects. New York: Chapman and Hall, 1994: 61- 94.
[5] Thompson J N. Evolutionary ecology of the relationship between oviposition preference and performance of offspring in phytophagous insects. Entomologia Experimentalis et Applicata, 1988, 47(1): 3- 14.
[6] Lu J H, Liu S S and Shelton A M. Laboratory evaluations of a wild cruciferBarbareavulgarisas a management tool for the diamondback mothPlutellaxylostella(Lepidoptera: Plutellidae). Bulletin of Entomological Research, 2004, 94(6): 509- 516.
[7] Wu J X,Li Z H, Yuan G H. Agricultural Entomology (2nd Edition). Beijing: China Agriculture Press, 2011: 52- 57.
[8] Meng X Z, Yan X H and Han Y. Chemical communication and semiochemicals in scarab beetles. Chinese Bulletin of Life Sciences, 1999, 11(5): 230- 234.
[9] Li W Z, Yuan Y H, An S H, Yuan G H, Luo M H and Guo X R. Bioassays on selection and feeding responses ofHolotrichiaoblitaadults to different plant species. Acta Ecologica Sinica, 2009, 29(5): 293- 296.
[10] Li W Z, Yuan Y H, Yuan G H, Luo M H and Guo X R. Bioassays on selection and feeding responses ofAnomalacorpulentaadults to different plant leaves. Chinese Journal of Ecology, 2009, 28(9): 1905- 1908.
[11] Li W Z, Yuan Y H, Yuan G H, Luo M H and Guo X R. Selection and feeding responses ofHolotrichiaparallelaadults to the leaves of non-host plantRicinuscommunisand several host plants. Journal of Henan Agricultural University, 2010, 44(4): 438- 442, 447.
[12] Shen X W, An J J, Yuan G H, Luo M H and Guo X R. Research on the contact effect of extracts of different plant parts ofRicinuscommunis(Euphorbiales: Euphorbiaceae) on grubs. Journal of Henan Agricultural University, 2008, 42(4): 427- 429.
[13] Zhao J X, Zhang S H, Sher G Z and Wu Y D L. Insecticidal effect of raw extracts of castor bean toxin. Journal of Inner Mongolia Agricultural University, 2001, 22(4): 78- 80.
[14] Xu Q Y, Zhong G H, Hu M Y, Liu X Q and Zheng C. Study on insecticidal activity of extract ofRicinuscommunisL. to vegetable pests. Journal of Changjiang Vegetables, 2006, (11): 35- 36.
[15] He H G. Insecticidal and Anti-feeding effects ofRicinuscommunisL. extract onPiersrapae. Journal of Anhui Agricultural Science, 2010, 38(15): 7929- 7930.
[16] Ramos-López M A, Perez-G S, Rodríguez-Hernández C, Guevara-Fefer P, Zavala-Sánchez M A. Activity ofRicinuscommunis(Euphorbiaceae) againstSpodopterafrugiperda(Lepidoptera: Noctuidae). African Journal of Biotechnology, 9(9): 1359- 1365.
[17] Zhou F C, Gu A X, Zhou G S, Chen X H, Qi X H, Hong N N, Ren J and Shao J Z. Effect of castor leaf alcohol extract onDiaphaniaindica. Chinese Journal of Eco- Agriculture, 2012, 20(5): 619- 624.
[18] Ju R, Xu H H, Zhou L J. Research and application of Euphorbiaceae plants in pesticides. Guangdong Agricultural Science, 2005, (6):56- 59.
[19] Wen Y M, Feng Y F, Zheng M Z. Extraction and content of the ricinine for different parts ofRicinuscommunis. Agrochemicals, 2008, 47:584- 585, 606.
[20] Yao Y S. Preliminary study on the positively taxis ofAnomalacorpulentato castor bean and its female sex pheromone. Henan Agricultural University thesis, 2004.
[21] Wei J N and Kang L. Roles of (Z)-3-hexenol in plant-insect interactions. Plant Signaling amp; Behavior, 2011, 6(3): 369- 371.
[22] Ruther J. Male-biassed response of garden chafer,PhylloperthahorticolaL., to leaf alcohol and attraction of both sexes to floral plant volatiles. Chemoecology, 2004, 14(3/4): 187- 192.
[23] Lu C K, Wang X Q, Zhang J S and Zhao T D. Electroantennographic and behavioral responses ofProagoperthalucidula(Faidermann) (Coleoptera: Scarabaeidae) to plant volatiles. Acta Entomologica Sinica, 2009, 52(12): 1379- 1384.
[24] Deng S S. Yin J, Cao Y Z, Luo Z X, Wang W and Li K B. Electroantennographic and behavioral responses ofHolotrichiaoblita(Faldermann) (Coleoptera: Scarabaeidae) to plant volatiles. Plant Protection, 2011, 37(5): 62- 66.
[25] Jackai L E N and Singh S R. Suitability of selected leguminous plants for development ofMarucatestulalislarvae. Entomologia Experimentalis et Applicata, 1983, 34(2): 174- 178.
[26] Shinoda T, Nagao T, Nakayama M, Serizawa H, Koshioka M, Okabe H and Kawai A. Identification of a triterpenoid saponin from a crucifer,Barbareavulgaris, as a feeding deterrent to the diamond back moth,Plutellaxylostella. Journal of Chemical Ecology, 2002, 28(3): 587- 599.
[27] Agerbirk N, Olsen C E, Bibby B M, Frandsen H O, Brown L D, Nielsen J K and Renwick J A A. A saponin correlated with variable resistance ofBarbareavulgaristo the diamondback mothPlutellaxyloaella. Journal of Chemical Ecology, 2003, 29(6): 1417- 1433.
[28] Jain S C, Novicki S, Eisner T and Meinwald J. Insect repellents from vetiver oil: zizanal and epizizanal. Tetrahedron Letters, 1982, 23(45): 4639- 4642.
[29] Ndemah R, Gounou S and Schulthess F. The role of wild grasses in the management of Lepidopterous stem-borers on maize in the humid tropics of western Africa. Bulletin of Entomological Research, 2002, 92(6): 507- 519.
[30] Ellis A M. Incorporating density dependence into the oviposition preference-offspring performance hypothesis. Journal of Animal Ecology, 2008, 77(2): 247- 256.
[31] Shelton A M and Nault B A. Dead-end trap cropping: a technique to improve management of the diamondback moth,Plutellaxylostella(Lepidoptera: Plutellidae). Crop Protection, 2004, 23(6): 497- 503.
[32] Zhu D, Qin Y C, Zhu P X, Shi Y J and Zhang D W. Control effect of different trap and kill methods on peanut scarab beetles. China Plant Protection, 2012, 32(1): 38- 41.
[33] Shelton A M and Badenes-Perez F R. Concepts and applications of trap cropping in pest management. Annual Review of Entomology, 2006, 51:285- 308.
[34] Hu Z Q, Kang J X, Zhao H Y and Shi W D. Bioassays of attracting substances to theHolotrichiaablita. Shanxi Agricultural Science, 2005, (4):46- 48.
[35] Choi, M Y, Paik C H, Seo H Y, Lee G. H, Kim J D, Riotberg B D and Gries G. Attractiveness of sex pheromone of the large black chaefer,Holotrichiaparallela(Motschulasky) (Coleoptera : Scarabaeidae), in potato field. Korean Journal of Applied Entomology, 2006, 45(2): 169- 172.
[36] Sun F and Lu J H. Analysis of volatiles and wound-induced volatiles component ofRicinuscommunis. Scientia Silvae Sinicae, 2006, 42(9): 140- 141, 241.
[37] Luo Z X. Investigation of scarab beetle and study on identification and application of sex pheromone of dominant species. Chinese Academy of Agricultural Sciences thesis, 2010.
[38] Yan F M. Chemical Ecology (2nd Edition). Beijing: China Science Press, 2011: 237- 399.
参考文献:
[7] 仵均祥, 李照会, 原国辉. 农业昆虫学 (第二版). 北京: 中国农业出版社, 2011: 52- 57.
[8] 孟宪佐, 闫晓华, 韩艳. 金龟子化学通讯与信息化学物质. 生命科学, 1999, 11(5): 230- 234.
[10] 李为争, 袁莹华, 原国辉, 罗梅浩, 郭线茹. 铜绿丽金龟对不同植物叶片的选择和取食反应. 生态学杂志, 2009, 28(9): 1905- 1908.
[11] 李为争, 袁莹华, 原国辉, 罗梅浩, 郭线茹. 暗黑鳃金龟成虫对非寄主蓖麻和几种寄主叶片的选择和取食反应. 河南农业大学学报, 2010, 44(4): 438- 442, 447.
[12] 申小卫, 安靖靖, 原国辉, 罗梅浩, 郭线茹. 蓖麻植株不同部位粗提物对蛴螬的触杀作用研究. 河南农业大学学报, 2008, 42(4): 427- 429.
[13] 赵建兴, 张树怀, 佘国珍, 乌云达来. 蓖麻毒素粗提物杀虫作用的研究. 内蒙古农业大学学报, 2001, 22(4): 78- 80.
[14] 徐齐云, 钟国华, 胡美英, 刘萱清, 郑成. 蓖麻提取物对蔬菜害虫的杀虫活性研究. 长江蔬菜, 2006, (11): 35- 36.
[15] 何恒果. 蓖麻提取液对菜青虫的生物活性研究. 安徽农业科学, 2010, 38(15): 7929- 7930.
[17] 周福才, 顾爱祥, 周桂生, 陈学好, 齐晓花, 洪楠楠, 任佳, 邵久之. 蓖麻叶片粗提物对黄瓜瓜绢螟的作用. 中国生态农业学报, 2012, 20(5): 619- 624.
[18] 鞠荣, 徐汉虹, 周利娟. 大戟科杀虫植物生物活性的研究与应用. 广东农业科学, 2005, (6):56- 59.
[19] 温燕梅, 冯亚非, 郑明珠. 蓖麻不同部位杀虫活性成分蓖麻碱的提取及含量. 农药, 2008, 47:584- 585, 606.
[20] 姚永生. 铜绿丽金龟对蓖麻的趋向作用及其雌性性信息素的初步研究. 河南农业大学硕士学位论文, 2004.
[23] 路常宽, 王晓勤, 张巨山, 赵铁栋. 苹毛丽金龟对植物挥发物成分的触角电位及行为反应.昆虫学报, 2009, 52(12): 1379- 1384.
[24] 邓思思, 尹姣, 曹雅忠, 罗宗秀, 王伟, 李克斌. 华北大黑鳃金龟对20种植物源挥发物的电生理和行为反应. 植物保护, 2011, 37(5): 62- 66.
[32] 朱栋, 秦玉川, 朱培祥, 时玉娟, 张佃文. 不同诱杀方法对花生金龟子的防治效果研究. 中国植保导刊, 2012, 32(1): 38- 41.
[34] 胡祖庆, 亢菊侠, 赵惠燕, 时卫东. 华北大黑鳃金龟引诱剂生物测定初探. 陕西农业科学, 2005, (4):46- 48.
[36] 孙凡, 鲁继红. 蓖麻挥发物与创伤诱导挥发物组成成分分析. 林业科学, 2006, 42(9): 140- 141, 241.
[37] 罗宗秀. 金龟甲调查及其优势种性信息素鉴定与应用研究. 中国农业科学院硕士学位论文, 2010.
[38] 阎凤鸣. 化学生态学 (第二版). 北京: 科学出版社, 2011: 237- 399.
ElectroantennographicandbehaviouralresponsesofscarabbeetlestoRicinuscommunisleafvolatiles
LI Weizheng, YANG Lei, SHEN Xiaowei, YUAN Yinghua, YUAN Guohui*, LUO Meihao, GUO Xianru
CollegeofPlantProtection,HenanAgriculturalUniversity,Zhengzhou450002,China
Holotrichiaoblita,H.parallelaandAnomalacorpulentaare important pests in the dry land areas of North China, which feed roots or stems of plants in larvae stage and leaves of variety of plants in adult stage. Most interestingly, three species all prefer to feeding on leaves ofRicinuscommunis, a non-host plant, despite that the extract ofR.communisleaf is toxic to their larvae and adults. In order to elucidate the mechanisms behind this phenomenon, in the present study, the electroantennographic and behavioural responses of the male and female adults of three scarab beetle species to five components ofR.communisleaf volatiles were tested using the electroantennogram (EAG) and a Y-typed olfactometer, respectively. The EAG bioassay showed that the relative EAG values of three species male scarab beetles were higher to four components, i.e., dibutyl phthalate, cinnamaldehyde, 2-phenylethanol and benzyl alcohol, than that to control volatile (Z)-3-hexene-1-ol, especially the males ofH.oblitaexhibited strong responses to dibutyl phthalate and 2-phenylethanol, with 200.34% and 168.43% relative EAG values, respectively. Corresponding females ofH.oblitaresponded strongly to cinnamaldehyde and dibutyl phthalate with the 146.01% and 135.12% relative EAG values, respectively. The relative EAG values ofH.parallelato benzyl alcohol arrived 149.95%(male) and 167.86%(female).A.corpulentaexhibited responses to dibutyl phthalate with about 144% the relative EAG values. The response ofA.corpulentamale to benzyl alcohol is strong with the 143.70% relative EAG values. The results of behavioural bioassay indicated the preference to volatiles derived fromR.communisis is species-dependent, that is,H.oblitaexhibited significant preferences to dibutyl phthalate and cinnamaldehyde, with the choice response percentages of 64% and 63% in females and 76% and 65% in males, significantly higher than that to (Z)-3-hexene-1-ol. Females and males ofH.parallelashowed significant preference to benzyl alcohol, with the 66% and 56% mean choice response percentages, respectively.A.corpulentawas most preferred to a green leaf volatile (Z)-3-hexene-1-ol, and the average choice response percentages of males and females to (Z)-3-hexene-1-ol were 88%, 87% and 89% in the controls of dibutyl phthalate, cinnamaldehyde and 2-phenylethanol, respectively. The results of comparison betweenR.communisvolatiles and the female-produced sex pheromones of the tested scarab beetle species, found thatR.communisleaves emitted abundant dibutyl phthalate, while the major components ofH.oblitafemale-produced sex pheromone were glycine methyl ester and proline methyl ester, and the major component ofH.parallelafemale-produced sex pheromone was methylL-isoleucinate. Therefore, “sex pheromone misleading” may possibly answer for the preferences of twoHolotrichiaspecies toR.communis. The green leaf volatile (Z)-3-hexene-1-ol may possibly be the main attractant ofA.corpulentatoR.communis.
scarab beetle;Ricinuscommunis; plant volatile; electroantennogram (EAG); “Y”-typed olfactometer
国家自然科学基金资助项目(31071972);国家公益性行业(农业)专项资助项目(201203036)
2012- 07- 08;
2012- 11- 28
*通讯作者Corresponding author.E-mail: hnndygh@126.com
10.5846/stxb201207080959
李为争,杨雷,申小卫,袁莹华,原国辉,罗梅浩,郭线茹.金龟甲对蓖麻叶挥发物的触角电位和行为反应.生态学报,2013,33(21):6895- 6903.
Li W Z, Yang L, Shen X W, Yuan Y H, Yuan G H, Luo M H, Guo X R.Electroantennographic and behavioural responses of scarab beetles toRicinuscommunisleaf volatiles.Acta Ecologica Sinica,2013,33(21):6895- 6903.
———在龟甲、兽骨上刻字的朝代

