盐分和底物对黄河三角洲区土壤有机碳分解与转化的影响
李 玲, 仇少君, 檀菲菲, 杨红军, 刘京涛, 陆兆华,
(1. 滨州学院山东省黄河三角洲生态环境重点实验室,滨州 256603;2. 中国农业科学院农业资源与农业区划所,农业部植物营养与施肥重点实验室,北京 100081;3. 中国矿业大学(北京)化学与环境工程学院恢复生态研究所,北京 100083)
盐分和底物对黄河三角洲区土壤有机碳分解与转化的影响
李 玲1, 仇少君2,*, 檀菲菲3, 杨红军1, 刘京涛1, 陆兆华1,3
(1. 滨州学院山东省黄河三角洲生态环境重点实验室,滨州 256603;2. 中国农业科学院农业资源与农业区划所,农业部植物营养与施肥重点实验室,北京 100081;3. 中国矿业大学(北京)化学与环境工程学院恢复生态研究所,北京 100083)
土壤盐碱化能抑制微生物活性,影响土壤有机碳的分解与转化。以黄河三角洲盐碱耕地为研究对象,采用室内恒温培养法,设置3个NaCl盐分梯度(S1:0.1%;S2:0.5%;S3:0.9%),通过在土壤中添加不同底物(CK:不添加底物;N:添加氮;C:添加碳;C+N:添加碳+氮),研究该土壤释放CO2-C量、土壤微生物生物量碳(SMBC)、土壤微生物呼吸商(qCO2)及溶解性有机碳(DOC)对盐分和底物的响应。结果表明:在45 d的培养期内,CK、N处理中S1盐分土壤释放CO2-C量最高,S2和S3明显低于S1,降低幅度分别为18.3%—23.7%和24.3%—39.8%。C、C+N处理中3个盐分土壤释放CO2-C量差异较小,特别是在C+N处理中,3个盐分土壤释放CO2-C差异不显著。4个底物处理中,SMBC均在S1和S2盐分中含量较高,S3盐分最低。与CK相比,N处理并不能提高SMBC含量,C、C+N处理可明显提高SMBC,但S1和S2盐分土壤提高的幅度(80.4%—80.5%、58.0%—58.7%)明显高于S3(68.9% 、49.7%)。4个底物处理中,qCO2均在S1盐分土壤中最高,C、C+N处理可明显提高qCO2。CK、N处理中3个盐分土壤DOC差异不显著,C、C+N处理中S3盐分土壤DOC较高。说明在无碳源输入条件下,增加盐分含量能明显抑制土壤释放CO2量。添加碳源后,盐分含量对土壤释放CO2的影响变小。微生物对碳源和盐分胁迫的响应较快,添加碳源能明显提高微生物数量及其活性。但较高盐分(含盐量gt;0.5%)可明显降低土壤微生物活性及对外源碳的利用率,导致较高盐分SMBC及qCO2较低而DOC较高。
土壤盐分;底物;CO2;土壤微生物生物量碳;土壤微生物呼吸商;土壤溶解性有机碳
目前全球盐碱地面积总计约10亿hm2,其中我国有近1亿hm2[1],且次生盐渍化土地面积仍在不断扩大。盐碱化是引起土地退化的重要因素之一,导致土壤肥力普遍较低,制约盐碱地的土地生产力。土壤碳素是维持土壤肥力的重要因子,在改善土壤理化性状、生物学特性及保肥供肥方面发挥重要作用。土壤微生物是土壤碳循环的主要驱动力,土壤的盐碱化影响土壤微生物活性,进而影响土壤碳素的循环过程。因此,加强盐碱地土壤碳循环过程的研究对进一步了解盐碱地及盐碱化过程在全球碳贮存及排放中的作用具有重要意义。
盐碱化土壤在碳循环中扮演“汇”、“源”的角色日益受到重视,一部分学者指出较高的盐分含量抑制土壤释放CO2量[2- 3],外源碳在高盐分土壤中的矿化率明显低于低盐分土壤,甚至仅为低盐分土壤的50%左右[3],但也有学者发现加入外源碳后盐碱地土壤释放CO2量高于非盐碱地16%—31%[4],特别是最新研究表明盐碱地能吸收大气中的CO2[5],因此盐碱化土壤有机碳分解机制的研究有待进一步加强。土壤微生物生物量碳和溶解性有机碳是有机质转化为活性碳的主要形式,土壤微生物呼吸商是衡量微生物活性的重要指标,三者均是反映土壤有机质周转的参数。目前盐分含量对土壤微生物生物量碳的影响仍存在争议,如在澳大利亚新南威尔士州的高原土壤中添加盐分后,高盐条件下土壤微生物生物量碳是低盐分条件下的3倍多[6],而对印度孟加拉湾沿海地区盐碱地的研究发现,土壤含盐量最高的夏季土壤微生物生物量碳最低[7]。另外,盐分含量对土壤溶解性有机碳及微生物呼吸商的影响报道较少[6]。因此,盐分含量对土壤碳素分解与转化的影响有待进一步深入研究,以探明盐分含量对土壤有机碳分解与转化的影响机理。
黄河三角洲地区近50%的土地为不同程度的盐碱化[8],且相当一部分盐碱地尚未得到有效的改良与利用。目前我国对黄河三角洲地区盐渍化土的形成、调查、改良和开发利用的研究较多[8- 10],但对该区盐碱地土壤生物化学过程的研究鲜有报道。针对以上问题,本文以黄河三角洲盐碱耕地为研究对象,设置不同的盐分梯度,同时在土壤中添加不同底物,研究底物添加后盐分含量对土壤释放CO2量、土壤微生物生物量碳、微生物呼吸商及溶解性有机碳的影响,明确土壤有机碳的分解与转化对盐分胁迫的响应机制,为进一步揭示该区盐碱化土壤有机碳的循环特征提供理论依据。
1 材料与方法
1.1 供试土样
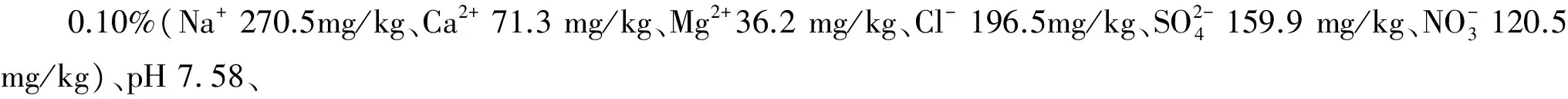
1.2 试验设计
1.2.1 土壤盐分处理
设置3个NaCl盐分梯度:(1)对照,土壤含盐量为0.1%(S1);(2)土壤含盐量为0.5%(S2);(3)土壤含盐量为0.9%(S3)。具体操作如下:称取12.80 kg新鲜土样3份,测定土壤含水量。按照烘干样计算出含盐量为0.5%所需的NaCl,使之溶解于170 mL蒸馏水中,均匀喷洒到土样中,即得含盐量为0.5%的土样;含盐量为0.9%的土样处理同上;对照处理(含盐量为0.1%)同样喷洒170 mL蒸馏水。3个盐分土样于25℃、黑暗条件下预培养14 d。预培养后的土壤特性见表1。
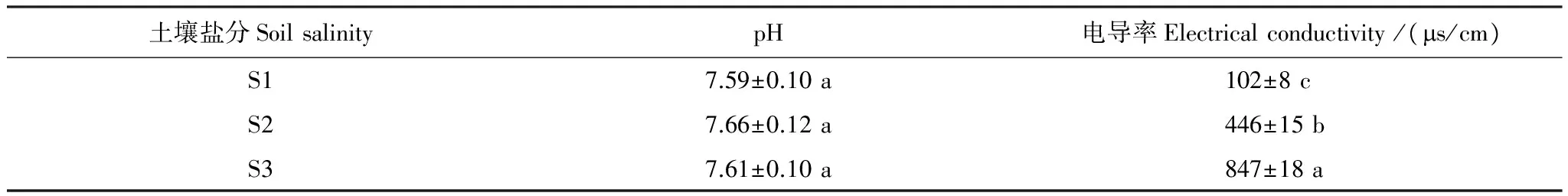
表1 土样添加盐分预培养14 d后土壤基本理化性质
表中数据为平均值标准误差,字母不同表示各个盐分土壤间差异达到Plt;0.05显著水平;S1、S2、S3分别代表0.1%、0.5%和0.9%的土壤盐分含量
1.2.2 底物处理
底物添加为4个处理:(1)对照(CK),不添加底物;(2)添加氮(N);(3)添加碳(C);(4)添加碳+氮(C+N)。分别以NH4Cl和葡萄糖作为氮源和碳源,其添加量分别为30 mg N/kg、750 mg C/kg。具体操作如下:取上述预培养后的3个盐分土样,把每个盐分土样分成4等份(每份土样为3.2kg),添加不同底物。按照不同底物处理称取葡萄糖和NH4Cl,每个处理中的底物溶解于蒸馏水中,均匀喷洒在土样中,使土壤含水量达到田间持水量的60%。
1.2.3 测定指标
(1)土壤释放CO2-C
称取每个处理土样50.00 g(鲜土重)于50 mL烧杯中,置于1 L广口瓶内,瓶底加10 mL蒸馏水以保持100%空气的相对湿度,另在广口瓶内放置一个盛有20 mL 1 mol/L NaOH溶液吸收瓶,用橡胶塞密封广口瓶,于25℃、黑暗条件下培养45 d。每个处理重复3次。培养过程中,每3 d称重广口瓶以定期补充损失的水分,且每3 d通气15 min。分别于0、2、5、10、20、30、45 d取出NaOH溶液吸收瓶,并换一个新的NaOH溶液吸收瓶,测定NaOH吸收液中CO2-C含量。
(2) 土壤微生物生物量碳(SMBC)、溶解性有机碳(DOC)
称取每个处理土样150.00 g(鲜土重)于1 L广口瓶内,用封口膜封口,膜上用针扎若干小孔以保证好气培养,于25℃、黑暗条件下培养45 d。每个处理重复3次。培养过程中,每3 d称重广口瓶,以定期补充损失的水分,且每3 d通气15 min。分别于0、2、5、10、20、30、45 d破坏性取样测定SMBC、DOC含量。
1.4 分析方法
SMBC的测定采用氯仿熏蒸法:于每个培养瓶内称取相当于烘干重25.00 g的土样,用氯仿熏蒸24 h,除去氯仿,加入100 mL 0.5 mol/L K2SO4溶液振荡30 min,过滤。同时称取相同量土样做不熏蒸处理,浸提方法同上。浸提液中有机碳含量采用TOC/TNb自动分析仪(Liquid TOC II,Elementar,德国)测定。SMBC = 2.22 ×(熏蒸土样浸提的有机碳-不熏蒸土样浸提的有机碳),式中以不熏蒸土样浸提的有机碳作为溶解性有机碳(DOC)[11- 12]。
NaOH吸收液中CO2-C含量的测定采用滴定法:吸取5 mL NaOH吸收液于100 mL三角瓶中,然后加入2 mL 1 mol/L BaCl2溶液及5滴酚酞指示剂,用0.1mol/L标准酸(HCl)滴定至红色消失,根据稀释倍数计算出吸收液中CO2-C含量。
土壤微生物呼吸商qCO2=(CO2-C)i/ SMBCi[6,13],式中(CO2-C)i为第i天土壤释放CO2-C的速率(mg CO2-C·kg-1土壤·d-1)),SMBCi为第i天土壤微生物生物量碳(mg SMBC/kg土壤)。
数据为3次重复的平均值,以烘干土壤量计。采用Excel 2003、Spss 12.0进行制图与统计分析,采用Anova法和Univariate法进行单因素和交互作用的方差分析。
2 结果与分析
2.1 土壤有机碳矿化的变化
土壤有机碳的矿化以土壤释放CO2-C量来计算。不同底物处理中,土壤有机碳的矿化均存在两个分解阶段:培养前10 d的快速分解阶段和接下来的慢速并趋稳定的分解阶段(图1)。培养45 d内,CK、N处理中盐分含量对土壤有机碳分解的影响相同。土壤释放CO2-C量均在S1盐分条件下最高,S2、S3盐分条件下土壤释放CO2-C量较低,且差异不显著。CK处理45 d内S1盐分条件下土壤释放的CO2-C量高于S2和S3盐分18.3%和23.7%。添加N处理45 d内S1盐分条件下土壤释放的CO2-C量高于S2和S3盐分24.3%和39.8%。添加C处理中,S2盐分土壤释放CO2-C量最高,S1和S3较低,且差异不显著。45 d内S2盐分条件下土壤释放的CO2-C量高于S1和S3盐分6.9%和9.8%。添加C+N处理,S1、S2和S3盐分条件下土壤释放CO2-C量差异不显著。
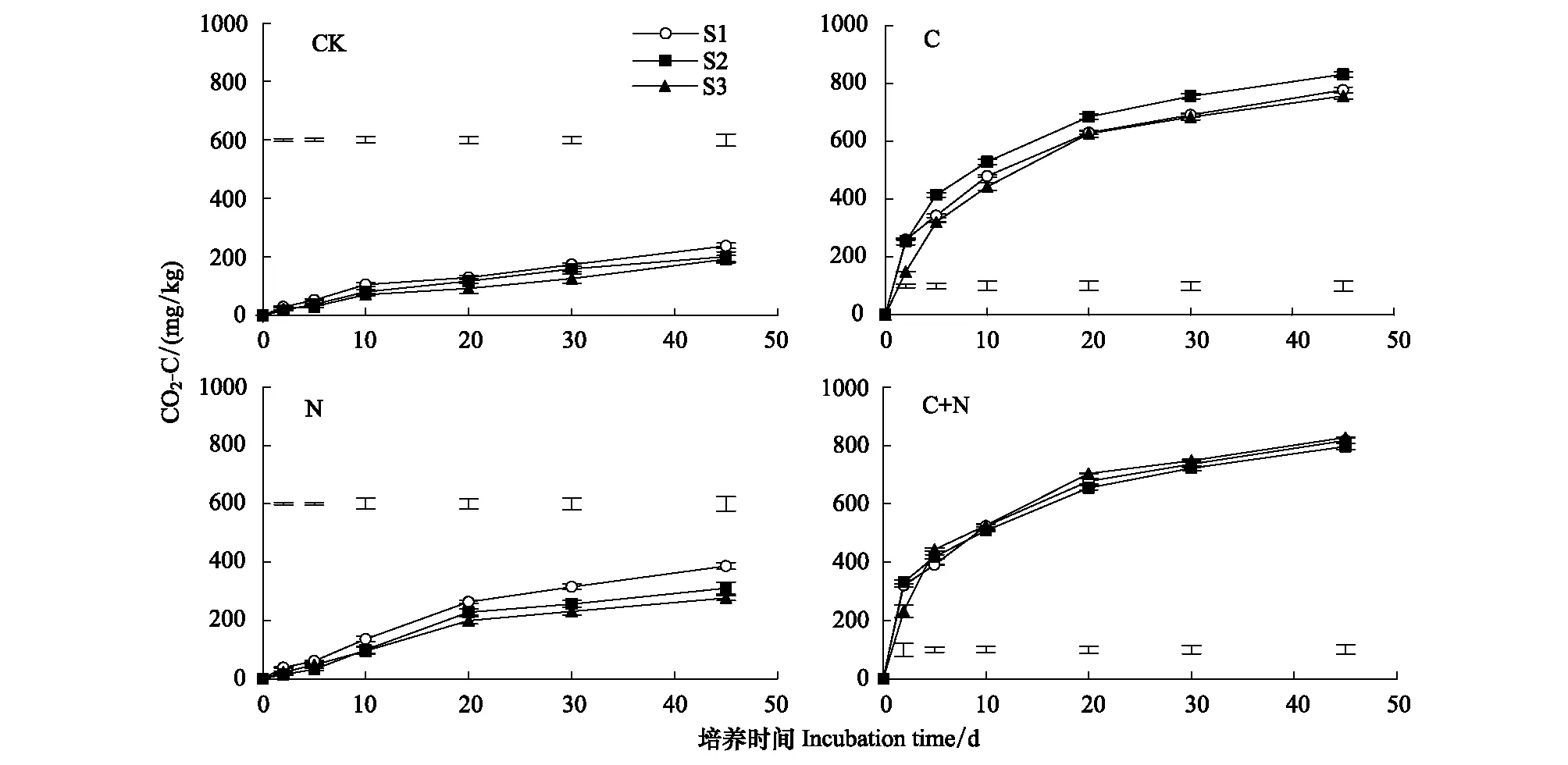
图1 不同处理下土壤释放CO2的动态变化Fig.1 Dynamic Changes of CO2 emission from soil under different treatments图中数据为平均值标准误差,图中短竖线(I)表示不同盐分土壤在Plt;0.05水平上的LSD值; S1、S2、S3分别代表0.1%、0.5%和0.9%的土壤盐分含量,CK、C、N和C+N分别代表不添加底物、添加碳、添加氮和添加碳+氮处理
本研究结果也表明,各个盐分土壤中添加底物均可以提高土壤释放CO2-C量,但不同盐分条件下土壤释放CO2-C量的增幅不同。与CK相比,添加N处理整个培养期内 S1和S2盐分条件下土壤释放CO2-C的增加幅度(61.4%—62.3%)明显高于S3盐分条件下的增加幅度(37.4%)。添加C处理S2盐分土壤释放CO2-C的增加幅度为331.5%,明显高于其余2个盐分土壤的增加幅度(226.3%—275.8%)。添加C+N处理,S2、S3盐分条件下土壤释放CO2-C量的增加幅度(311.1%—313.4%)明显高于S1盐分条件下的增加幅度(243.1%)。
2.2 土壤微生物生物量碳(SMBC)的变化
CK处理和添加N处理,3个盐分条件下SMBC均在培养第2天出现最低值,此后出现升高趋势。培养结束时,CK处理SMBC含量高于初始值37.5%—52.3%,添加N处理SMBC含量高于初始值44.4%—46.3%。而添加C及C+N处理,3个盐分条件下SMBC均在培养2 d时迅速升高,且在培养第10—20天达到最大值,培养结束时3个盐分条件下SMBC含量均高于初始值,增加幅度达78.5%—121.1%(图2)。
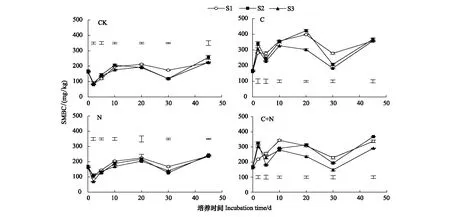
图2 土壤微生物生物量碳的动态变化Fig.2 Dynamic changes of soil microbial biomass carbon under different treatments
由45 d培养期内SMBC的平均值来看,CK处理S1和S2盐分条件下SMBC的均值较高,且差异不显著,但两个盐分条件下SMBC明显高于S3(Plt;0.05)。添加N处理,S1盐分条件下SMBC最高,与S2相比差异不显著,但明显高于S3。与CK相比,添加N处理S1盐分条件SMBC略有增加,增幅为6.6%,而S2、S3盐分条件下SMBC均值与CK处理相比基本一致。添加C及C+N处理,S1和S2盐分条件下SMBC均值较高,且差异不显著,但两个盐分条件下SMBC明显高于S3(Plt;0.05)。与CK相比,添加C处理S1、S2和S3盐分条件下SMBC的增加幅度为80.5%、80.4%和68.9%,添加C+N处理S1、S2和S3盐分条件下SMBC的增加幅度为58.7%%、58.0%和49.7%。
2.3土壤微生物呼吸商(qCO2)的变化
整个培养期内,不同处理值均表现为培养前2 d最高,此后开始降低并趋于稳定(图3),这与土壤有机碳的分解动态表现一致(图1)。不同底物处理,qCO2均在S1盐分条件下较高,随着盐分的增加qCO2出现降低趋势。CK和添加N处理,在培养的前2 d内S1盐分条件下qCO2明显高于S2和S3,但随着培养时间的延长,其差异逐渐变小。添加C及C+N处理,在培养最初的2 d内,S1和S2盐分条件下qCO2值较高,但2 d后S3盐分条件下qCO2值明显高于其余盐分处理。同时本研究结果表明土壤添加底物后可明显提高qCO2值。整个培养期内与不添加底物相比,添加N、C及C+N后,不同盐分条件下qCO2的增加幅度分别为24.6%—43.1%、164.6%—263.7%及248.5%—312.4%。
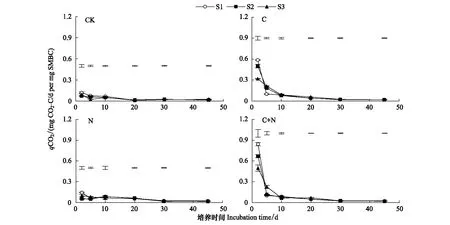
图3 不同处理下土壤微生物呼吸商的动态变化Fig.3 Dynamic changes of metabolic quotient under different treatments
2.4 土壤溶解性有机碳(DOC)的变化
整个培养期内,盐分含量对土壤DOC的影响相对较小(图4)。CK及添加N处理,3个盐分条件下土壤DOC的变化趋势基本一致,且3个盐分土壤DOC差异不显著。添加C及C+N处理,培养2 d后土壤DOC含量迅速增加,且S3盐分条件下土壤DOC的增加幅度(433.3%及90.1%)明显大于S1和S2盐分条件下的增加幅度(34.1%—190.5%及22.1%—33.5%)。此后,S1、S2和S3盐分条件下土壤DOC含量差异变小,且在培养结束时均低于初始值。
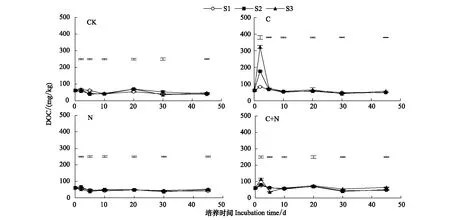
图4 土壤溶解性有机碳的动态变化Fig.4 Dynamic changes of soil dissolved organic carbon under different treatments
3 讨论
盐分含量影响土壤释放CO2量,但不同底物处理下盐分含量对CO2释放量的影响不同。不添加底物和只添加氮处理,土壤释放CO2量均在低盐分条件下较高,随着含盐量的增加土壤释放CO2量出现降低趋势,这与Elgharably等在无外源底物添加处理中的研究结果一致[15]。而Beltrán-Hernández等研究发现,不添加底物处理高盐分条件下土壤释放CO2量是低盐分条件下的1.6—2.7倍[16],这可能是因为其高盐土壤有机碳含量(26.8—30.3g/kg)明显高于本研究中的土壤。添加碳后本研究0.5%盐分土壤释放CO2量最高,添加碳+氮后3个盐分土壤释放CO2量无明显差异。说明在碳源输入条件下,增加一定量的土壤盐分可能产生正激发作用,从而引起土壤释放CO2量的增加[17]。有研究者在土壤中添加葡萄糖,同样发现较高的盐分含量并没有抑制土壤释放CO2量,且高盐土壤释放CO2是低盐土壤的2倍多[18]。这主要是因为葡萄糖是活性较高的碳源,其加入到土壤后可提高微生物的活性及其周转速率,进而使土壤微生物对CO2释放的贡献率远远掩盖了盐分对土壤CO2释放的影响。而在土壤中添加植物残体+氮后,土壤释放CO2量仍以低盐分条件下最高[12],这是因为植物残体木质素含量较高、碳源有效性较低,土壤盐分含量仍是影响CO2释放的因子之一。本研究还表明不添加底物及只添加氮条件下,高盐和低盐土壤释放CO2量的差异较大,而添加碳及碳+氮后差异较小。同时,与不添加底物相比,添加氮处理低盐分(0.1%)土壤释放CO2量的增加幅度高于较高盐分(0.5%、0.9%)土壤,而添加碳及碳+氮后,0.1%盐分土壤土壤释放CO2量的增加幅度并不是最高的。说明在无碳源而只有氮源输入的条件下,土壤盐分是影响土壤释放CO2的重要限制因子。添加碳源后盐分对土壤释放CO2的影响减小。
土壤微生物生物量碳均在低盐分条件下最高,随着盐分含量的增加土壤微生物生物量碳出现降低趋势。说明增加土壤盐分含量可明显抑制土壤微生物的活性,从而引起微生物数量的降低[7,15]。但Vanessa等采用盐溶液对土壤进行淋洗表明,高盐溶液淋洗的土壤微生物生物量碳明显高于低盐[6],并且证实较高的盐分通过破坏土壤团聚体等过程提高了土壤有机碳的有效性,且有机碳有效性的增加弥补了盐分对土壤微生物的抑制,从而使高盐分土壤中的微生物生物量碳较高。但本研究中所设置的土壤盐分(0.5%和0.9%)较高,且盐分完全与土壤混合,从而可能导致盐分对土壤微生物活性抑制作用较强。不添加底物和只添加氮处理,3个盐分土壤微生物生物量碳在培养第2天均出现最低值,而添加碳及碳+氮后土壤微生物生物量碳迅速增加,这可能是在底物添加过程中对土壤进行扰动,加速土壤活性碳的释放,从而导致无碳源添加的土壤随着土壤自身活性碳源量的减少,引起土壤微生物的能量供应减少,抑制了土壤微生物的生长繁殖,从而使培养第2天土壤微生物生物量碳较低,但两天后随着微生物对外源底物的慢慢适应与同化,微生物数量得到缓慢增加。而添加碳源后,由于葡萄糖本身是微生物易于利用的有机碳,因此微生物能快速吸收利用此碳源,从而使土壤微生物的数量增加。与不添加底物相比,添加氮源后3个盐分土壤微生物生物量碳含量变化较小,说明单施氮源并不能提高土壤微生物生物量碳,而添加碳及碳氮共同施用条件下可提高盐碱地土壤微生物生物量碳,尽管髙盐分条件下土壤微生物生物量碳增加的幅度相对较小。
土壤微生物呼吸商是指单位微生物生物量碳的呼吸速率,用于反映外界环境变化对微生物的影响。微生物呼吸商高,一方面说明微生物呼吸消耗的碳量相对较高,另一方面说明外界环境条件使微生物产生胁迫,可导致微生物的代谢功能发生变化,使微生物的活性升高而不稳定[19]。本研究不同盐分与底物处理中,培养前2 d土壤微生物呼吸商是最高的,说明培养前2 d微生物对土壤中的碳源消耗较高,这与此时土壤释放CO2的速率较高一致(图1)。次后,土壤微生物呼吸商逐渐降低并趋于稳定,说明微生物对土壤中的碳源消耗较慢[17]。另外,不同底物处理中,低盐分(0.1%)土壤微生物呼吸商最高,而高盐分土壤较低,也说明盐分含量是抑制微生物活性的重要因子之一。尽管添加碳及碳+氮处理,在培养第5天时高盐分土壤微生物呼吸商仍较高,这可能是因为较高的盐分含量使微生物产生胁迫,导致微生物在短时间内活性升高[19]。
土壤溶解性有机碳是土壤有机碳的活性组分,是外界环境变化的敏感性指标[20- 21]。不添加底物和只添加氮处理,各盐分间土壤溶解性有机碳的含量基本保持一致,说明盐分含量对土壤溶解性有机碳的影响较小,同时也证实单施氮肥并不能提高土壤溶解性有机碳含量[21- 22]。但添加碳及碳+氮后,由于葡萄糖本身就是溶解性有机碳,因此短时间内引起土壤溶解性有机碳含量的增加,但较高盐分土壤(0.5%、0.9%)增加的幅度较大,说明短时间内高盐分土壤中的微生物对葡萄糖的利用率相对较低,同时由图1、图3可明显看出培养的前2 d,高盐分土壤(0.9%)释放CO2量及土壤微生物的呼吸商均较低,这也更好地证实了上述观点。
4 结论
(1)在无碳源输入的条件下,增加土壤含盐量可明显降低土壤释放CO2量。添加碳源后,增加土壤含盐量对土壤释放CO2量的影响变小。说明在无碳源输入条件下,土壤盐分是影响土壤释放CO2的重要限制因子。
(2)土壤含盐量(lt;0.5%)较低时,盐分含量对土壤微生物生物量碳的影响较小,增加土壤含盐量(0.9%)可明显降低土壤微生物生物量碳含量。且在无碳源输入条件下,随着含盐量的增加土壤微生物生物量碳的降低幅度较小;添加碳源后,随着含盐量的增加土壤微生物生物量碳的降低幅度变大。
(3)较高的盐分含量可明显降低土壤微生物呼吸商,但添加碳源后短时间内可明显提高土壤微生物呼吸商。
(4)盐分含量对土壤溶解性有机碳的影响较小,尽管添加碳源后短时间内可明显提高较高盐分土壤溶解性有机碳。说明微生物对盐分胁迫的响应较快,较高盐分(含盐量gt;0.5%)可明显降低土壤微对外源碳的利用率。
致谢:感谢薛同同、王军才、刘庆在样品测定过程中给予的帮助。
[1] Yang J S. The progress and development trend of the geochemical study of soil salinity. Soil, 1991, 23(4): 206- 209, 173.
[2] Farshid N, Ahmad R S. A kinetic approach to evaluate salinity effects on carbon mineralization in a plant residue-amended soil. Journal of Zhejiang University Science B, 2006, 7(10): 788- 793.
[3] Pathak H, Rao L N. Carbon and nitrogen mineralization from added organic matter in saline and alkali soils. Soil Biology and Biochemistry, 1998, 30: 695- 702.
[4] Rasul G, Appuhn A, Müller T, Georg Joergensen R. Salinity-induced changes in the microbial use of sugarcane filter cake added to soil. Applied Soil Ecology, 2006, 31: 1- 10.
[5] Xie J,Li Y, Zhai C, Li C, Lan Z. CO2absorption by alkaline soils and its implication to the global carbon cycle. Environmental Geology, 2009, 56: 953- 961.
[6] Vanessa N L W, Ram C D,Richard S B G. Salinity and sodicity effects on respiration and microbial biomass of soil. Biology and Fertility of Soils〗, 2008, 44: 943-953.
[7] Tripathi S, Kumari S, Chakraborty A, Gupta A, Chakrabarti K, Bandyapadhyay B K. Microbial biomass and its activities in salt-affected coastal soils. Biology and Fertility of Soils, 2006, 42: 273-277.
[8] Guan Y X, Liu G H, Liu Q S, Ye Q H. The study of salt-affected soils in the Yellow Rriver Delta based on remote sensing. Journal of Remote Sensing, 2001, 5(1): 46-53.
[9] Liu Q S, Liu G H, Xue K,Song H W. Elementary analysis on characteristics of soil salinization of geomorpholoty units with different scales in the neoteric and moder Yellow River Delta. Chinese Agricultural Science Bulletin, 2006, 22(11):353-359.
[10] Xia J B, Xu J W, Li C R, Liu J T, Wang Y H, Lu Z H. Effect of different road protection forests on soil improment in saline lands of the Yellow River Delta. Journal of Soil and Water Conservation, 2011, 25(6): 72-75.
[11] Lou Y, Li Z, Zhang T, Zhang T, Liang Y. CO2emissions from subtropical arable soils of China. Soil Biology amp; Biochemistry, 2004, 36:1835-1842.
[12] Li L, Zhu H H, Su Y R, Xiao H A, Huang D Y, Wu J S. Effects of rice straw incorporation in situ and ex situ on soil organic C and active organic C in agricultral soils in red soil hilly region. Scientia Agricultura Sinica, 2009, 42(3):926-933.
[13] Li G T, Zhang B G, Li B G. Effect of straw pretreatment on soil micribial biomass and respiration activity. Chinese Journal of Applied Ecology, 2003, 14(12): 2225-2228.
[14] Institute of Soil Science, Chinese Academy of Sciences. Soil Physical and Chemical Analyze (In Chinese). Shanghai: Shanghai Science Press, 1978.
[15] Elgharably A, Marschner P. Microbial activity and biomass and N and P availability in a saline sandy loam amended with inorganic N and lupin residues. European Journal of Soil Biology, 2011, 47: 310-315.
[16] Beltrán-Hernández R L,Coss-Muoz E, Luna-Guido M L, Mercado-García F, Siebe C, Dendooven L. Carbon and Nitrogen dynamics in alkaline saline soil of former lake Texcoco (Mexico) as affected by application of sewage sludge. European Journal of Soil Science, 1999, 50: 601-608.
[17] Li X G, Shi X M, Wang D J, Zhou W. Effect of alkalized magnesic salinity on soil respiration changes with substrate availability and incubation time. Biology and Fertility of Soils, 2012, 48: 597-602.
[18] Dendooven L, Alcántare-Hernández R J, Valenzuela-Encinas C, Valenzuela-Encinas C, Luna-Guido M, Ferez-Guevara F, Marsh R. Dynamics of carbon and nitrogen in an extreme alkaline saline soil: A review. Soil Biology amp; Biochemistry, 2010, 42: 865-877.
[19] Chen W W, Li Y M, Guo P. Relationships between the chemical forms of heavy metals and the microbial biomass, microbial quotient, metabolic quotient of soils in Changchun City. Journal of Northeast Normal University (Natural Science Edition), 2010, 42(4): 144-149.
[20] Wang C, Butterbach-Bahl K, Han Y, Wang Q, Zhang L. The effect of biomass removal and N additions on microbial N transformations and biomass at different vegetation types in an old-field ecosystem in northern China. Plant and Soil, 2011, 340: 397-411.
[21] Li L, Qiu S J, Liu J T, Liu Q, Lu Z H. Roles of soil dissoved organic carbon cycling of terrrestrial ecosystems: A review. Chinese Journal of Applied Ecology, 2012, 23(5): 1407-1414.
[22] Adams A B, Harrison R B, Sletten R S, Strahm B D, Turnblom E C, Jensen C M. Nitrogen-fertilization impacts on carbon sequestration and flux in managed coastal Douglas-fir stands of the Pacific Northwest. Forest Ecology and Management, 2005, 220: 313-325.
参考文献:
[1] 杨劲松. 土壤盐渍地球化学研究的进展及发展趋势. 土壤, 1991, 23(4): 206-209, 173.
[8] 关元秀, 刘高焕, 刘庆生, 叶庆华. 黄河三角洲盐碱地遥感调查研究. 遥感学报, 2001, 5(1): 46-53.
[9] 刘庆生, 刘高焕,薛凯,宋红伟. 近代及现代黄河三角洲不同尺度地貌单元土壤盐渍化特征浅析. 中国农学通报, 2006, 22(11):353-359.
[10] 夏江宝, 许景伟, 李传荣, 刘京涛, 王月海, 陆兆华. 黄河三角洲盐碱地道路防护林对土壤的改良效应. 水土保持学报, 2011, 25(6): 72-75.
[12] 李玲, 朱捍华, 苏以荣, 肖和艾, 黄道友, 吴金水. 稻草还田和易地还土对红壤丘陵农田土壤有机碳及其活性组分的影响. 中国农业科学, 2009, 42(3):926-933.
[13] 李贵桐, 张宝贵, 李保国. 秸秆预处理对土壤微生物量及呼吸活性的影响. 应用生态学报, 2003, 14(12): 2225- 2228.
[14] 中国科学院南京土壤研究所. 土壤理化分析. 上海: 上海科学出版社, 1978.
[19] 陈薇薇, 李悦铭, 郭平. 长春市土壤重金属化学形态与土壤微生物量、微生物商和代谢商之间的关系. 东北师范大学学报 (自然科学版), 2010, 42(4): 144-149.
[21] 李玲, 仇少君, 刘京涛, 刘庆, 陆兆华. 土壤溶解性有机碳在陆地生态系统碳循环中的作用. 应用生态学报, 2012, 23(5): 1407-1414.
EffectsofsalinityandexogenoussubstratesonthedecompositionandtransformationofsoilorganiccarbonintheYellowRiverDelta
LI Ling1, QIU Shaojun2,*, TAN Feifei3, YANG Hongjun1, LIU Jingtao1, LU Zhaohua1,3
1ShangdongKeylaboratoryofEco-enviromentalScienceforYellowRiverDelta,BinzhouUniversity,Binzhou256603,Shandong,China2MinistryofAgricultureKeyLaboratoryofPlantNutritionandFertilizer,InstituteofAgriculturalResourcesandRegionalPlanning,ChineseAcademyofAgriculturalSciences,Beijing100081,China3InstituteofRestorationEcology,ChinaUniversityofMiningandTechnology,Beijing100083,China
In the Yellow River Delta, nearly 50 percent of soils are saline and alkaline. Soil salinization can suppress microbial activity and thus affect the decomposition and transformation of soil organic carbon, while little information was found about the effects of salinity and exogenous C and N amendment on the decomposition and transformation of soil organic carbon in this area. A laboratory experiment was conducted to investigate the effects of soil salinity and exogenous substances on the turnover of organic carbon under conditions with 25℃ and 60% water holding capacity over 45 days. Three levels of salinity (S1: 0.1%; S2: 0.5%; S3: 0.9%) using NaCl (w/w) were imposed in the saline-alkaline cultivated soil in Yellow River Delta. Soil was amended with or without C (750 mg/kg) or inorganic N (30 mg/kg) as glucose or NH4Cl, and 4 treatments were established, including (Control: no substrates addition, N: NH4Cl addition, C: glucose addition, C+N: glucose and NH4Cl addition). The CO2-C emission, soil microbial biomass carbon (SMBC), dissolved organic carbon (DOC) and calculation of the respiratory quotient(qCO2)were determined. Without glucose addition, the cumulative amount of CO2-C emission was highest in S1 during the incubation, and it was decreased by 18.3%—23.7% and 24.3%—39.8% in S2 and S3 compared with S1, respectively. After glucose addition, the cumulative amount of CO2-C emission little changed among the three salinity soils, and especially it was no significant difference between the three salinity soils in C+N treatment. SMBC was higher in S1 and S2 than that in S3 under the four treatments with substrates addition. Addition of NH4Cl had no significant effect, but addition of glucose significantly increased SMBC, and SMBC increased by 80.4%—80.5% or 58.0%—58.7% in S1 and S2 in C or C+N treatment, and only 68.9% or 49.7% in S3. TheqCO2was significant higher in S1 than that in S2 and S3, and it was significantly improved with glucose addition. Compare with the control, DOC reminded unchanged in the N treatment, but it increased in S3 with glucose addition. It was suggested that the CO2emission could be depressed with the increase of soil salinity without C addition, and soil salinity had little influence on CO2emission after C addition. Microorganism was more sensitive to exogenous carbon and soil salinity. The size and the activity of microbial biomass would be improved with C addition, but higher salinity (gt;0.5%) could depress the microbial activity and the utilization of exogenous carbon, resulting in higher SMBC andqCO2and lower DOC in higher salinity soil.
Soil salinity; exogenous substrate; CO2; soil microbial biomass carbon; soil microbial respiratory quotient; soil dissolved organic carbon
国家自然科学基金项目(41101220, 41101277);山东省优秀中青年科学家奖励基金项目(BS2011HZ001);山东省高校科研发展计划项目(J13LE58);滨州学院国家级大学生创新训练计划项目(201210449127);滨州学院博士基金项目(2008Y05)
2012- 06- 27;
2012- 10- 26
*通讯作者Corresponding author.E-mail: shjunqiu@163.com
10.5846/stxb201206290914
李玲, 仇少君, 檀菲菲, 杨红军, 刘京涛, 陆兆华.盐分和底物对黄河三角洲区土壤有机碳分解与转化的影响.生态学报,2013,33(21):6844- 6852.
Li L, Qiu S J, Tan F F, Yang H J, Liu J T, Lu Z H.Effects of salinity and exogenous substrates on the decomposition and transformation of soil organic carbon in the Yellow River Delta.Acta Ecologica Sinica,2013,33(21):6844- 6852.

