酸枣生理生化特性对干旱胁迫的响应
朱广龙,韩 蕾,陈 婧,王艺苗,高亚卉,魏学智
随着全球气候和环境的变化,区域性干旱频发[1-2],干旱胁迫对植物的生长带来了严重的影响,干旱成为影响植物生长、分布和生产的主要限制因素[3-8]。特别是北方地区,生态环境脆弱,干旱化、沙漠化日益加剧,植被恢复及荒漠绿化是改善干旱地区生态环境的重要措施。选择分布广,适应性强,抗逆性高的植物类群进行研究,阐明植物适应逆境的机制,对寻找新的抗逆性强的种质资源进行生态建设与恢复具有重要的理论和实践意义。
酸枣(Zizyphus jujuba Mill.)为鼠李科(Rhamnaceae)枣属(Zizyphus Mill.)植物,原产于我国,广布于华北、西北、东北和华东的向阳山坡、荒芜丘陵和平原,从湿润的海滨到干旱的荒漠,酸枣都有分布[9]。酸枣根系深广,抗旱、耐寒、耐贫瘠能力强,具有重要的水土保持作用,是绿化荒山的先锋树种[10]。对该植物的研究主要分布在生物活性物质提取[11]、药理作用探索[12]、组培嫁接[13]、抗旱结构研究等方面[14],对干旱生理方面研究较少[15]。酸枣分布广泛,耐干旱,可做为干旱地区植被恢复的重要材料。本文以酸枣为试材,以期明确酸枣的抗旱机理和途径,从而为选取抗逆性强的植物资源,为我国干旱、半干旱地区荒山绿化、植被恢复提供理论依据,为酸枣资源的开发利用提供基础资料。
1 材料与方法
1.1 材料
试验试材2009年3月采自山西省临汾市西赵村村南(地处半干旱暖温带半湿润气候区,年平均气温9~13℃,年平均降水量515.7 mm),生境内伴生种为扁核木、野生沙棘、狗尾草等。选取树龄3年、基径3.0 cm左右,株高1.5 m左右,生长健壮一致的实生苗,试验用土采自西赵村农田,测得有机质、氮、磷、钾含量分别是 12.15 g/kg、29.28 mg/kg、3.16 mg/kg、57.67 mg/kg,自然含水量为 11.90%。将试材移栽到塑料桶(上口径×下口径×高=50 cm×30 cm×50 cm)中,移栽时称量并记录每株苗重,每桶装土20 kg,由自然含水量计算土壤干重,以便控水。利用环刀法在原生境测得土壤田间持水量为42.38%,试验地设在山西师范大学,于2010年7月至9月进行。
1.2 方法
1.2.1 实验方法
试验采用盆栽称量控水法进行研究,选取移栽的树苗5株,待叶片完全成熟,使其持续干旱处理,到叶片全部枯萎时测量其土壤含水量,取平均值为酸枣的土壤临界含水量,测得酸枣生长的土壤临界含水量为4.975%,在此基础上设一个对照组,3个干旱胁迫组。对照组(CK):土壤含水量为田间持水量的45% ~48%;轻度胁迫组(L):土壤含水量为田间持水量的35% ~38%;中度胁迫组(M):土壤含水量为田间持水量的25% ~28%;重度胁迫组(S):土壤含水量为田间持水量的15% ~18%;每组3次重复。桶面上覆一层塑料薄膜(厚0.5 mm),以减少水分蒸发,雨天移入防雨棚中;每晚18:00采用称重法补充蒸发的水量,使土壤含水量达到设定的范围,试验持续进行30 d,从处理第10 d开始测相关指标,此后每隔10 d测1轮,共测3轮。
1.2.2 生理生化指标测定方法
测定当天早晨8:00~9:00,选取各处理组相同部位的功能叶数片,测定相关指标,每个样3次重复。可溶性糖测定采用蒽酮比色法[16];可溶性蛋白含量测定用考马斯亮蓝法[17],叶绿素含量测定用乙醇-丙酮抽提法[18-19];抗坏血酸含量测定用钼蓝比色法[20];游离脯氨酸含量测定用磺基水杨酸-茚三酮比色法[3];超氧阴离子自由基含量测定用盐酸羟胺法[21]。
1.2.3 数据处理
利用SPSS18.0和Excel统计软件处理数据、作图,显著性差异检验。
2 结果与分析
2.1 可溶性糖对干旱胁迫的响应
干旱胁迫条件下酸枣叶中可溶性糖的变化如图1所示,随着干旱胁迫的加重,可溶性糖含量呈上升趋势。与CK组相比(第10天),L、M、S组分别增加了32.00%、42.75%、90.89%。随胁迫时间的持续,可溶性糖含量也呈上升趋势,胁迫20 d时,L、M、S各处理组比 CK组增加了59.01%、83.25%、142.37%;胁迫第30天时,各处理组可溶性糖含量高于 CK 组 58.92%、89.89%、171.74%;在同一处理组,可溶性糖含量与胁迫时间成正比。各处理组与CK组相比,差异显著(p<0.05),表明可溶性糖具有重要的生理调节功能,可缓解、抵抗干旱对植物造成伤害。

图1 干旱胁迫下可溶性糖含量的变化
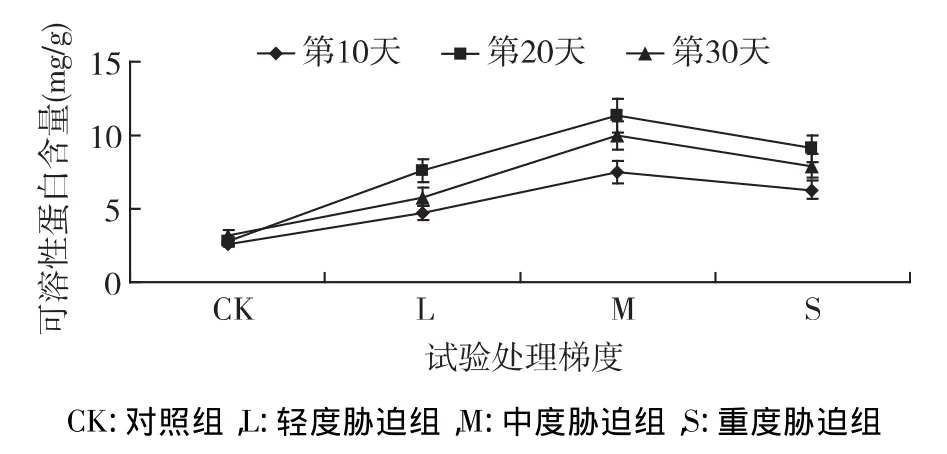
2.2 可溶性蛋白对干旱胁迫的响应
可溶性蛋白是渗透调节物质之一,其对干旱胁迫的响应如图2所示,其含量随胁迫梯度加重呈现出先升高后降低的趋势。与CK相比(第10天),L组可溶性蛋白含量增加了0.78倍,M组其含量达到最高值,增加了1.85倍,S组略有降低,为1.37倍。随着胁迫时间的持续,各处理组可溶性蛋白继续积累,在胁迫第20天时,M 组含量最高达11.36mg/g,为CK组的3.01倍;在胁迫持续到第30天时,可溶性蛋白含量减少,呈下降的趋势,M组含量为9.99 mg/g,高于CK 2.11倍。方差分析显示,各处理组差异显著(p<0.05)。植物通过合成大量可溶性蛋白来进行渗透调节,维持代谢活动,度过不良环境;轻度胁迫促进蛋白质的合成,重度逆境则抑制蛋白质的合成。
2.3 游离脯氨酸对干旱胁迫的响应
PRO是植物重要的渗透调节物质,如图3可知,随干旱胁迫梯度加重、胁迫时间延长,PRO含量均表现出持续上升的趋势。随土壤含水量降低,PRO含量增加,处理第10天 L、M组含量达到189.59 μg/g、274.29 μg/g,分别高于 CK 组0.70、1.45倍,S组其含量最高为558.64μg/g,高于CK组4.00倍。随胁迫时间的持续,其含量持续增加,胁迫20 d L、M 组含量分别为376.98 μg/g、585.894 μg/g,分别是CK的1.87倍、3.45倍;S组含量急剧增加,达到1283.11 μg/g,高于 CK 8.75 倍。到胁迫第30天S组含量最高为1733.23μg/g,是 CK组的12.68倍,各处理组含量均高于前两批,且差异极显著(p<0.01),说明植物在逆境中通过产生大量的PRO来维持细胞的渗透调节能力,保持膜结构的完整性,增强蛋白质之间的水合作用,是植物对逆境响应的一种保护策略。
2.4 AsA含量对干旱胁迫的响应
抗坏血酸(AsA)存在于叶绿体基质中,是一种重要的抗氧化物质,可以作为抗氧化剂清除自由基、活性氧;还原,猝灭,歧化,还可再生VE。在干旱条件下,其含量在酸枣中的变化如图4所示,随胁迫加重,AsA在植物体内逐渐增多,S组(第10天)重度胁迫下其含量最高为508.23 mg/100g·FW,高于正常组78.95%,L及 M 分别高于CK组21.13%、59.33%。随干旱时间的延长,各处理组AsA含量持续增加,胁迫20 d、30 d各组含量均高于第10天,且以第30天含量最高,L、M、S各组含量分别为 537.763 mg/100g·FW、763.52 mg/100g·FW、813.10 mg/100g·FW,分别比 CK 增加了70.67%、142.33%、158.07%。各处理组差异极显著(p<0.01),反映出植物在逆境中合成大量的AsA来缓解氧化损伤。
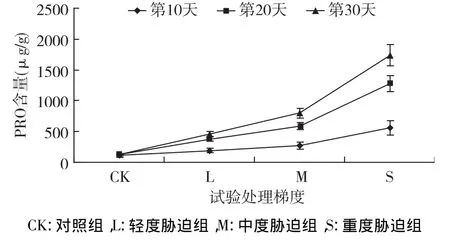
图3 干旱胁迫下游离脯氨酸含量的变化
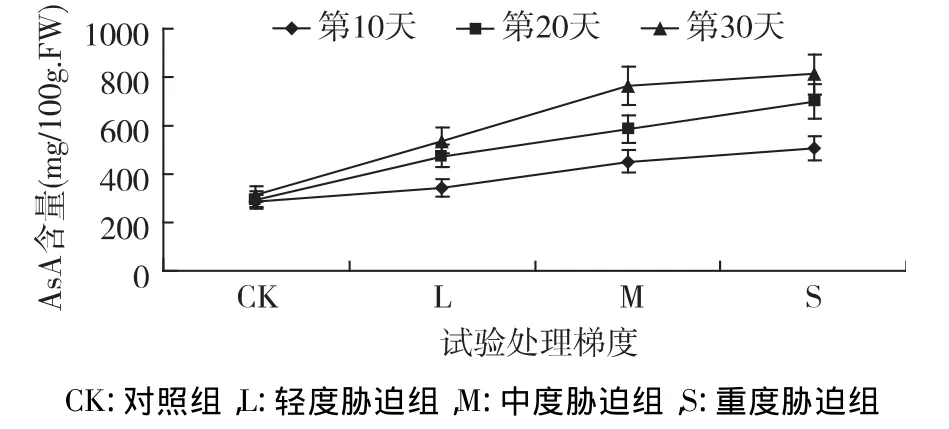
图4 干旱胁迫下抗坏血酸含量的变化
2.5 超氧阴离子自由基对干旱的响应
如图5所示,超氧阴离子自由基在干旱胁迫下急剧增加,第10天 L、M、S组含量为177.55μg/g.FW、222.91 μg/g.FW、376.18 μg/g.FW,高于 CK组0.46 倍、0.83 倍、2.10 倍;随着干旱时间的持续,其含量继续增加,对植物造成伤害加重,第20天各处理组含量高于 CK 组1.97倍、2.96倍、4.51倍;第30天各组含量达到最高,L、M、S含量为448.64 μg/g.FW、637.99 μg/g.FW、823.64 μg/g.FW,高于CK 组2.69 倍、4.24 倍、5.77 倍,且各组间差异显著(p<0.05),超氧阴离子自由基含量在整个胁迫期间随干旱胁迫的加重和时间的持续呈持续增加的趋势。
2.6 光合色素对干旱胁迫的响应
在干旱条件下,叶绿素含量随胁迫梯度的加重而逐渐降低(图6),各组间差异显著(p<0.05)。第10天 L、M、S较 CK相比分别降低了4.35%、8.28%、15.16%;随胁迫时间的持续,叶绿素含量继续降低,胁迫第20天,其各组含量低于CK 4.33%,17.35%、21.33;到胁迫第 30 天,各组含量继续减少,与 CK 相比,L、M、S分别降低了 22.87%、30.69%、33.68%,干旱胁迫影响叶绿素合成速度,促进已形成叶绿素分解,最终导致叶片变黄。
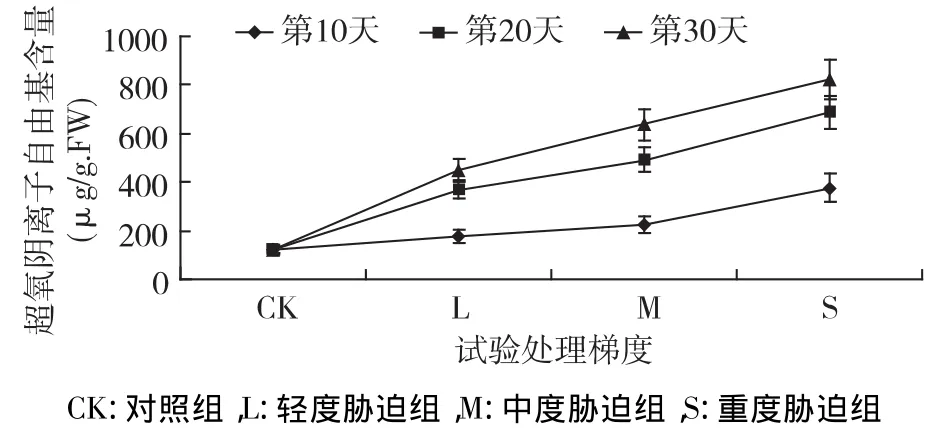
图5 干旱胁迫下超氧阴离子自由基含量的变化
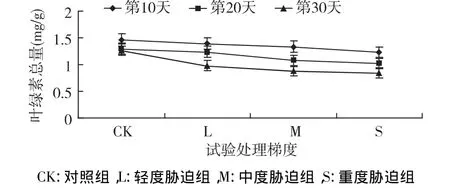
图6 干旱胁迫下叶绿素总量的变化
随胁迫加剧叶绿素a含量降低,各处理组下降趋势平缓(图 7),L、M、S低于 CK 组 9.11%、15.23%、21.49%。随胁迫时间的持续,叶绿素a含量急剧减少,以胁迫30 d含量最低,比CK减少了16.49%、27.02%、31.01%。分析显示各组间差异显著(p<0.05),干旱对叶绿素a影响较大。

图7 干旱胁迫下叶绿素a含量的变化
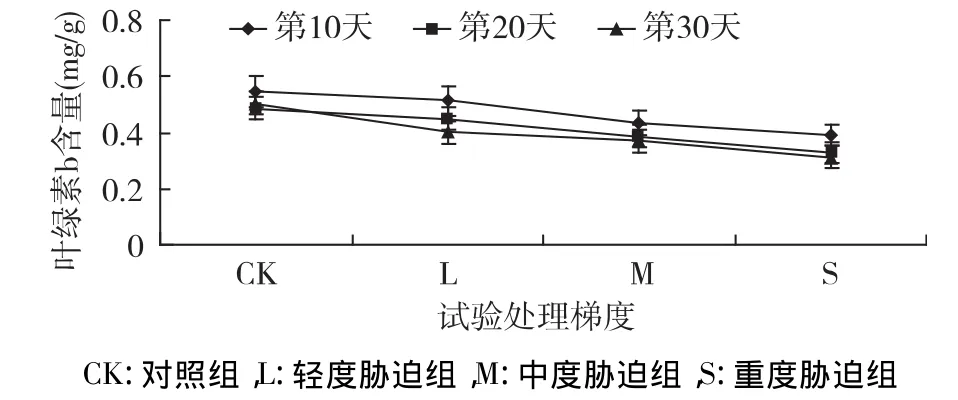
图8 干旱胁迫下叶绿素b含量的变化
叶绿素b含量在整个胁迫期间随胁迫梯度的加重而逐渐降低,如图8所示,处理第10天,其含量下降缓慢,分别降低了 6.39%、20.96%、28.63%;胁迫20 d、30 d降低幅度增大,以30 d含量最少,比CK 减少了 20.5%、26.36%、37.99%,各处理间差异极显著(p<0.01),说明干旱胁迫严重影响了叶绿素b的合成,加速其分解速率。
叶绿素a/b比值下降的程度也可评定作物品种的抗旱性[22],如图9所示,在干旱胁迫第10天、第20天,叶绿素a/b略有增加;与CK组相比,第10天,L、M、S 分别增加了 2.07%、13.83%、17.3%;第20 天,L、M、S 分别增加了 9.56%、8.27%、21.29%。处理30 d时,叶绿素a/b值表现为先降后升的趋势,在L组下降了17.42%,在M和L组增高,M处比值最高为2.35,高于CK组39.67%,S组略有降低,为2.08,高于 CK 组 23.68%。
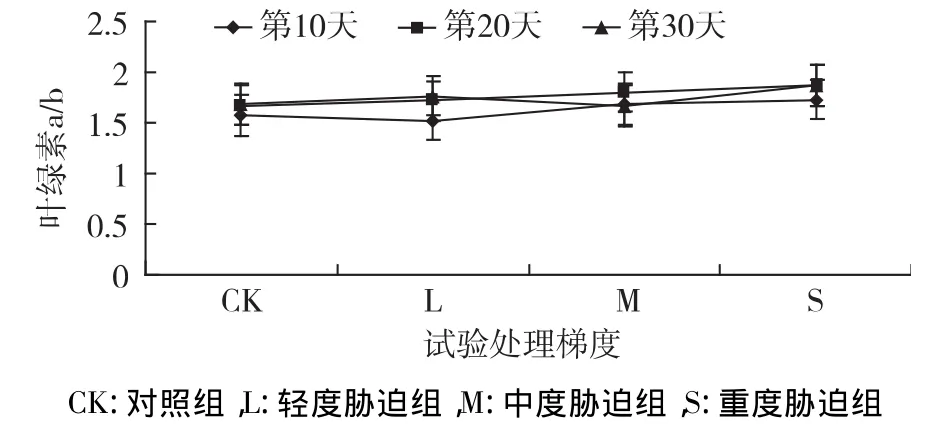
图9 干旱胁迫下叶绿素a/b含量的变化
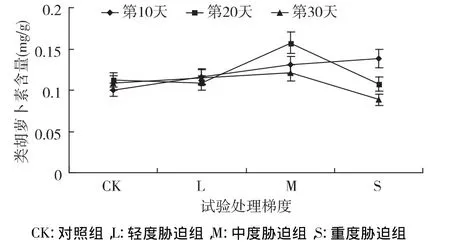
图10 干旱胁迫下类胡萝卜素含量的变化
类胡萝卜素含量在干旱胁迫下的变化如图10所示,在胁迫前期其含量逐渐上升,与CK组相比,L、M、S 组分别增加了 15.76%、30.10%、37.72%;随胁迫时间的持续,其含量表现为先升高后降低的趋势,在M处含量最高,S处含量降低。第20天,M含量为0.16mg/g,与 CK 相比增加了39.93%;S含量为0.11 mg/g,比CK降低了4.49%。第30天,M含量为0.12 mg/g ,增加了 11.35%;S 含量为 0.09 mg/g,降低了18.94%。各处理组间差异显著(p<0.05),说明短期的逆境有利于类胡萝卜素的生成,长期的逆境则抑制其合成或加速其降解。
3 讨论
植物在逆境中其生理生化代谢会发生一系列的变化,以缓解逆境伤害,度过不良时期。在干旱胁迫下植物细胞内大量富集活性氧(H2O2、OH及-O2),引发膜脂过氧化自由基链式反应,造成膜相分离,破坏膜的正常功能,在多数情况下,OH是启动这一反应的直接因子,而O2-·和 H2O2、-O23 种活性氧可以分别通过Haber-Weiss反应和Fenton反应等途径转化为OH后诱发膜脂过氧化[23]。本研究表明酸枣在干旱胁迫下,体内产生大量的超氧阴离子自由基,对细胞造成氧化损伤,引发质膜过氧化反应,对膜的结构和功能造成影响,其含量随干旱的加重和时间的延长持续增加,对植物的危害程度不断加重。植物减轻氧化损伤的途径有2种:一是启动保护酶系统(SOD、POD、CAT);二是产生抗氧化物质(GSH、AsA、VE)。这两条途径协调作用,共同清除或猝灭活性氧。酸枣在干旱胁迫下,AsA含量急剧增多,AsA是一种强还原剂,其与谷胱甘肽、NADP+氧化还原反应相偶联,抗坏血酸氧化酶系统与谷胱甘肽氧化酶系统和NADPH脱氢酶偶联,起到末端氧化酶的作用,以减弱消除氧化损伤。植物降低氧化损伤的能力能反映出其抗旱性的强弱,酸枣在干旱胁迫时累积了高达158.07%的AsA来减缓氧化损伤,是酸枣抗旱性强的表现之一。
渗透调节是植物响应水分胁迫的一个重要生理保护机制。大量研究表明,植物在干旱逆境胁迫下积累大量的渗透调节物质,维持细胞膨压,保证正常的生理代谢活动[24]。在水分胁迫时,植物体内会积累一些小分子的渗透调节物质,如可溶性糖、游离氨基酸、K+和甜菜碱等,而且抗旱性强的品种积累量大于抗旱性弱的[25]。本研究结果显示,在干旱胁迫下,酸枣体内产生大量的可溶性糖、可溶性蛋白、PRO等渗透调节物质,可溶性糖和PRO的变化趋势基本一致,呈持续增加,可溶性蛋白则先增后减,这与蔡昆争[24]、蒲光兰[26]、孙景宽[27]等研究结果一致,且积累量高于沙枣,欧叶李,木本滨藜。其原因可能是干旱引起植物水势降低,导致质壁分离或使细胞死亡,影响酶的代谢活性,使糖酵解途径效率降低或受阻,积累大量的糖类物质;同时糖酵解过程中产生的非糖前体如丙酮酸、草酰乙酸等物质通过糖异生作用合成糖类,所以可溶性糖含量增加。由于糖酵解途径受阻,与之偶联的磷酸戊糖途径代谢增强,形成大量的产物丙酮酸参与TCA循环,经a-酮戊二酸形成脯氨酸,引起脯氨酸含量增加。轻度胁迫可刺激诱导蛋白质的产生,使其含量增加;严重干旱则降低酶的活性,减弱氨基转化作用,抑制蛋白质的合成;并加速蛋白质分解,导致其含量下降。可溶性蛋白,可溶性糖、PRO等物质参与细胞渗透调节、维持细胞膨压,确保代谢正常进行。渗透调节能力是反映植物抗逆性能力的又一重要指标,其主要是通过积累大量的渗透调节物质活化或加强相关代谢途径实现。酸枣在干旱条件下PRO积累量高达12.68倍,可溶性蛋白含量增加了2.11倍,可溶性糖含量增加了171.74%,反映出酸枣具有极强的渗透调节能力,是其抗旱性强的又一表现。
光合色素在光合作用中参与光能吸收、传递及引发光合原初反应。许多研究证实:干旱可以引起Chl a,Chl b和Chl a/Chl b的变化,进而引起光合功能的改变[28]。本研究表明,叶绿素a、叶绿素b及叶绿素总量在干旱胁迫下均降低。其原因可能为Chl a和Chl b化学结构中其卟啉环的中央为Mg,干旱降低植物水势,影响矿质元素的吸收,植物体内的Mg2+减少,使叶绿素合成受阻,导致其含量降低。Chl a和Chl b具有收集和传递光能的作用,参与电子传递和光合磷酸化,干旱降低两种色素的含量,影响光能的吸收和传递,进而影响光合磷酸化作用,使光合作用减弱。且胁迫前期下降缓慢,后期含量急剧减少。Chl a/Chl b的值与植物的抗旱性有关,Chl a/Chl b前期缓慢增加,后期先降后升再降,表明酸枣具有极强的耐旱性,这可能与干旱对Chla、Chl b影响程度不同及Chl a、Chl b合成与分解速率的不同步有关。类胡萝卜素除参加光合作用以外,还具有清除活性氧的作用[29]。本研究表明,短期轻度胁迫促进类胡萝卜素的积累,长期的重度干旱则使其含量降低。酸枣在干旱胁迫下仍能保持较高含量的光合色素,从而维持较高的光合效率,反映出其有较强的耐旱、抗旱能力,其机理还需结合保护酶系统及其它代谢途径深入研究。酸枣具有极强的耐旱性及适应性,可作为生态建设恢复的理想材料。
[1] 景蕊莲.作物抗旱研究的现状与思考[J].干旱地区农业研究,1996,17(2),79 -85.
[2] 张有信,刘学义.黄淮海地区大豆抗旱种质资源的多样性研究[J].中国农业科学,2001,3412(3),251 -255.
[3] Wang Suomin,Wan Changgui,Wang Yanrong,et al.The characteristics of Na+,K+and free proline distribution in several drought- resistant plants of the Alxa Desert,China[J].Journal of Arid Environments,2004,(56),525 -539.
[4] 黄华,梁宗锁,韩蕊莲.持续干旱胁迫对女贞形态与生长的影响[J].林业科学,2008,44(8),145 -148.
[5] 白向历,孙世贤,杨国航,等.不同生育时期水分胁迫对玉米产量及生长发育的影响[J].玉米科学,2009,17(2):60 -63.
[6] 赵海超,刘景辉,任永峰,等.水分胁迫对内农大莜1号裸燕麦品种生长指标的影响[J].作物杂志,2010,(1):73-76.
[7] 丛建鸥,李宁,许映军,等.干旱胁迫下冬小麦产量结构与生长、生理、光谱指标的关系[J].中国生态农业学报,2010,18(1):67-71.
[8] Khan H R,Paull JG,Siddique K H M,et al.Faba bean breeding for drought-affected environments:A physiological and agronomic perspective[J].Field Crops Research,2010,115,279 -286.
[9] 中国植物志编委会.中国植物志:第48卷第1分册[M].北京:科学出版社,1998:135.
[10] 江涛.酸枣的护坡性能及种子萌发研究[D].北京:北京林业大学,2007:9-10.
[11] 回瑞华,侯冬岩,李铁纯.酸枣果肉中挥发性化学成分的提取及分析[J].分析化学,2004,32(3):325 -328.
[12] 史琪荣,周耘,周萍,等.中药酸枣仁的研究概况[J].药学实践杂志,2004,22(2):94 -97.
[13] 韦晓霞,吴如健,熊月明,等.南酸枣嫁接育苗试验初报[J].中国农学通报,2009,25(14):197 -200.
[14] 康东东,韩利慧,马鹏飞,等.不同地理环境下酸枣叶的形态解剖特征[J].林业科学,2008,12(25):136 -139.
[15] 梁静,魏学智.酸枣叶对土壤水分的生理生化响应[J].植物研究,2010,30(5):549 -555.
[16] 刘爽,王庆成,刘亚丽,等.土壤pH值对脂松苗木膜脂过氧化及内源保护系统的影响[J].林业科学,2010,46(2):152-156.
[17] 史薇,徐海量,赵新风,等.胀果甘草种子萌发对干旱胁迫的生理响应[J].生态学报,2010,30(8):2112 -2117.
[18] 李洪燕,郑青松,刘兆普,等.海水胁迫对苦荬菜幼苗生长及生理特性的影响[J].植物学报,2010,45:73 -78.
[19] 王宇超,王得祥,彭少兵,等.干旱胁迫对木本滨藜生理特性的影响[J].林业科学,2010,46(1):61 -67.
[20] 王秀奇,秦淑媛,高天慧,等.植物生理学实验技术[M].2版.北京:高等教育出版社,1999:195-199.
[21] 柯世省,金则新.干旱胁迫对夏腊梅叶片脂质过氧化及抗氧化系统的影响[J].林业科学,2007,43(10):28 -33.
[22] 付秋实,李红岭,崔健,等.水分胁迫对辣椒光合作用及相关生理特性的影响[J].中国农业科学,2009,42(5):1859 -1866.
[23] 胡景江,顾振瑜,文建雷,等.水分胁迫对元宝枫膜脂过氧化作用的影响[J].西北林学院学报,1999,14(2):7 -11.
[24] 蔡昆争,吴学祝,骆世明.不同生育期水分胁迫对水稻根叶渗透调节物质变化的影响[J].植物生态学报,2008,32(2):491-500.
[25] Martino C D,Delfine S,Pizzuto R,et al.Free amino acids and glycine betaine in leaf osmoregulation of spinach responding to increasing salt stress[J].New Phytologist,2003,158:455 -463.
[26] 蒲光兰,肖千文.水分胁迫下核桃叶片生理生化特性[J].安徽农业科学,2009,37(5):1909 -1911.
[27] 孙景宽,张文辉,刘新成.干旱胁迫对沙枣和孩儿拳头的生理特性的影响[J].西北植物学报,2008,28(9):1868 -1874
[28] 应小芳,刘鹏.铝胁迫对大豆叶片光合特性的影响[J].应用生态报,2005,16(1):166 -170.
[29] 李学强,李秀珍.盐碱胁迫对欧李叶片部分生理生化指标的影响[J].西北植物学报,2009,29(11):2288 -2293.

