人参皂苷Rb1对油酸诱导HepG2细胞脂肪堆积的影响作用
陈 静,祁东利,张春风,陈 平,杨中林*
(1.中国药科大学天然药物活性组分与药效国家重点实验室,江苏南京210009;2.武汉工业学院生物与制药工程学院,湖北 武汉430023)
脂肪性肝病包括酒精性脂肪肝病(AFLD)和非酒精性脂肪肝病(nonalcoholic fatty liver diseases,NAFLD)两大类,其中,NAFLD在临床上更为常见,是一种严重影响人们生活质量的常见隐匿性肝病。目前NAFLD的临床治疗药物有胰岛素增敏剂、减肥药、调脂药、降压药、抗氧化剂、细胞保护剂、抗炎细胞因子等类型。由于近年来NAFLD的发病率逐年升高,发病机制未完全清楚,药物治疗也不完善,因此寻找良好的预防和治疗非酒精性脂肪肝病的药物尤为迫切。
人参皂苷Rbl是人参和竹节参的代表成分之一,属达玛烷型三萜皂苷类化合物,具有多种生物活性,对心血管系统,中枢神经系统,免疫系统都具有改善调节作用[1],同时又具有抗肿瘤[2],改善记忆力[3],改善性功能[4]等功效,但尚未见人参皂苷 Rb1对非酒精性脂肪肝病的研究报道。本研究即模拟临床上非酒精性脂肪肝病理特点,利用油酸诱导HepG2细胞形成具有明显脂滴增加特征的脂质堆积肝细胞模型,评价人参皂苷Rb1改善该细胞模型脂质堆积作用及降低细胞内TG含量作用,揭示其在防治脂肪肝方面的潜在价值。
1 材料与方法
1.1 材料
1.1.1 细胞株
人肝癌细胞株HepG2,中国药科大学国家新药筛选中心馈赠。
1.1.2 药物与试剂
人参皂苷Rb1(中国药品生物制品鉴定所,批号:110704-200921);高糖DMEM干粉培养基(美国Gibco公司,批号:991030);胎牛血清(FBS)(美国Hyclone公司,批号:NWC0388);胰蛋白酶(美国Gibco公司,批号:27250018);油酸(美国 sigma公司,批号:026K13971V);油红O(美国Sigma公司,批号:O0625);牛血清白蛋白(BSA)(瑞士Roche公司,批号:738328);TG试剂盒(北京北化康泰临床试剂有限公司,批号:006304);MTT(美国Amresco公司,批号:0793);Western及IP细胞裂解液(碧云天生物技术研究所);二甲基亚砜(DMSO)、异丙醇、乙醇(南京化学试剂有限公司,分析纯)。
1.1.3 仪器
JJ-CJ-1FD型洁净工作台(苏州市金净净化设备科技有限公司);XDS-1B型倒置光学显微镜(重庆光电有限公司);二氧化碳恒温培养箱(Thermo公司);MH-1型细胞板振荡器(海门市其林贝尔仪器制造有限公司);RT-6000型酶标分析仪(深圳书社生命科学股份有限公司)。
1.2 方法
1.2.1 细胞培养
HepG2细胞用含10%FBS的高糖DMEM培养液,在37℃、体积分数5%CO2的饱和湿度条件下培养,每3天用0.25%的胰蛋白酶消化细胞,按1∶3进行传代,取对数期的细胞用于实验。
1.2.2 MTT 法测 HepG2 细胞活力
将HepG2接种于96孔培养板中,每孔接种细胞约1万个,在37℃、体积分数5%CO2培养箱中孵育24 h后,设对照组和终浓度为300、250、200、150、100、50、10、5、1 μg·mL-1人参皂苷 Rb1 加药组,每组6个平行孔。继续培养24 h后,每孔加0.5 mg·mL-1MTT 溶液20 μL,继续培养4 h后取出,弃培养基,每孔加DMSO 150μL,在细胞振荡器上振荡10 min,酶标仪490 nm处测吸光度。根据吸光度计算细胞存活率,选择人参皂苷Rb1合适的给药浓度范围。
式中:A加药490nm为加药组吸光度;A对照490nm为对照组吸光度。
1.2.3 细胞内TG检测
蛋白吸附法配制油酸溶液[5]:70℃振荡水浴下将油酸溶于 0.1 mmol·L-1NaOH 中,配成 100 mmol·L-1的储存液;55℃振荡水浴下将上述储存液滴入10%BSA 的PBS 溶液中,配成浓度5 mmol·L-1的使用液,过滤除菌,-20℃冷冻保存,使用前55℃水浴15 min并冷却至室温。
将HepG2细胞接种于24孔板,孵育24 h后取出,设置对照组、模型组和不同浓度人参皂苷Rb1加药组,每组均设6个平行孔。对照组加含2%BSA的1%FBS高糖DMEM培养基,模型组每孔加含终浓度1 mmol·L-1油酸的1%FBS高糖 DMEM 培养基,各加药组加含终浓度1 mmol·L-1油酸和各浓度(5、10、25、50、75、100、150 μg·mL-1)人参皂苷 Rb1的1%FBS高糖DMEM培养基。将24孔板置于37℃、体积分数5%CO2培养箱孵育24 h后去除培养液,用PBS轻洗两遍,再用Western及IP细胞裂解液充分裂解细胞,6 000 r·min-1离心 5 min,取上清液,用TG试剂盒测定TG含量,并计算各加药组对TG的清除率。

式中:A模型为模型组吸光度;A加药为加药组吸光度。
1.2.4 油红O染色
油红O工作液配制[6]:油红O溶于异丙醇配成0.5%油红O贮备液,以6∶4的比例将贮备液与蒸馏水混匀后过滤2次,至液体澄清为止,得油红O工作液。
将HepG2细胞接种于24孔板,孵育24 h后取出,分为对照组、模型组、低中高浓度(10、50、100 μg·mL-1)人参皂苷Rb1加药组,各组所加培养基同“1.2.3”项下所述。继续孵育24 h后去除培养液,油红O工作液对各组细胞染色30 min,蒸馏水洗两次,在倒置显微镜下观察染色效果。
1.2.5 统计分析
通过Excel软件对数据进行分析、作图,实验结果以平均值±标准误差)表示,采用t检验法比较组间差异,p<0.05具有显著性差异,p<0.01具有极显著性差异。
2 结果
2.1 人参皂苷Rb1的细胞毒理学评价
高浓度的人参皂苷Rb1具有一定的细胞毒性,本实验通过MTT法检测人参皂苷Rb1对HepG2细胞存活率的影响,选取对细胞毒害作用较小的人参皂苷Rb1浓度作为实验的加药浓度。
表1 人参皂苷Rb1对HepG2细胞活力与存活率影响,n=6)

表1 人参皂苷Rb1对HepG2细胞活力与存活率影响,n=6)
组别 浓度(μg·mL-1) A490 nm 存活率对照组 -1.122 ± 0.039 100%1.129 ± 0.124 100.6%5 1.111 ±0.076 99.0%10 1.094 ± 0.047 97.5%50 1.073 ± 0.040 95.6%100 1.034 ± 0.027 92.2%150 1.013 ± 0.046 90.3%200 0.955 ±0.080 85.1%250 0.890 ± 0.045 79.3%1人参皂苷Rb1给药组300 0.847 ± 0.052 75.5%
如表1所示,随着人参皂苷Rb1浓度的增加,细胞存活率逐渐降低,说明人参皂苷Rb1对HepG2细胞有一定的毒害作用。当其浓度小于150μg·mL-1时,细胞存活率在90%以上,对细胞毒害作用很小,因此人参皂苷Rb1的给药浓度可设定在1~150 μg·mL-1之间。
2.2 人参皂苷Rb1对HepG2细胞TG含量的影响
实验选取了对细胞毒害作用较小的人参皂苷Rb1系列浓度,测定该系列浓度下人参皂苷Rb1对HepG2细胞脂肪堆积模型TG含量的影响作用。
表2 人参皂苷Rb1对TG含量的影响n=6)
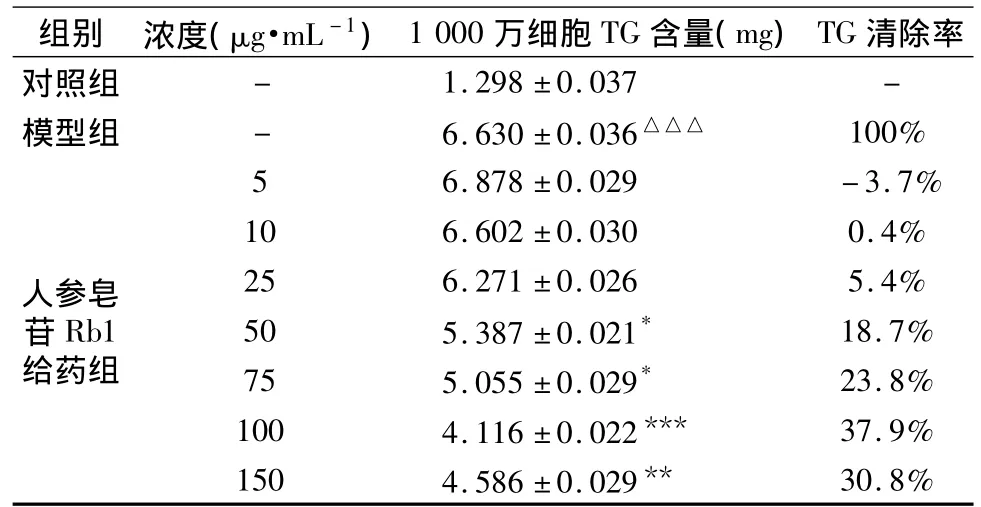
表2 人参皂苷Rb1对TG含量的影响n=6)
注:△△△P <0.001,与对照组比较;*P <0.05,**P <0.01,***P <0.001,与模型组比较
清除率对照组组别 浓度(μg·mL-1)1 000万细胞TG含量(mg)TG 1.298 ±0.037 -模型组 - 6.630±0.036△△△ 100%-5人参皂苷Rb1给药组30.8%6.878 ±0.029 -3.7%10 6.602 ±0.030 0.4%25 6.271 ±0.026 5.4%50 5.387 ±0.021* 18.7%75 5.055 ±0.029* 23.8%100 4.116 ±0.022*** 37.9%150 4.586 ±0.029**

图1 人参皂苷Rb1对TG含量的影响
如表2和图1所示,模型组与对照组相比,TG含量显著增加,具有极显著性差异(p<0.001),表明HepG2细胞脂肪堆积模型成功建立。150μg·mL-1和100 μg·mL-1人参皂苷 Rb1 组与模型组相比,TG含量具有极显著性差异(p<0.01);75μg·mL-1和 50 μg·mL-1人参皂苷 Rb1 组与模型组相比,TG含量具有显著性差异(p<0.05),并且在5~100μg·mL-1浓度范围内随人参皂苷Rb1浓度的升高,对细胞内TG的清除率也逐渐升高,表现出较明显的剂量依赖性,其中100μg·mL-1人参皂苷Rb1组降低细胞内TG的作用最强,对TG的清除率达37.9%。
2.3 人参皂苷Rb1减轻细胞内脂质堆积的作用
倒置显微镜对油红O染色的细胞进行形态学观察(图2),结果显示,与对照组相比,模型组细胞出现大量红色脂滴,脂滴数量非常多,并发生相互融合现象,说明HepG2细胞脂肪堆积模型成功建立。随着人参皂苷Rb1浓度的增加,HepG2细胞红色脂滴数量呈现减少的趋势,且脂滴变小,颜色变浅。低中高浓度人参皂苷 Rb1组中,低浓度组(10μg·mL-1)的效果差,与模型组差异不大;中浓度(50μg·mL-1)组改善细胞内脂质堆积较明显,相较于模型组,减轻了细胞内脂质相互融合的现象;高浓度(100μg·mL-1)组可显著减轻细胞内脂质堆积现象,脂滴数量明显减少,颜色也明显变浅。
通过人参皂苷Rb1对细胞内TG含量影响和改善脂肪堆积现象可知,人参皂苷Rb1具有良好的体外降脂活性,提示其有一定的防治脂肪肝的作用。

图2 各组细胞染色图
3 讨论
自1958年首次正式报道非酒精性脂肪肝病(NAFLD)至今,NAFLD已经成为全球范围内普遍存在并日趋严重的疾病,目前全球的平均发病率大约20%左右,并呈逐年增加趋势。NAFLD是世界范围内导致肝功能异常的主要原因,其典型特征是肝脏脂肪积聚。甘油三酯是NAFLD患者肝脏内蓄积的主要脂质,它的积聚是合成与转化失衡的结果[7]。NAFLD的发病目前尚不能以单一的机制解释,一般认为它是一种遗传-环境-代谢应激相关性疾病,人们广泛接受的理论是Donati和Diehl等提出的“二次打击”学说[8]。
目前国内外对脂肪肝的研究主要采用动物模型,细胞模型研究较少。由于动物模型存在个体差异较大、实验条件不易控制、整体影响因素多、材料耗费多、研究周期长且稳定性较差等不利因素,因此成功建立稳定的细胞模型可很好的克服上述缺点,并且能针对性地探究NAFLD发病的细胞机理。
HepG2细胞易于培养,细胞特性稳定,并已成功用于脂肪肝细胞模型的建立,在细胞水平上筛选脂肪肝防治药物或探讨脂肪肝的病理机制。长链脂肪酸能使HepG2细胞形成明显的脂滴,进而引起HepG2细胞脂肪堆积。在游离脂肪酸中含量最高的是油酸,因此可选择油酸诱导建立肝细胞脂肪堆积模型,它符合 NAFLD 形成的病理生理过程[9]。Yasuyuki等[10]用1 mmol·L-1的油酸诱导HepG2细胞24 h后,成功建立肝细胞脂肪堆积模型;Cui等[11]采用油酸诱导HepG2细胞24h,采用比色定量法研究发现细胞内脂肪堆积程度与油酸浓度(0.1-2 mmol·L-1)呈正相关。
本实验模拟NAFLD的发病过程,选用油酸做造模剂,诱导HepG2细胞24 h成功建立脂肪堆积模型,并选择NAFLD的常规检测指标(TG含量、脂滴量)评价人参皂苷Rb1对细胞内脂肪堆积的作用。实验结果表明,100μg·mL-1人参皂苷 Rb1组作用最显著,其TG含量与模型组比较,具有极显著性差异(p<0.01),对细胞内TG的清除率达37.9%,并且人参皂苷Rb1在5~100μg·mL-1的浓度范围内表现出较明显的剂量依赖性。因此人参皂苷Rb1具有良好的降脂作用,在脂肪肝防治方面具有潜在药用价值,但目前人参皂苷Rb1的降脂机制还不十分明确,具体的机制有待于进一步实验探讨。
[1] 杨艳萍.人参皂苷Rb1药理作用的研究概述[J].中国药师,2010,13(2):280 -281.
[2] 金岩,曲婷婷,柳越冬,等.人参皂苷Rb1、Rg1与5-氟脲嘧啶协同抗肿瘤作用的实验研究[J].中医研究,2006,19(6):16 -18.
[3] 陈声武,王丽娟,王岩,等.人参皂苷Rb1和Rd对不同类型记忆障碍模型小鼠学习记忆功能的影响[J].中国药理学与毒理学杂志,2001,15(5):330 -332.
[4] 王晓英,张均田.人参皂苷Rbl对小鼠性功能的改善作用及其机制探讨[J].药学学报,2000,35(7):492 -495.
[5] Cousin SP,Hugl SR,Wrede CE,et al.Free fatty acid - induced inhibition of glucose and insulin-like growth factor I-induced deoxyribonucleic acid synthesis in the pancreaticβ cell line INS-1[J].Endocrinology,2001,142(1):229 -240.
[6] 吕业春,刘翼翔,吴薇,等.蓝莓多酚对油酸诱导HepG2细胞脂肪累积的干预作用[J].食品科学,2011,32(17):308 -312.
[7] 丁晓东,范建高.非酒精性肝脂肪变性和脂肪性肝炎的发生机制[J].现代消化及介入诊疗,2009,14(4):237 -242.
[8] 夏菁,孙涛.非酒精性脂肪肝发病机制及治疗研究进展[J].海军总医院学报,2010,23(2):100 -103.
[9] 杨林辉,陈东风.油酸诱导培养肝细胞脂肪变性模型的建立[J].重庆医学,2007,36(8):698 -700.
[10] Yasuyuki Okamoto,Shinobu Tanaka,Yoshimasa Haga,et a1.Enhanced GLUT2 gene expression in an oleic-induced in vitro fatty liver modle[J].Hepatol Res,2002,23(2):138 - 144.
[11] Cui Wei,Chen Stephen L,Hu Keqin.Quantification and mechanisms of oleic acid-induced steatosis in HepG2 cells[J].Am J Transl Res,2010,2(1):95 -104.

