低温沉淀法提取高纯度蛋黄卵磷脂的工艺研究
肖文婷,张 帆,李 燕,范杰平,朱建航,*
(1.南昌大学环境与化学工程学院低碳生物技术研究中心,江西南昌330031;2.南昌大学生命与食品科学学院,江西南昌330029)
卵磷脂(lecithin)是一种从植物或动物中提取出来的磷脂混合物,主要包括磷脂酰胆碱(phosphotidylcholine,简称 PC)、磷 脂酰乙醇胺(phosphotidylethanolamine,简称 PE)、磷脂酰肌醇(phosphotidylinositol,简 称 PI)、磷 脂 酰 丝 氨 酸(phosphotidylserine,简称PS)等几种组分,具有重要的生理活性[1],被广泛应用于食品加工、医疗保健、饲料加工、化妆品行业[2-4]。卵磷脂主要来源于大豆和蛋黄,蛋黄卵磷脂中磷脂酰胆碱含量高于大豆3倍,且氧化稳定性更好,所以近年来蛋黄卵磷脂的功能研究和应用开发日益受到人们的关注[5]。目前蛋黄卵磷脂的制备方法主要有溶剂提取法、金属离子沉淀法、超临界萃取法、柱层析法、膜分离法、酶催化法等[1],且以溶剂提取法最具工业应用价值。1981年Larsen等[6]以单一溶剂提取蛋黄卵磷脂,提取率可达71.6%(换算成得率为7.20%),但纯度仅为51.4%,限制了其进一步的应用。此后谢宪章等[7]采用二元混合溶剂提取蛋黄卵磷脂,提取率和纯度均优于单一溶剂,但该工艺毒性溶剂残留较大。为改善溶剂残留问题,Sim[8]以乙醇为溶剂,并结合低温冷藏去除甘油三酯,制得纯度为82%的卵磷脂,虽然该方法可有效控制有毒溶剂的残留,但产品胆固醇含量较高,磷脂组分的纯度偏低。为进一步提高产品纯度,Palacios[9]用4℃丙酮去除胆固醇和中性油脂,使纯度达90%以上,但该工艺操作步骤较多,溶剂用量大,提取率不高,实际生产过程中也受到一定的限制。因此,开发简单易行、高附加值的高纯蛋黄卵磷脂提取工艺已成为亟待解决的研究热点。本研究以鸭蛋蛋黄液为原料,利用低温沉淀法提取高纯度蛋黄卵磷脂,探讨了各因素对卵磷脂得率和纯度的影响,通过实验优化分析,得到了最佳提取工艺条件。与传统工艺相比,该工艺操作简便、提取率高、节约成本,可为蛋黄卵磷脂的工业化生产提供参考依据。
1 材料与方法
1.1 材料与仪器
新鲜鸭蛋 市购;磷脂酰胆碱(PC)标准品、磷脂酰乙醇胺(PE)标准品 Sigma公司;无水乙醇、正己烷、丙酮、钼酸铵、盐酸 分析纯,市购;甲醇、乙腈色谱纯,市购;分析用水 二次蒸馏水,自制。
BSA124S电子分析天平 赛多利斯科学仪器(北京)有限公司;85-2型恒温磁力搅拌器 郑州长城科工贸有限公司;RE-52旋转蒸发器 上海申生科技有限公司;MDF-U333超低温冰箱 SANYO Electric Biomedical Co.,Ltd.;UV762紫外可见分光光度计 上海精密科学仪器有限公司;DZF-6050型真空干燥箱 上海一恒科技有限公司;Agilent 1100高效液相色谱仪 美国Agilent公司。
1.2 实验方法
1.2.1 样品制备 称取一定量鸭蛋蛋黄液,加入适量无水乙醇,在25℃恒温搅拌条件下提取30min后,过滤,滤渣重复以上步骤两次。收集上清液,减压蒸馏至近干,先加入适量正己烷使其完全溶解,再加入一定比例丙酮,然后放入超低温冰箱中冷冻12h取出,倾注分离出沉淀物,经低温丙酮洗涤数次,真空干燥,得高纯度蛋黄卵磷脂,称重,检测。

1.2.2 磷脂含量测定 采用定磷比色法[10]测定含磷量,使用系数25将含磷量换算为磷脂的含量[11]。计算公式为:

式中:P-标准曲线查得的含磷量(mg);n-稀释倍数;m-试样质量(g);25-每毫克磷相当于磷脂的毫克数。
1.2.3 HPLC检测 采用高效液相色谱法测定样品纯度[12-15]。采用外标法定量,计算样品中 PC、PE 组分含量。色谱条件为色谱柱:Sinochrom Si 60柱(4.6mm ×250mm,5μm);流动相:乙腈-甲醇-85%磷酸(7∶2∶0.09,v/v);流速:1.0mL/min;柱温:30℃;紫外检测波长:210nm;进样量:10μL。
1.2.4 实验设计 蛋黄卵磷脂的提取受到诸多因素的影响,本文以卵磷脂得率和磷脂含量为衡量指标,研究料液比、己烷-丙酮体积比、冷冻温度等因素对卵磷脂提取效果的影响。在单因素实验中,料液比(g/mL)设定为 1∶3、1∶3.5、1∶4、1∶4.5、1∶5;己烷-丙酮体积比为 1∶1.5、1∶2、1∶2.5、1∶3、1∶3.5;冷冻温度为-40、-30、-20、-10、0℃,通过单因素实验对提取工艺初步优化。为获得最佳提取工艺条件,在单因素实验的基础上进行三因素三水平正交实验L9(34)(见表1),分析结果确定提取高纯度蛋黄卵磷脂的最佳工艺条件。考虑到实际生产,确定评价指标中权重关系为综合指标Z=0.6×磷脂含量+0.4×得率[16],即 Z=0.6X+0.4Y。

表1 正交因素水平表Table 1 Factors and levels of orthogonal design
2 结果与讨论
2.1 单因素实验
2.1.1 料液比对蛋黄磷脂提取效果的影响 在己烷-丙酮体积比1∶2.5,冷冻温度-20℃条件下,考察了提取过程中料液比对卵磷脂得率和含量的影响,结果见图1。随着料液比的增大,卵磷脂得率和磷脂含量均有明显上升。这是因为增大溶剂用量即增大了蛋黄液与乙醇溶剂的接触面积,促进了蛋黄中磷脂的溶解。当料液比达1∶4(g/mL)后得率和磷脂含量上升趋势逐渐减小,且磷脂含量于1∶4.5(g/mL)处达到最大值。综合考虑,实验选择的料液比为1∶4.5(g/mL)。
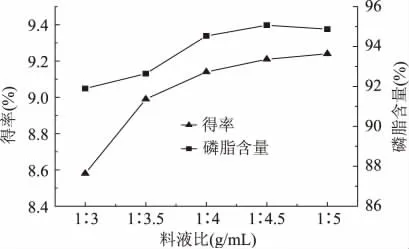
图1 料液比对提取效果的影响Fig.1 Influence of egg yolk-ethanol ratio on extraction effect
2.1.2 己烷-丙酮体积比对蛋黄磷脂提取效果的影响 在料液比1∶4.5(g/mL),冷冻温度-20℃条件下,考察了己烷-丙酮体积比对卵磷脂得率和含量的影响,结果见图2。随着己烷-丙酮体积比减小,卵磷脂得率是先增后减,于1∶2.5时达到最大值;而磷脂含量逐渐增加,增加幅度越来越小。这可能是因为随着体积比减小,己烷-丙酮体系体积变大,卵磷脂及中性脂质部分溶解,且中性脂质溶解量比卵磷脂更大,导致卵磷脂得率下降,含量上升。考虑到实际生产中的溶剂成本,实验选择己烷-丙酮体积比为1∶2.5。

图2 己烷-丙酮体积比对提取效果的影响Fig.2 Influence of hexane-acetone volume ratio on extraction effect
2.1.3 冷冻温度对蛋黄磷脂提取效果的影响 在料液比1∶4.5(g/mL),己烷-丙酮体积比1∶2.5的条件下,考察了冷冻温度对卵磷脂得率和含量的影响,结果见图3。随着冷冻温度升高,卵磷脂得率逐渐降低,且降低幅度逐渐增大;而磷脂含量先升高后降低,在-20℃时达到最大值。这可能是在低温条件下中性脂质和磷脂在己烷-丙酮溶剂体系中的溶解性相互作用和影响造成的[17]。在温度低于-20℃时,其他油脂类物质的溶解度随温度变化更显著,导致温度升高时,得率略有降低,含量有所提高;在温度高于-20℃时,卵磷脂的溶解度随温度变化更显著,导致温度升高时,卵磷脂在溶剂中溶解度增大,从而得率和含量都急剧下降。综合考虑,实验选择冷冻温度为-20℃。
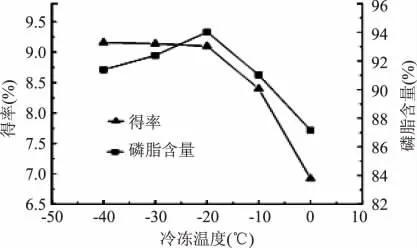
图3 冷冻温度对提取效果的影响Fig.3 Influence of frozen temperature on extraction effect
2.2 正交实验
在单因素实验基础上进行正交实验优化提取工艺条件。综合考察料液比、己烷-丙酮体积比、冷冻温度三个因素的影响,按照L9(34)正交表进行实验,正交实验设计和结果见表2。
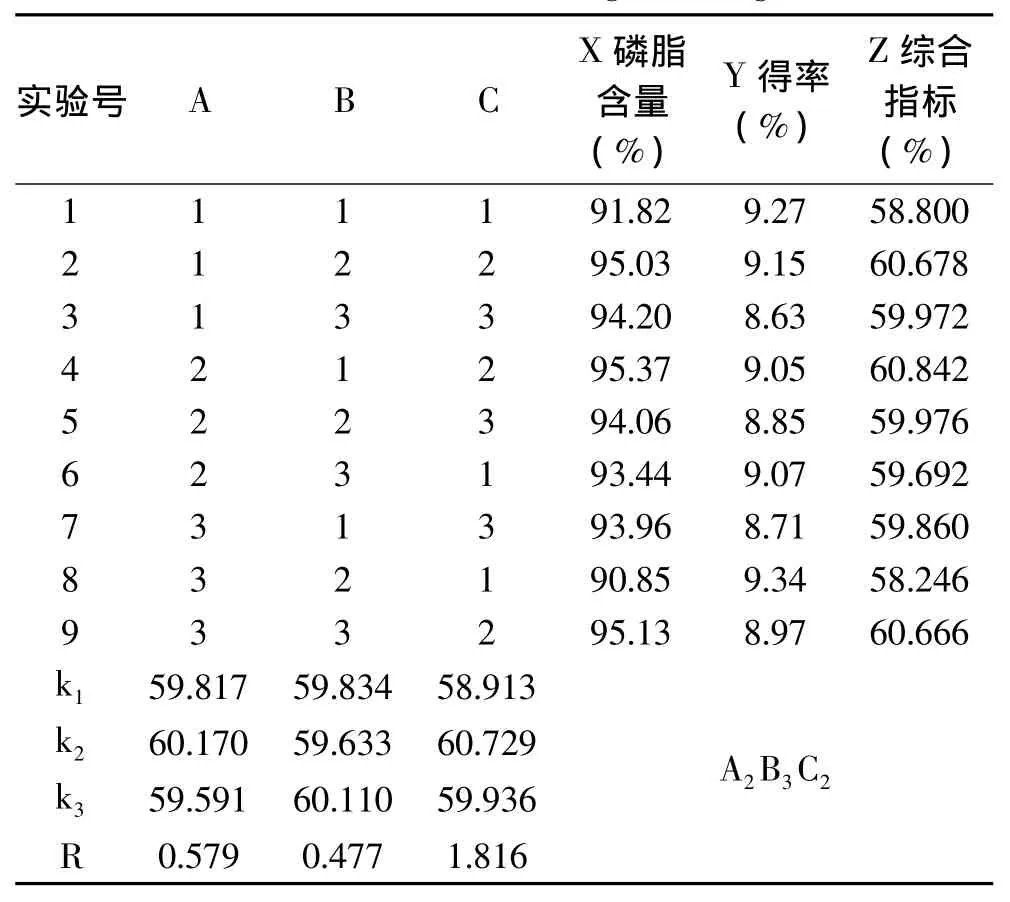
表2 正交实验结果Table 2 Results of orthogonal design
由表2可知,影响卵磷脂得率和含量的因素主次顺序为:C(冷冻温度)>A(料液比)>B(己烷-丙酮体积比)。通过极差分析得到最佳工艺条件:A2B3C2,即料液比 1∶4.5,己烷-丙酮体积比 1∶3,冷冻温度-20℃。从极差值可以看出,己烷-丙酮体积比对实验结果影响较小,综合考虑实际生产成本,验证实验选择的条件为:料液比1∶4.5,己烷-丙酮体积比1∶2.5,冷冻温度-20℃,进行3组重复实验后,测得产品得率为9.37%,磷脂含量为97.68%。
2.3 HPLC检测结果
利用高效液相对标准品及样品进行检测,结果见图4。

图4 高效液相色谱图Fig.4 The HPLC Chromatogram
由图4可以看出,在8.6和9.2min左右,PC标准品和样品均出现两个峰,这是因为PC本身是混合物,其R2位置上存在多种基团,如油酸、亚油酸、花生四烯酸等,导致PC中存在多种单质,如1-棕榈酸-2-二花生四烯酸磷脂酰胆碱、1,2-花生四烯酸磷脂酰胆碱、1,2-二亚油基磷脂酰胆碱等[18-19]。由于这些单质在结构上存在微小差别,造成出峰时间有一定差异,从而出现上图中的峰形。
样品中主要组分的峰形和PC、PE标准品基本一致,表明样品主要组分为PC和PE,通过外标法定量测得PC含量为77.42%,PE含量为18.47%。
3 结论
研究了料液比、己烷-丙酮体积比、冷冻温度对蛋黄卵磷脂提取效果的影响,并通过正交实验优化提取工艺,得到最佳工艺条件:料液比1∶4.5(g/mL),己烷-丙酮体积比1∶2.5,冷冻温度-20℃,该条件下产品的得率可达9.37%,磷脂含量为97.68%。采用高效液相色谱法对样品进行检测,结果表明样品中PC和PE组分含量分别为77.42%和18.47%。本工艺具有操作简单、提取效果好、成本低等优点,对工业化生产鸭蛋黄卵磷脂有着重要的参考价值和指导意义。
[1]常皓,王二雷,宫新统,等 .蛋黄卵磷脂研究概况[J].食品工业科技,2010,31(5):414-417.
[2]迟玉杰,林淑英.卵黄卵磷脂提取与应用的研究进展[J].食品与发酵工业,2002,28(5):50-53.
[3]Y Mine,J Kovacs- Nolan.Biologically Active Hen Egg Components in Human Health and Disease[J].The Journal of Poultry Science,2004,41:1-29.
[4]VJ Sinanoglou,IF Strati,S Miniadis-Meimaroglou.Lipid,fatty acid and carotenoid content of edible egg yolks from avian species:A comparative study[J].Food Chemistry,2011,124(3):971-977.
[5]曹栋,裘爱泳,王兴国.磷脂结构、性质、功能及研究现状[J].粮食与油脂,2004(6):13-16.
[6]JE Larsen,GW Froning.Extraction and processing of various components from egg yolk[J].Poultry Science,1981,60:160-167.
[7]谢宪章,林建华.蛋黄中卵磷脂提取方法的研究[J].食品工业科技,1997(6):35-37.
[8]JS Sim.Extraction of fresh liquid egg yolk[P].Canadian Patent,335054,1999.
[9]LE Palacios,T Wang.Egg-yolk lipid fractionation and lecithin chaaracterization[J].Journal of the American Oil Chemists’Society,2005,82(8):571-578.
[10]中华人民共和国卫生部药典委员会,第二部,第六册(生化药品第一分册)[M].中华人民共和国卫生部药品标准,1998:117-120.
[11]H Nielsen,VKS Shukla.In situ solid phase extraction of lipids from spray-dried egg yolk by ethanol with subsequent removal of triacylglycerols by cold temperature crystallization[J].LWT-Food Science and Technology,2004,37(6):613-618.
[12]王雅蕾,黄建国,马春建.高效液相色谱法测定鸡蛋中的脑磷脂和卵磷脂[J].分析仪器,2010(3):34-37.
[13]关明,王岩,陈坚.高效液相色谱法测定卵磷脂中磷脂酰胆碱的含量[J].化学与生物工程,2005(10):54-56.
[14]TH Yoon,IH Kim.Phosphatidylcholine isolation from egg yolk phospholipids by high-performance liquid chromatography[J].Journal of Chromatography A,2002,949:209-216.
[15]宫新统,林松毅,刘静波,等.HPLC在高纯度蛋黄卵磷脂提取技术中的应用研究[J].食品科学,2008,29(12):242-245.
[16]李桂华,王成涛,方芳.乙醇冷冻法纯化分离大豆磷脂酰胆碱研究[J].粮食与油脂,2010(5):17-19.
[17]谷克仁,张君杰.脱油大豆磷脂的溶剂分提[J].中国油脂,2001,26(6):48-50.
[18]许海丹.蛋黄磷脂的精制工艺及其稳定性研究[D].杭州:浙江大学,2005:35-36.
[19]VV Patil,RV Galge,BN Thorat.Extraction and purification of phosphatidylcholine from soybean lecithin[J].Separation and Purification Technology,2010,75(2):138-144.

