葡萄酒泥酵母超氧化物歧化酶分离提取工艺条件优化
杜 娜,杨学山,韩舜愈,祝 霞,付文力,王 婧,盛文军,张 波
(1.甘肃农业大学食品科学与工程学院,甘肃兰州730070;2.甘肃农业大学生命科学技术学院,甘肃兰州730070)
超氧化物歧化酶(Superoxide dismutase,SOD,EC1,15,1,1)是广泛存在于生物体内的一种胞内金属酶,可催化超氧阴离子(superoxideanions,O2-·)与H+发生歧化反应,解除O2-·对机体的毒害[1]。因此,SOD制剂已被广泛应用于医疗、食品及化妆品领域[2]。自1969年 Mccord从牛血中发现SOD以来,人们已从猪、牛、马等动物红细胞、肌肉、肝脏组织以及植物和微生物中分离化出SOD,其中利用微生物生产SOD具有成本低、周期短、适用于规模化生产和所得产品安全性高等特点[3-6]。研究证实,真核微生物的SOD含量一般高于原核微生物,其中酵母菌含有丰富的线粒体,呼吸系统最完整,因而SOD含量高于其它丝状真菌,可以作为 SOD的主要生产菌种[7-8]。葡萄酒泥是葡萄酒酿造过程中的主要副产物,含有大量的酵母细胞[9]。据统计,2011年我国葡萄酒年产量已达123.2万t,加工各个阶段产生酒泥量约占总加工量的4%~5%[10]。但目前国内葡萄酒泥酵母尚未得到充分利用,大多数企业将其作为饲料、肥料,附加值很低,有一些甚至作为垃圾倾倒,不仅污染环境,而且浪费了宝贵的生物资源[11]。因此,利用葡萄酒泥酵母生产SOD,有较大的经济意义和社会意义。酵母具有较为坚固的细胞壁,破壁效果直接影响SOD的分离提取。苏昕等[12]研究了发酵培养Y12酵母菌分离制备酵母SOD,并对其部分酶学性质进行了深入的探讨;廖湘萍等[13]采用异丙醇破壁法对啤酒酒泥酵母生产SOD进行了研究;王岁楼等[14]采用甲苯破壁法从活性干酵母中直接提取SOD,但利用葡萄酒泥酵母纯化SOD尚未见报道。甲苯可溶解酵母细胞膜磷脂层,改变细胞膜结构,提高细胞膜的通透性,从而使胞内物质释放使[15]。因此,本实验以葡萄酒泥酵母为原料,采用效果较好的甲苯法对酵母细胞进行破壁,并通过正交实验优化提取工艺参数,以期建立较为高效的技术路线,为葡萄酒泥酵母的资源化利用提供一定的技术支持。
1 材料与方法
1.1 材料与仪器
葡萄酒酵母泥 甘肃祁连葡萄酒业有限公司;牛血清白蛋白 pharmacia公司;SOD活性测定试剂盒 南京建成生物工程有限公司;甲苯、三羟甲基氨基甲烷(Tris)、EDTA、柠檬酸、Na2HPO4-12H2O、考马斯亮蓝等常规试剂均为国产分析纯。
SL-1001电子天平 上海民桥精密科学仪器有限公司;TDZ5-WS离心机 湖南仪离心机仪器有限公司;HH-6数显恒温水浴锅 国华电器有限公司;PHS-3C pH计 上海雷磁有限公司;808型紫外-可见分光光度计 日本日立公司。
1.2 实验方法
1.2.1 葡萄酒泥酵母SOD提取技术路线 葡萄酒泥→预处理→收集湿酵母→加入甲苯→热处理→加入磷酸盐缓冲液→室温浸提→离心→热变性→离心→提取液→SOD活性及蛋白质含量测定。
1.2.2 操作要点
1.2.2.1 葡萄酒泥酵母预处理 将葡萄酒酒泥与蒸馏水以1∶1混合,用80目筛筛分,4000r/min离心20min。重复上述步骤,直至所得沉淀为白色,上清液无色透明为止,收集沉淀备用。
1.2.2.2 甲苯破壁 1g湿酵母中加入0.8mL的甲苯溶液,35℃保温 45min后,加入 pH7.8、0.05mol/L的磷酸缓冲液(含0.1mmol/L EDTA)3mL,室温浸提5h,4000r/min离心15min,收集上清液。
1.2.2.3 热变性 收集的上清液置于55℃水浴锅中热处理15min,4000r/min离心15min,除去杂蛋白,即得SOD酶液。取样进行SOD活性及蛋白质含量测定。
1.2.3 单因素实验设计
1.2.3.1 甲苯用量对SOD提取的影响 称取5份各2g 湿酵母细胞,分别加入0.8、1.6、2.4、3.2、4mL 甲苯,35℃保温处理45min,加入0.05mol/L、pH7.8磷酸盐缓冲液6mL,搅拌均匀后在室温条件下浸提5h,离心、热变性去除杂蛋白。测定SOD活性及蛋白质含量。
1.2.3.2 甲苯作用时间对SOD提取的影响 称取5份各2g湿酵母细胞,加入0.8mL甲苯,35℃条件下分别处理 15、25、35、45、55min,加入 0.05mol/L、pH7.8磷酸盐缓冲液6mL,搅拌均匀后在室温条件下浸提5h,离心、热变性去除杂蛋白。测定酶活性及蛋白质含量。
1.2.3.3 甲苯作用温度对SOD提取的影响 称取5份各2g湿酵母细胞,加入0.8mL的甲苯,分别在30、35、40、45、50℃ 保温处理 35min 后,加入 pH7.8、0.05mol/L磷酸盐缓冲液6mL,搅拌均匀在室温条件下浸提5h,离心、热变性去除杂蛋白。测定酶活性及蛋白质含量。
1.2.3.4 磷酸缓冲液pH对SOD提取的影响 称取5份各2g湿酵母细胞,分别加入甲苯0.8mL,45℃保温处理 35min,依次加入 pH7.2、7.4、7.6、7.8、8.0 的0.05mol/L磷酸盐缓冲液6mL,搅拌均匀后在室温条件下浸提5h,离心、热变性去除杂蛋白。测定SOD活性及蛋白质含量。
1.2.4 正交实
验优化 根据单因素实验结果确定葡萄酒泥酵母中提取SOD的正交实验因素和水平,采用L9(34)正交实验设计,优化SOD提取工艺,平行重复3次。

表1 L9(34)正交实验因素水平表Table 1 Factors and their levels in L9(34)orthogonal array design
1.2.5 蛋白质含量测定 本实验采用马斯亮蓝法测定蛋白质含量[16]。通过实验数据绘制的蛋白质标准曲线线性回归方程为:y=0.0049x-0.0069(R2=0.9989)。符合测定要求。
1.2.6 SOD酶活力测定 采用SOD活性测定试剂盒进行。根据蛋白质含量和酶活力测定值计算比活力。

2 结果与分析
2.1 单因素结果与分析
2.1.1 甲苯用量对SOD提取的影响 由图1可知,甲苯用量不同时,所提取的SOD酶比活力不同。当甲苯用量为0.8mL/g时,SOD的比活力最高,提取效果最好,所以选择0.8mL/g为SOD提取的较佳甲苯用量。这主要是由于当甲苯用量不足时,酵母细胞壁没有得到充分破碎,导致SOD释放不完全;过量的甲苯会影响SOD活性,导致酶比活力下降。

图1 甲苯用量对SOD比活力的影响Fig.1 Effect of different amount of toluene on the activity of SOD
2.1.2 甲苯作用时间对SOD提取的影响 由图2可知,甲苯作用时间不同,提取的SOD比活力不同。其中,甲苯作用时间为35min时所提取的SOD酶比活力最高,所以应选择35min为较佳甲苯作用时间。当甲苯用量一定时,较短的作用时间,使酵母细胞壁破碎不充分,提取物中SOD含量较低,导致比活力较低;而较长的作用时间,虽然酵母细胞壁破碎较为充分,但也会导致酵母细胞中其他蛋白组分溶出,影响酶比活力。

图2 甲苯作用时间对SOD比活力的影响Fig.2 Effect of different wall-broken time on the activity of SOD
2.1.3 甲苯作用温度对SOD提取的影响 由图3可知,当加入一定量的甲苯后,作用温度不同时,所提取的SOD酶比活力存在差异。其中,当作用温度为45℃时,所提取的 SOD酶比活力最高,所以选择45℃为甲苯作用的最佳温度。这是由于温度过低时,不利于甲苯对酵母细胞壁的破碎,使SOD不能充分释放;温度过高,影响SOD稳定性,导致比活力下降。
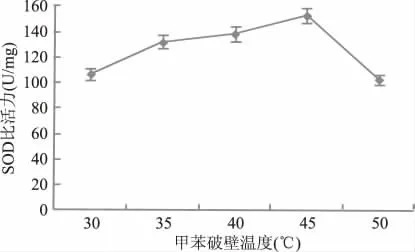
图3 甲苯作用温度对SOD比活力的影响Fig.3 Effect of different temperature on the activity of SOD
2.1.4 磷酸缓冲液pH对SOD提取的影响 由图4可知,当磷酸缓冲液pH为7.8时,SOD的比活力最高,提取效果最好,所以选择pH7.8为SOD提取的较佳磷酸缓冲液pH。当磷酸缓冲液pH小于或大于7.8时,都会使所得到的SOD比活力下降,造成这一结果的原因可能是不同pH条件下SOD的活性存在差异,进而影响所得SOD酶比活力。
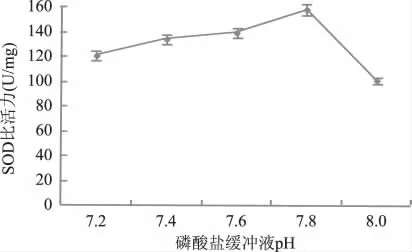
图4 磷酸缓冲液pH对SOD比活力的影响Fig.4 Effect of different pH of phosphate buffer on the activity of SOD
2.2 正交实验结果与分析
根据单因素实验结果,以SOD比活力为考察指标,进行了L9(34)正交实验,实验结果见表2。通过直观分析和方差分析得到最优组合,进行验证实验,确定甲苯法提取SOD的最优工艺。
由表2的数据结果可得出影响甲苯法提取葡萄酒酒泥酵母SOD因素的主次顺序为:A>C>B>D。甲苯法提取葡萄酒酒泥酵母SOD正交实验的最优组合是 A2B1C3D3,即甲苯用量 0.8mL/g,作用时间25min,作用温度50℃,磷酸缓冲液pH8.0。

表2 L9(34)正交实验设计及结果表Table 2 L9(34)orthogonal array design arrangement and experimental results
用spss17.0统计软件对实验结果进行方差分析,其结果见表3。
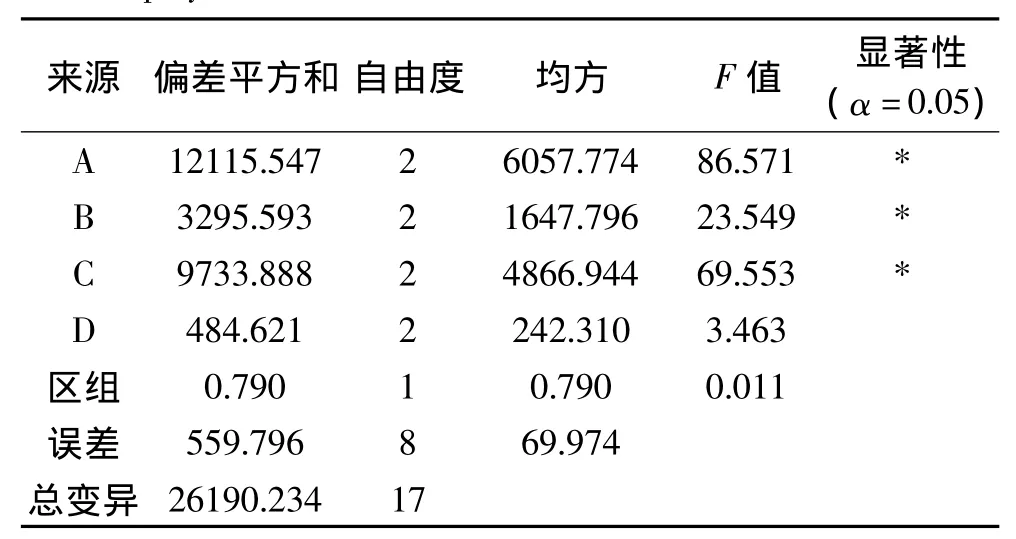
表3 正交实验方差分析结果Table 3 Analysis of variances for extraction yield of polysaccharides with various extraction conditions
由表3可知,甲苯用量、作用时间、作用温度对SOD比活力影响显著(p<0.05),对实验结果影响较大。
2.3 验证实验结果
因正交实验得到的最优组合在L9(34)中未出现,需对最优组合进行验证实验。在甲苯用量0.8mL/g,作用时间25min,作用温度50℃,磷酸缓冲液pH8.0的条件下提取SOD。重复3次,SOD平均酶比活力为178.73U/mg,比正交实验中最优组合得到的酶比活力高。
3 结论
本实验以葡萄酒酒泥酵母为原料,通过L9(34)正交实验确定的最优工艺参数为甲苯用量0.8mL/g,作用时间25min,作用温度50℃,磷酸缓冲液pH8.0,在此条件下提取 SOD,所得 SOD平均比活力为178.73U/mg。
甲苯虽然具有一定毒性,但可通过后续的离子交换层析等工艺去除。因此,利用甲苯破壁法分离纯化葡萄酒泥酵母SOD简单易行,较为廉价,可为葡萄酒泥酵母开发生产SOD提供技术支持。
[1]林庆斌,廖升荣,熊亚红,等.超氧化物歧化酶(SOD)的研究和应用进展[J].化学世界,2006,4(6):378-379.
[2]李东旭,吴蕾.超氧化物歧化酶的提取和纯化技术研究进展[J].食品研究与开发,2008,29(3):183-184.
[3]李海,饶丽娟.超氧化歧化酶的研究现状[J].塔里木农垦大学学报,1998,2(6):10-11.
[4]FRIDOVICH.Superoxide radical and superoxide dismutases[J].Annu Rev Biochem,1995,64(5):97-112.
[5]张彩莹.不同来源的超氧化物歧化酶的部分理化性质比较研究[J].安徽农业科学,2007,35(15):4426-4429.
[6]李宏,单振秀.利用几种原料提取SOD的比较研究[J].贵州农业科学,2009,37(3):93-94.
[7]SABARINATH SUNDARAM,SUNILKHANNA,RENU KHANNA-CHOPRA.Purification and characterization of thermostable monomeric chloroplastic Cu/Zn superoxide dismutase from Chenopodium murale[J].Physiol.Mol.Biol.Plants,2009,15(3):199-203.
[8] AMITRREDDI,LARANTJENSEN,AMORNRAT NARANUNTARAT,et al.The overlapping roles of manganese and Cu/Zn SOD in oxidative stress protection[J].Free Radical Biology & Medicine,2009,46(3):154-162.
[9]郑鹤龄,张斌,潘洁,等.葡萄酒泥农业应用效果研究[J].天津农业科学,2006,12(3):47-48.
[10]刘军,李进,曲健,等.葡萄皮渣的综合利用[J].中外葡萄与葡萄酒,2012,18(3):51-53.
[11] JAROMIRLACHMAN,MILOSLAVSULC,MAREK SCHILLA.Comparison of the total antioxidant status of Bohemian wines during the wine-making process[J].Food Chemistry,2007,10(3):802-807.
[12]苏昕,阎浩林,梁丽.酵母SOD分离纯化及其酶学性质的研究[J].沈阳药科大学学报,2005,22(1):67-68.
[13]廖湘萍,徐功瑾,付三乔.利用啤酒酵母生产SOD的提取条件研究[J].酿酒科技,2007,27(5):89-91.
[14]王岁楼,张平之,张鑫,等.从活性干酵母中直接提取SOD 的研究[J].郑州粮食学院学报,2000,21(2):66-68.
[15]刘晓艳,丘泰球,黄卓烈.不同方法对酵母细胞膜通透性的影响[J].华南农业大学学报,2004,25(1):74-76.
[16] TRAYANA NEDEVA,PAVLINA DOLASHKA -ANGELOVA,VESELA MOSHTANSKA,et al.Purification and partial characterization of Cu/Zn superoxide dismutase from Kluyveromyces marxianusyeast[J].Journal of Chromatography B,2009,87(7):3529-3536.

