肾宁合剂微生物限度检查方法的验证
曾云胜 张先洲
1.湖北省仙桃市第一人民医院药剂科,湖北仙桃 433000;2.武汉大学人民医院药学部,湖北武汉 430060
肾宁合剂是本院结合临床研制的医院制剂,由黄芪、益母草、败酱草、川芎等组成,具有益气活血、利水消肿、调节免疫功能的功效,用于急慢性肾炎、肾病综合征、糖尿病性肾病、急慢性肾功能衰竭等疾病。据调查目前微生物限度不合格是医院制剂不合格的主要因素之一[1],为控制产品质量,本研究按照2010年版《中华人民共和国药典》(简称“中国药典”)附录的相关规定[2],参考相关文献对肾宁合剂微生物限度检查方法进行了验证[3-4],以保证患者用药的安全有效,现报道如下。
1 仪器与试药
1.1 供试品
肾宁合剂,规格:100 ml,由本院制剂室生产;批号:20120413。1.2培养基
营养琼脂培养基,批号:110116;营养肉汤培养基,批号:110112;玫瑰红钠琼脂培养基,批号:110112;4-甲基伞形酮葡糖苷酸培养基(MUG),批号:100820;pH 7.0改良马丁琼脂培养基,批号:101106;无菌氯化钠-蛋白胨缓冲液,批号:100824。以上培养基均由北京三药科技开发公司提供。
1.3 验证试验用菌种
金黄色葡萄球菌 (Staphylococcus aureus)[CMCC(B)26003],大肠埃希菌(Escherichia coli)[CMCC(B)44102],枯草芽胞杆菌 (Bacillus subtilis)[CMCC (B)63501], 黑曲霉(Aspergil1us niger)[CMCC(F)98003],白色念珠菌(Candida albicans)[CMCC(F)98001]。 以上菌种均由中国药品生物制品检定研究院提供。
1.4 仪器和设备
SHINVA立式压力蒸汽灭菌器 (山东新华医疗器械股份有限公司),超净工作台(蚌埠净化设备厂),LRH-250生化培养箱 (上海一恒科学仪器有限公司),HTY-2000A集菌仪,HTY反复使用集菌培养器 (杭州高得医疗器械有限公司)等。
2 细菌、真菌及酵母菌计数方法的验证
2.1 菌液制备
接种白色念珠菌的新鲜培养物至改良马丁培养基上,经25℃培养18~24 h,取1 ml加入到9 ml 0.9%无菌氯化钠溶液中,10倍稀释至10-5,为50~100 CFU/ml菌悬液备用。
接种金黄色葡萄球菌、大肠埃希菌与枯草芽胞杆菌的新鲜培养物至营养肉汤培养基上,经35℃培养18~24 h,取1 ml加入到9 ml 0.9%无菌氯化钠溶液中,10倍稀释至10-6~10-7(50~100 CFU/ml)的菌悬液备用。
接种黑曲霉菌的新鲜培养物于改良马丁琼脂斜面培养基上,25℃培养5 d,加入0.05% 聚山梨酯80的0.9%无菌氯化钠溶液5 ml,将孢子洗脱,吸出孢子悬液至无菌试管内,用0.05%聚山梨酯80的0.9%无菌氯化钠溶液10倍递增稀释制成每毫升含孢子数50~100 CFU的孢子悬液,备用。
将上述5种菌液分别接种至相应的培养基上,金黄色葡萄球菌、大肠埃希菌、枯草芽胞杆菌,35℃培养2 d;黑曲霉、白色念珠菌,25℃培养 2~3 d。
2.2 供试液制备
取供试品10 ml,加pH 7.0无菌氯化钠-蛋白胨缓冲液至100 ml,制成1︰10的供试液。
2.3 细菌、真菌及酵母菌计数方法的验证
供试品对照组:取1∶10的供试液1 ml,立即倾注琼脂培养基,凝固后,置规定温度下,细菌培养 24~48 h,白念珠菌和黑曲霉菌培养48~72 h,按菌落计数方法测定供试品本底菌数。试验组:取1∶10的供试液1 ml和50~100 CFU/ml试验菌,分别注入平皿中,倾注营养琼脂培养基及玫瑰红钠琼脂培养基,5种试验菌株每株试验菌分别制备2个平皿,按平皿法测定其菌数。菌液组:取各试验菌50~100 CFU注入平皿中,立即倾注琼脂培养基,平行制备2个平皿,凝固后,置规定温度下,细菌培养24~48 h,白色念珠菌和黑曲霉菌培养48~72 h,测定所加入的实验菌数。
试验组回收率计算:回收率=(试验组平均菌落数-供试品对照组平均菌落数)/菌液组的平均菌落数×100%。
验证结果提示,5株试验菌人工染菌回收率达到70%以上,表明采用常规法做验证试验,方法可行(表1)。
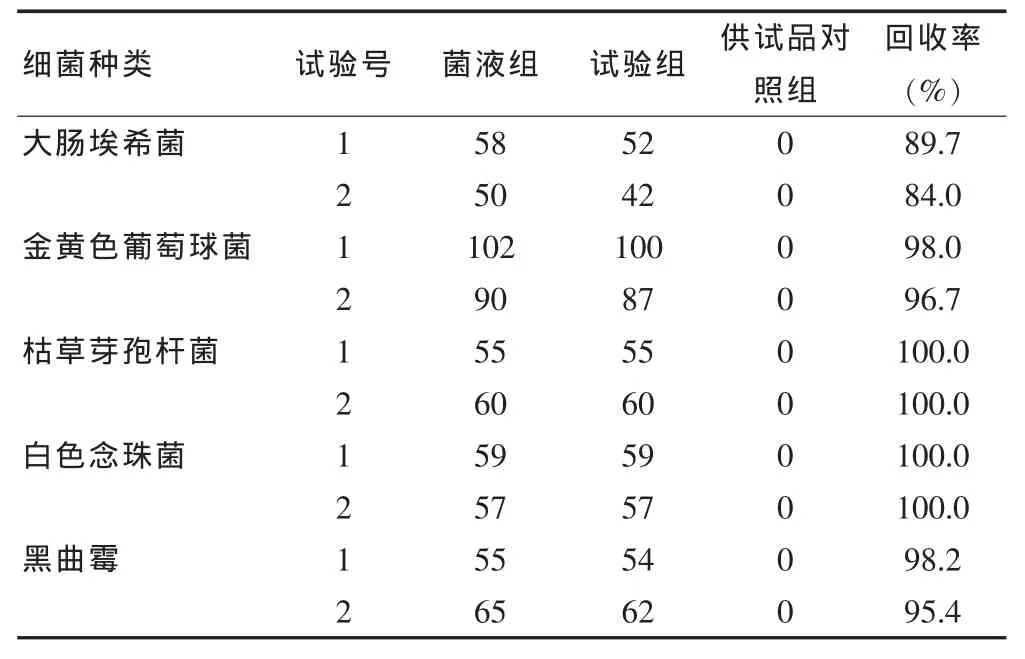
表1 肾宁合剂微生物限度检查方法的验证结果(常规法)(CUF/ml)
3 控制菌检查方法的验证(常规法)
试验组:取1∶10的供试液10 ml和小于100 CFU/ml大肠埃希菌试验菌液加到100 ml胆盐乳糖増菌培养基中,35℃培养24~48 h。取培养物0.2 ml,接种至含MUG培养基5 ml的试管中,35℃培养24 h,在366 nm紫外灯下观察荧光,同时用未接种的MUG培养基作本底对照。试验管MUG为阳性,靛基质试验为阳性,本底对照管为阴性。
阴性菌对照组:同试验组,取小于100 CFU的金黄色葡萄球菌加入到100 ml胆盐乳糖増菌培养基中。阴性菌对照组MUG为阴性,靛基质试验为阴性,本底对照管为阴性。
上述验证结果提示试验组检出了大肠埃希菌,而阴性菌对照组未检出金黄色葡萄球菌,说明可采用常规法对本品进行控制菌(大肠埃希菌)检查。
根据以上验证结果,肾宁合剂的微生物限度检查按照中国药典2010年版第一部附录微生物限度检查法 (附录ⅧC)检查,细菌、真菌及酵母菌数测定和控制菌检查均可采用常规法检验。具体方法如下:
供试液制备:取本品供试液10 ml,加pH 7.0无菌氯化钠-蛋白胨缓冲液至100 ml,制成1∶10的供试液。
细菌数测定:取 1∶10、1∶100、1∶1000 的供试液,采用平皿法测定,符合规定。
真菌及酵母菌数测定: 取 1∶10、1∶100、1∶1000 的供试液,采用平皿法测定,符合规定。
大肠埃希菌的检查:取1∶10的供试液10 ml,加入到胆盐乳糖增菌培养基100 mL中,依法检查,符合规定。
4 讨论
肾宁合剂是由多种中药材经水煎煮醇沉提取后制成的澄明液体,含有多糖、淀粉、蛋白质类物质,这些物质为微生物繁殖提供了营养条件。如果微生物度检查呈假阴性,当样品存放后使用,会产生大量微生物甚至致病菌,因此对肾宁合剂进行微生物限度检查具有重要意义[5]。
本试验中菌液经稀释至适宜浓度后,若在室温下放置,应在2 h内使用,若保存在2~8℃可在24 h内使用,以确保细菌活性及菌数稳定[6-7]。本试验经过考查证明,以1∶10肾宁合剂样品作为最低稀释级供试液,能够消除药品在微生物限度检查中的抑菌作用,5种试验菌的回收率均大于70%,表明稀释剂 pH 7.0无菌氯化钠-蛋白胨缓冲液无抑菌作用[8],对实验无干扰,符合中国药典要求。
[1]安富荣,张纯.2004~2007年上海市医院制剂中抽检不合格制剂质量问题分析[J].中国药房,2008,19(28):2211-2212.
[2]国家药典委员会.中华人民共和国药典(一部)[M].北京:中国医药科技出版社,2010:附录79-83.
[3]马绪荣,苏德模.药品微生物学检验技术[M].北京:华龄出版社,2007:209.
[4]兰鸿,李元宏,杨务彬.乳核内消液微生物限度检查方法学验证[J].医药导报,2011,30(6):804-805.
[5]马亮英,蒋磊.小儿腹泻散微生物限度检查方法验证[J].中国现代药物应用,2011,20 (5):123-124.
[6]卜生高,王劲争.喉咽清口服液微生物限度检查方法的验证[J].中国药事,2009,23(12),1210-12112.
[7]袁汀.清热合剂的微生物限度检查方法的验证[J].山西医药杂志,2011,40(9):869-870.
[8]黄文娴,金国良,王元培.5种医院制剂微生物限度及其质量考察[J].抗感染药学,2011,8(3):198-199.

