罗格列酮对阻塞性睡眠呼吸暂停综合征模型血清和脂肪组织抵抗素、瘦素表达的影响
周 燕,汤凤莲,蔡姗姗
(桂林医学院附属医院呼吸内科,广西桂林 541001)
阻塞性睡眠呼吸暂停综合征(obstructive sleep apnea syndrome,OSAS)可导致心脑血管疾病、内分泌代谢紊乱、脂代谢紊乱、2型糖尿病及胰岛素抵抗等相关并发症,并与肥胖密切相关。肥胖和胰岛素抵抗是OSAS主要发病环节之一,脂肪激素在胰岛素抵抗以及代谢综合征组分疾病的发生、发展中起重要作用。瘦素作为一种脂肪激素,是肥胖与高胰岛素血症、胰岛素抵抗联系的关键所在[1]。抵抗素也是一种由脂肪细胞分泌的新的多肽类激素,由Steppan于2001年在研究抗糖尿病药物——噻唑烷二酮类时发现并命名。本研究旨在观察应用罗格列酮对OSAS猪模型进行干预性治疗后对实验动物抵抗素、表达及高胰岛素血症、胰岛素抵抗的影响,探讨OSAS发病机制,进一步寻找药物治疗的新靶点。
1 材料与方法
1.1 材料
1.1.1 实验动物 选择幼年♀清洁陆川猪23只(由桂林医学院动物实验中心提供),月龄10~12周,体质量30~40 kg,
1.1.2 主要实验试剂 TRIzol RNA提取试剂盒、逆转录试剂盒(大连宝生物公司);TAq酶(北京天根生物公司);Leptin mRNA引物(上海英骏生物公司);兔抗猪Leptin一抗(博士德公司)。
1.1.3 主要实验仪器 多导睡眠监测仪1台(美国泰科公司生产);Legendmiro 17R型微量台式高速冷冻离心机(Thermo公司);Biometra型PCR扩增仪(德国耶拿分析仪器股份公司);JS-780型全自动凝胶成析系统(上海培清科技);酶标仪(Labsystem MK3,芬兰);EPS 301型SDS-PAGE电泳仪(Amersham Pharmacia Biotech公司);SD转膜仪(BIORAD)公司。
1.2 方法
1.2.1 动物模型制备与分组 陆川猪为自然状态下的OSAS动物模型,经呼吸睡眠监测其OSAS发生率为50%[2]。用普通饲料由专人喂养。实验前1周所有动物均做暗适应训练,静脉注射安定(0.1 mg·kg-1),诱导其进入睡眠状态。采用多导睡眠监测仪进行监测其口鼻气流、鼾声、胸腹式呼吸、睡眠呼吸暂停低通气指数及脉搏血氧饱和度,记录时间为7 h,开始4 h为侧卧位,后3 h为仰卧位。根据监测结果,其中符合OSAS诊断标准的12只作为OSAS模型组,将OSAS模型组随机分为两组:OSAS组6只,罗格列酮干预组6只。在不符合OSAS诊断标准的11只中随机选取6只作为健康对照组。罗格列酮干预组(干预组)喂服罗格列酮0.2 mg·kg-1·d-1;正常对照组(对照组)及 OSAS 模型组(模型组)给予等量生理盐水,每天1次。各组均连续12周。实验结束后处死各组实验动物提取大网膜脂肪组织,分别用DEPC水与无菌冰生理盐水冲洗并剪成0.5 g大小的脂肪块,分装在无菌EP管中密封,迅速液氮冷冻,-80℃保存,DEPC水冲洗过的留做RT-PCR,生理盐水冲洗过的留做蛋白质免疫印迹分析(Western blot方法)。
1.2.2 血清学指标检测 所有受试对象均禁食过夜12 h,用20%乌拉坦腹腔内注射麻醉后,抽取耳缘静脉血5 ml,检测空腹抵抗素、瘦素、空腹血糖、胰岛素、胰岛素原,采用HOMA模型公式计算胰岛素抵抗指数(HOMA-IR),HOMA-IR=(胰岛素×血糖)/22.5。抵抗素、瘦素采用酶联免疫分析法(ELISA),试剂盒购自美国 Phoenix Pharmaceutical公司,血糖采用葡萄糖氧化酶法,胰岛素、胰岛素原采用放射免疫(RIA)法。
1.2.3 RT-PCR法检测脂肪组织抵抗素、瘦素mRNA基因的表达
1.2.3.1 提取脂肪组织总RNA 将超低温冻结的RNA提取样品迅速转移至用液氮预冷的研钵中,用研棒研磨组织,期间不断加入液氮,直至研磨成粉末状,取研磨成粉末状的样品100 mg加入到含有1 ml RNAiso plus的2 ml EP管中,轻摇混匀,置于冰浴上匀浆5 min,反复离心,浴上匀浆 5 min,12 000 r·min-14 ℃离心5 min;加入200 μl氯仿,震荡混匀,冰浴上静置 5 min,12 000 r·min-14℃离心 15 min;将上清液移至新的1.5 ml EP管中,加入与上清液等体积的异丙醇,冰浴上静置10 min,12 000 r·min-14℃离心10 min;弃上清保留沉淀,加入1 ml 75%乙醇,12 000 r·min-14 ℃离心5 min;弃上清保留沉淀,干燥;溶解于30~50 μl DEPC处理水中。用紫外分光光度计检测RNA浓度及纯度。
1.2.3.2 总RNA 逆转录成cDNA 各取1 μg RNA按试剂盒操作说明逆转录为cDNA。
1.2.3.3 目的基因片段的 PCR扩增 取1 μl cDNA为模板,分别以瘦素的引物(上游引物5'-ACAAAGGCCAGTTTACGGTT-3',下 游 引 物 5'-ACATCTCCAGGCTTTTATGAGG-3';扩增片段约240 bp);抵抗素的引物(上游引物5'-GTCGCCAGTTTCCTAATTCCTC-3',下游引物 5'-ACCCAGTGACAGCAAAGCCT-3';扩增片段约112 bp)与内参照β-actin的引物(上游引物5'-CTGCGGCATCCACGACCA-3',下游引物 5'-TACTCCTGCTTGCTTGCTGATCCAC-3';扩增片段约273 bp)进行PCR扩增,PCR反应体系为25 μl,扩增条件为:94℃预变性5 min,94℃变性30 s,56 ℃ 退火30 s,72 ℃ 延伸30 s,72 ℃ 终延伸2 min。最后取扩增产物5 μl在含有0.5 mg·L-1溴己啶的1.5%琼脂糖凝胶上电泳,产物条带用凝胶成像系统照相并进行灰度分析。目的片段的相对表达量=目的基因的灰度值/β-actin的灰度值。
1.2.4 蛋白质免疫印迹分析抵抗素、瘦素蛋白含量提取各组脂肪组织总蛋白,用BSA试剂盒测定总蛋白浓度,根据标本蛋白浓度计算上样量,使每孔蛋白上样量一致;行SDS-PAGE凝胶电泳后电转移至硝酸纤维素滤膜上;将膜用5%的脱脂奶粉封闭后,加入抗抵抗素单克隆抗体、抗瘦素单克隆抗体(稀释度1∶500),室温孵育1 h;洗膜后加入二抗鼠抗兔IgG(稀释度1∶1 000)室温孵育1 h;PBST充分洗涤后,用化学发光显影药盒显影,X线胶片曝光记录影像;凝胶成像分析系统分析胶片,读取各目的条带及β-actin的光密度值,计算其比值。
2 结果
2.1 罗格列酮对OSAS模型睡眠监测结果的影响
与模型组比较,干预组 AI、AHI下降,最低SaO2
增加,差异有统计学意义(P<0.05),见Tab 1。
Tab 1 The influence of rosiglitazone on sleep monitoring results of OSAS model(±s,n=6)

Tab 1 The influence of rosiglitazone on sleep monitoring results of OSAS model(±s,n=6)
*P <0.05,**P <0.01 vs control group;△P <0.05 vs model group
Group AI/h AHI/h minSaO2/%Control 2.35 ±0.10 3.13 ±0.20 91.60 ±2.75 Model 29.50 ±10.55** 34.67 ±15.28** 75.69 ±8.52**Treatment 12.65 ±7.10*△ 17.38 ±6.46*△ 82.37 ±6.89*△
2.2 罗格列酮对OSAS模型血清抵抗素、瘦素表达的影响 与对照组比较,模型组血清抵抗素、瘦素、血糖、胰岛素、胰岛素原水平与HOMA-IR均升高,差异有统计学意义(P<0.01);与模型组比较,干预组上述指标数值下降,但血清抵抗素、瘦素水平仍高于对照组,差异有统计学意义(P<0.05),见Tab 2。
2.3 罗格列酮对OSAS模型抵抗素mRNA、瘦素mRNA表达的影响 RT-PCR的扩增产物经琼脂糖凝胶电泳结果显示:正常对照组、模型组和罗格列酮干预组均在240 bp处有特异性的抵抗素mRNA、瘦素mRNA表达条带(Fig 1a-b)。与对照组比较,模型组抵抗素mRNA、瘦素mRNA表达量高于对照组(P<0.01);与模型组比较,干预组抵抗素mRNA、瘦素mRNA表达量低于模型组(P<0.05),但仍高于对照组,差异有统计学意义(P<0.05),见Tab 3、Fig 1a-b。
Tab 2The influence of rosiglitazone on serum resistin,leptin of OSAS model(±s,n=6)

Tab 2The influence of rosiglitazone on serum resistin,leptin of OSAS model(±s,n=6)
*P <0.05,**P <0.01 vs control group;△P <0.05 vs model group
group Leptin/μg·L -1 Resistin/μg·L -1 Insulin/pmol·L-1 Proinsulin/pmol·L-1Blood sugar/mmol·L-1HOMA-IR Control Model Treatment 12.58 ±5.04 23.64 ±8.49**19.11 ±10.72*△41.50 ±5.69 54.09 ±5.06**46.53 ±6.43*△3.70 ±0.51 103.18 ±6.20*4.78 ±0.71△0.37 ±0.64 9.49 ±1.03*0.44 ±0.04△5.33 ±0.71 11.94 ±2.51*7.50 ±0.75△0.88 ±0.13 54.97 ±13.09*1.59 ±0.25△
Tab 3 The influence of rosiglitazone on resistin mRNA、leptin mRNA of OSAS model(±s,n=6)

Tab 3 The influence of rosiglitazone on resistin mRNA、leptin mRNA of OSAS model(±s,n=6)
*P <0.05,**P <0.01 vs control group;△P <0.05 vs model group
Group Resistin mRNA Leptin mRNA Control 0.23 ±0.08 0.04 ±0.02 Model 0.54 ±0.03** 0.16 ±0.02**Treatment 0.37 ±0.01△ 0.10 ±0.01*△

Fig 1a The difference of groups adipose tissue resistiin mRNA expression after 12 weeks of rosiglitazone treatment

Fig 1b The difference of groups adipose tissue leptin mRNA expression after 12 weeks of rosiglitazone treatment
2.4 罗格列酮对OSAS模型抵抗素蛋白、瘦素蛋白表达量的影响 蛋白质免疫印迹分析(Western blot方法)结果显示:Western印迹发现大约65 ku分子量位置上出现阳性条带,经扫描发现:与对照组比较,模型组抵抗素、瘦素蛋白表达水平高于对照组(P<0.01);与模型组比较,干预组抵抗素、瘦素蛋白表达水平低于模型组(P<0.05),但仍高于对照组,差异有统计学意义(P<0.01),见Tab 4、Fig 2ab。
Tab 4 The influence of rosiglitazone on resistin、leptin protein expression of OSAS model(±s,n=6)
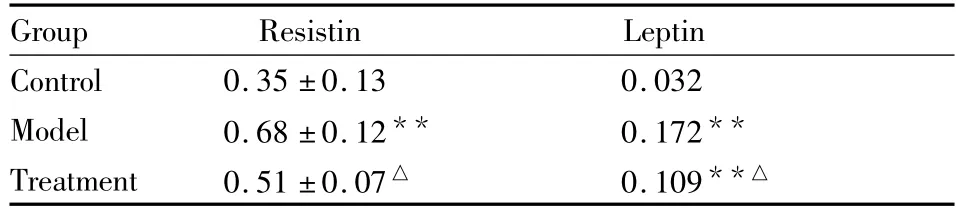
Tab 4 The influence of rosiglitazone on resistin、leptin protein expression of OSAS model(±s,n=6)
*P <0.05,**P <0.01 vs control group;△P <0.05 vs model group
Group Resistin Leptin Control 0.35 ±0.13 0.032 Model 0.68 ±0.12** 0.172**Treatment 0.51 ±0.07△ 0.109**△

Fig 2a The difference of groups adipose tissue resistiin protein expression after 12 weeks of rosiglitazone treatment Fig 2b The difference of groups adipose tissue leptin protein expression after 12 weeks of rosiglitazone treatment
3 讨论
现已证实OSAS为其他许多疾病的共同病理基础,具有相当大的潜在危险[3],与肥胖密切相关。目前对OSAS的病因、发病机制尚不完全清楚,新近研究认为,脂肪细胞因子是导致OSAS发生、发展的重要危险因素[4]。瘦素是摄食调控网络中的上游因子,通过降低动物食欲、提高能量代谢效率、增加能量消耗、减少脂肪储存而减轻体质量。瘦素可以从多个途径参与肥胖调节[5]。抵抗素也是一种由脂肪细胞分泌的新的多肽类激素,其作用是对抗胰岛素的效应,使血糖升高,同时刺激脂肪细胞增殖,而导致肥胖。本研究发现,OSAS猪模型血清抵抗素、瘦素水平明显升高,脂肪组织抵抗素mRNA、瘦素mRNA及蛋白表达灰度值升高,差异有统计学意义(P<0.01)。研究发现OSAS患者血清瘦素水平较非OSAS者升高,与体重指数、胰岛素抵抗指数呈正相关,且与OSAS患者病情的严重程度存在相关性[6]。迄今为止,有两项小型研究观察抵抗素和成人OSAS的关系,发现在不同严重程度的的患者,抵抗素水平与炎症水平相关,随着OSAS严重程度的增加抵抗素水平增加,CPAP治疗后降低[7],而本研究则进一步从分子水平、蛋白水平等方面研究脂肪激素与OSAS发生发展的关系。引起OSAS体内抵抗素、瘦素水平升高的机制可能为[8]:OSAS患者睡眠呼吸暂停低通气指数(AHI)增加,夜间血氧饱和度下降,进而引起交感神经兴奋、血管紧张素升高、血压波动,这些均可导致抵抗素、瘦素水平升高。另外,本研究结果还显示:与对照组比较,OSAS模型组血糖、胰岛素、胰岛素原水平、HOMA-IR均升高,差异有统计学意义(P<0.01);提示OSAS存在高血糖、高胰岛素血症及胰岛素抵抗等并发症。
目前药物治疗0SAHS没有明确的效果。罗格列酮属噻唑烷二酮类药物,是有效的核转录因子过氧化酶体增殖激活受体γ(PPARγ)的选择性激动剂。作为一种新型的胰岛素增敏剂,罗格列酮具有拮抗胰岛素抵抗、降低高血糖、改善脂代谢紊乱、抗动脉粥样硬化的作用[9]。以往的研究发现[10],噻唑烷二酮类药物可通过调节脂联素、瘦素、肿瘤坏死因子的水平而增强胰岛素敏感性,改善IR。本研究结果显示:与模型组比较,经罗格列酮干预后AI和AHI下降,最低SaO2增加;血清抵抗素、瘦素、抵抗素mRNA表达量、瘦素mRNA表达量、抵抗素蛋白表达水平、瘦素蛋白表达水平、血糖、胰岛素、胰岛素原、HOMA-IR均降低,差异有统计学意义。这些结果均提示罗格列酮有可能通过减轻胰岛素抵抗、下调体内抵抗素、瘦素mRNA及蛋白表达量而改善OSAS模型的代谢及临床症状,降低OSAS并发症的发生率。从而为开发治疗OSAS患者的药物提供新的靶点,目前国内外均未见此报道,
由于OSAS发病率较高,危害较大,而抵抗素、瘦素与其密切相关,因此,进一步探讨OSAS与脂肪激素的内在联系、罗格列酮有可能通过减轻胰岛素抵抗而发挥干预治疗OSAS的作用,具有不可忽视的临床意义。未来抵抗素、瘦素作为研究人类OSAS等代谢紊乱相关疾病的病理生理学标志物将越来越受到关注。
[1]Kershaw E E,Fliter J S.Adipose tissue as an endocrine organ[J].Clin Endocrinol Metab,2004,89(7):2548-56.
[2]柳广南,陈学运,张建全,等.一种天然的阻塞性睡眠呼吸暂停低通气综合征动物模型—陆川猪[J].中华内科杂志,2004,43(3):224-5.
[2]Liu G N,Chen X Y,Zhang J Q,et al.Lu Chuan pig-one nature animal modify of OSAHS[J].Chin J Internal Med,2004,43(3):224-5.
[3]Pilla G,Shehadeh N.Abdominal fat and sleep apnea:the chicken or the egg[J]?Diabetes Care,2008,31(suppl 2):303-12.
[4]周 燕,唐 灵,陈梅唏,等.阻塞性睡眠呼吸暂停低通气综合征患者血清脂肪细胞因子变化及其临床意义[J].山东医药,2010,50(21):1-3.
[4]Zhou Y,Tang L,Chen M X,et al.Changes of serum adipocy tokines leve ls in patients with obstructive sleep apnea-hypopnea syndrome and its significance[J].Shandong Med J,2010,50(21):1-3.
[5]Gonzale Z,Jmenez E,Aguilar C,et al.Leptin:a peptide with therapeutic potential in the obese [J].Endocrinol Nutr,2010,57(7):322-7.
[6]王 玮,孔德磊,康 健,等.阻塞性睡眠呼吸暂停患者瘦素、性激素水平与呼吸调节的关系研究[J].中国全科医学,2011,14(4A):1085-7.
[6]Wang W,Kong D L,Kang J,et al.Relation of serum leptin and sex hormone to respiratory control in patients with obstructive sleep apnea[J].Chin Gener Pract,2011,14(4A):1085-7.
[7]Yamamoto Y,Fujiuchi S,Hiramatsu M,et al.Resistin is closely re-lated to systemic inflammation in obstructive sleep apnea[J].Respiration,2008,76(4):377-85.
[8]Alawati N,Mulgrew A,Cheema R,et al.Pro-atherogenic cytokine profile of patients with suspected obstructive sleep apnea[J].Sleep Breath,2009,13(4):391-5.
[9]诸葛铭宁,蔡玉秦,马淑平.罗格列酮对胰岛素抵抗SD大鼠血压和脂蛋白脂酶的影响[J].中国糖尿病杂志,2011,19(10):787-9.
[9]Zhu-ge M N,Cai Y Q,Ma S P,et al.The effects of rosiglitazon on lipoprotein lipase and blood pressure in SD rats with insulin resistance[J].Chin J Diabetes,2011,19(10):787-9.
[10]李慧华,杨 敏,余 敏,等.B3-AR Trp64Arg遗传多态性对T2DM患者罗格列酮疗效的影响[J].中国药理学通报,2009,25(3):317-21.
[10]Li H H,Yang M,Yu M,et al.The effect of β-3-AR Tra64Arg on rosiglitazone response in T2DM patients[J].Chin Pharmacol Bull,2009,25(3):317-21.

