南京地区35家医院2009-2011年常用喹诺酮类药利用分析
王陆军,刘慧,彭婕,方芸(南京大学医学院附属鼓楼医院药学部,南京210009)
喹诺酮类药是一类以1,4-二氢-4-氧-3-喹啉羧酸为基本结构的合成类抗菌药物,通过抑制细菌脱氧核糖核酸(DNA)回旋酶和拓扑异构酶发挥抗菌作用[1]。其主要通过与DNA、DNA回旋酶或拓扑异构酶Ⅳ发生交叉作用形成三元复合物,诱导DNA和拓扑异构酶Ⅳ发生构型改变,从而使酶对DNA不能发生正常功能,最后导致DNA降解及菌体死亡[2]。它具有抗菌谱广、抗菌力强、口服吸收好、组织浓度高、与其他抗菌药物无交叉耐药、不良反应少[3]等特点,已成为临床治疗细菌感染性疾病的常用药物。虽然喹诺酮类药在临床应用仅仅经历了20多年时间,但是目前世界各地不同菌属的耐药细菌已频繁出现。我国的细菌耐药情况由于抗菌药物不合理应用显得尤为严重,在临床应用中存在着很多不合理乃至滥用的状况。如何合理、有效使用抗菌药物已成为抗菌药物管理的重中之重。本文通过对南京地区35家医院2009-2011年常用喹诺酮类药的利用情况进行回顾性统计、分析,旨在为临床合理用药提供参考。
1 资料与方法
1.1 资料来源
数据来源于长江流域医药情报研究所提供的南京地区35家医院2009-2011年喹诺酮类药的销售数据,国产药、合资药、进口药等常用药均列入本次统计范围之内。35家医院中,三级医院19家,二级医院12家,一级医院3家,专科医院1家。
1.2 方法
按喹诺酮类药品种、剂型等分类统计其销售金额、用药频度(DDDs)、日均费用(DDC)、年均增长率(AARG)等。限定日剂量(DDD)是指某一特定药物为治疗主要适应证而设定的用于成人的平均日剂量。本文药品的DDD值根据世界卫生组织(WHO)推荐的为准,未收载的结合《中国药典·临床用药须知》(2010年版)、《新编药物学》(第17版)和药品说明书综合确定。DDDs=某药的总用量(g)/DDD值。DDC=某药的零售金额/该药的DDDs。DDC代表药物的总体价格水平,表示患者应用该药的平均日费用。AARG=[(止年费用或用量/始年费用或用量)1/(止年-始年)-1]×100%。对销售金额、DDDs进行排序并编号,得出各种药的销售金额序号和DDDs序号,并计算销售金额序号和DDDs序号的比值。序号比值是反映销售金额与用药人次是否同步的指标,如果比值接近1,表明该药的销售金额与DDDs同步性较好;比值<1,表明该药价格较高;比值>1,表明该药价格较低。
2 结果与分析
2.1 各年度各类喹诺酮类药销售金额、DDDs和AARG统计
各年度各类喹诺酮类药销售金额、DDDs和AARG统计见表1。
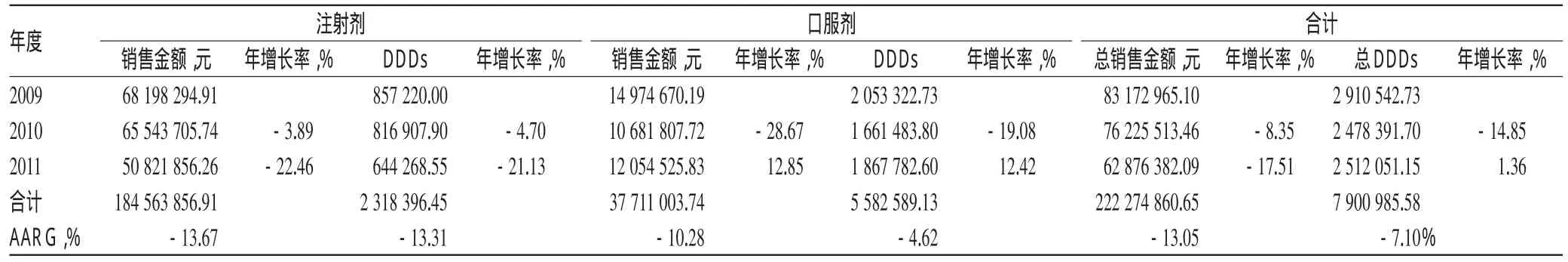
表1 各年度各类喹诺酮类药销售金额、DDDs和AARG统计Tab 1 Consumption sum,DDDs andAARG of quinolones during 2009-2011
由表1可见,该地区医院喹诺酮类药总销售金额整体呈逐年下降趋势,注射剂销售金额下降较口服剂明显。总DDDs年增长率分别为-14.85%、1.36%,AARG为-7.10%。2011年增长率为正值,与口服剂DDDs上升有关。注射剂销售金额所占比例较大,占喹诺酮类药总销售金额的83.03%。但注射剂DDDs所占比例较小,仅占喹诺酮类药总DDDs的29.34%,这是因为注射剂喹诺酮类药价格较高。临床上依然是价格相对较低的口服剂喹诺酮类药占主导地位。
2.2 各年度各种喹诺酮类药销售金额、DDDs和DDC统计
各年度各种喹诺酮类药销售金额、DDDs和DDC统计见表2。
由表2可见,该地区医院3年间共应用了16种喹诺酮类药,其中注射剂有9种。左氧氟沙星注射剂的销售金额3年来一直稳居第1位,分别占各年度喹诺酮类药总销售金额的44.26%、48.28%、46.96%;且其DDDs 3年来稳居第2位,占喹诺酮类药总DDDs的20.88%,可见左氧氟沙星注射剂在临床的应用中占主导地位。口服剂共13种,其中左氧氟沙星的销售金额列第1位,分别占各年度喹诺酮类药总销售金额的9.15%、7.46%、10.13%;其DDDs稳居第1位,占喹诺酮类药总DDDs的42.85%。莫西沙星和莫西沙星注射剂的销售金额和DDDs均呈上升趋势,因莫西沙星为第4代喹诺酮类药,抗菌效果较第3代强且不良反应较少,故在临床的应用越来越广泛。帕珠沙星注射剂销售金额的增长幅度虽然很明显,但因价格昂贵,且为第3代喹诺酮类药,疗效不如第4代喹诺酮类药,因此在临床应用中受到很大限制,其DDDs较小。依诺沙星注射剂、培氟沙星注射剂、环丙沙星、氟罗沙星注射剂、芦氟沙星、司帕沙星、加替沙星注射剂、加替沙星的销售金额和DDDs下降趋势明显,究其原因可能为价格较高、临床效果较左氧氟沙星无明显优势、不良反应较多。吡哌酸、培氟沙星、妥舒沙星在2010年被淘汰,因其治疗窗窄、不良反应发生率高、价格昂贵,临床替代品较多。其他品种也因临床疗效无特别优势,DDDs和销售金额皆呈下降趋势。

表2 各年度各种喹诺酮类药销售金额、DDDs和DDC统计Tab 2 Consumption sum,DDDs and DDC of various quinolones during 2009-2011
销售金额与DDDs序号比值接近于1表明用药同步性较好,主要有氧氟沙星、环丙沙星、培氟沙星注射剂、芦氟沙星、莫西沙星。序号比值>1的有诺氟沙星、洛美沙星、左氧氟沙星、加替沙星,说明价格较低;序号比值<1的有依诺沙星注射剂、环丙沙星注射剂、洛美沙星注射剂、左氧氟沙星注射剂、氟罗沙星注射剂、莫西沙星注射剂、加替沙星注射剂、帕珠沙星注射剂,说明价格较高。这和DDC结果一致,因其剂型全部为注射剂,成本相对口服剂较高。
3 讨论
喹诺酮类药按抗菌谱和结构差异可分为4代,其抗谱菌广,主要针对于革兰阴性(G-)菌、大部分厌氧菌,对葡萄球菌等革兰阳性(G+)菌也有抗菌作用[4]。由表2可见,第1代喹诺酮类已未见踪影,表明其已被淘汰;第2代喹诺酮类以吡哌酸为代表,由于其血药浓度低、抗菌谱窄,仅限于治疗肠道和尿路感染[5]。本组资料中吡哌酸2009年的销售金额仅为120.00元,2010、2011年的销售金额均为0元,表明其已退出南京市场。第3代喹诺酮类药的主要特点是在母环6位碳上引入氟原子,并在侧链上引入哌嗪环或甲基唑环,抗菌活性增强、血浆浓度提高、组织分布改善,因而得到广泛应用[6]。临床常用的品种有诺氟沙星、环丙沙星、氧氟沙星、左氧氟沙星、依诺沙星、氟罗沙星、洛美沙星、司帕沙星、芦氟沙星、托氟沙星、帕珠沙星、培氟沙星。用量最大的是左氧氟沙星,因其为第3代喹诺酮类药的代表,为氧氟沙星的光学活性L-型异构体,其抗菌活性是外消旋体的2倍,是右旋体的8~128倍[7];其抗菌活性可达到氧氟沙星的1~4倍[8],故受到广泛应用。而以莫西沙星、加替沙星为代表的第4代喹诺酮类药抗菌谱除与第3代喹诺酮类药一样对G+、G-菌有效外,还扩展到了支原体、衣原体;对抗厌氧菌也明显比第3代喹诺酮类药强;明显降低了对中枢神经系统的毒性和药物诱发的光敏反应,近年来的应用越来越广泛。
由表1可知,南京地区35家医院喹诺酮类药的销售金额和DDDs整体呈下降趋势,远低于上海地区医院2006-2008年喹诺酮类药的销售金额(分别为24356.54、27404.71、30914.73万元[9]);且销售金额和DDDs的AARG分别为-13.05%和-7.10%,也远低于上海地区2006-2008年喹诺酮类药销售金额和DDDs的AARG(分别为12.66%和0.48%[9])。DDDs在2011年有所上升,是因为增加了新品种。注射剂与口服剂品种数相差不多,但销售金额和DDDs却相差较大,注射剂的销售金额是口服剂的4.9倍,而DDDs却只有口服剂的2/5,说明注射剂的价格相对偏高,临床应用没有口服剂广泛;DDC排序同样显示出注射剂的价格普遍较高。
统计显示,价廉物美、使用方便的口服药在临床仍占主导地位。这是因为喹诺酮类药的主要特点是生物利用度高,口服用药与静脉用药的生物利用度差别不大,临床疗效无明显差异。所以,临床应该主要采用口服给药方式,以便降低用药费用和减少治疗成本,减轻患者负担[9]。近年来,国际上已广泛提倡抗菌药物采取序贯疗法,用于治疗呼吸系统、泌尿系统、腹部和皮肤软组织感染[10]。
从表2中可以看出,依诺沙星注射剂、培氟沙星注射剂、环丙沙星、氟罗沙星注射剂、芦氟沙星、司帕沙星、加替沙星注射剂、加替沙星的销售金额和DDDs下降趋势明显,加替沙星的用量减少与其严重的不良反应有关,包括过敏性休克、血糖异常、心脏毒性、神经系统毒性等。2006年6月加替沙星已宣布在美国、加拿大撤市[11],但其销售金额和DDDs排名依然在前5位,且DDC也较高。在临床应用中应严格掌握其适应证、禁忌证,尽可能避免其不良反应的发生。随着其他喹诺酮类药的广泛应用,加替沙星可能会逐渐退出我国市场。其他第3代喹诺酮类药,抗菌谱和左氧氟沙星类似,因应用时间短、疗效相对于左氧氟沙星无明显优势,故在临床的应用也逐渐减少。妥舒沙星和培氟沙星在2010年退出市场,原因可能为二者均为第3代喹诺酮类药,疗效无明显优势。且妥舒沙星价格极其昂贵;培氟沙星的不良反应发生率较高(文献报道培氟沙星不良反应发生率为8%~16.9%[12]),其注射剂的销售金额和DDDs下降也十分明显,与之相符。
莫西沙星注射剂、帕珠沙星注射剂、安妥沙星的销售金额和DDDs呈上升趋势,尤其是帕珠沙星注射液的销售金额增幅较大,但其DDDs增幅较小,与其价格较高有关。莫西沙星是第4代新型8-甲氧基氟喹诺酮类药,它既保留了抗G-需氧菌的高效活性,又增强了对G+菌、厌氧菌及非典型病原体(支原体、衣原体、军团杆菌)的抗菌活性,具有体内药物浓度高、血浆消除半衰期长、疗效好、几乎无光敏反应、与其他抗菌药无交叉耐药性等优点,且在临床中应用广泛[13]。由于其良好的临床疗效,已对第3代喹诺酮类药的应用产生威胁。安妥沙星从2010年进入南京市场,2011年销售金额和DDDs增幅较大。安妥沙星是我国第1个具有自主知识产权的新型氟喹诺酮类药,临床研究显示药动学性质良好,与最新的第4代氟喹诺酮药相比,其口服剂量、蛋白结合率最低,半衰期达20 h,每日只需给药1次,是真正意义上的长效氟喹诺酮类药[14]。临床研究结果表明,安妥沙星在正常受试者中耐受性良好,在首次0.4 g、以后每次0.2 g、每日1次给药剂量下,治疗轻、中度急性细菌性感染包括呼吸系统感染、泌尿系统感染、皮肤软组织感染具有良好的安全性和有效性[15]。因其各方面的优越性,可能将成为未来喹诺酮类药的主要代表。
综上所述,南京地区医院喹诺酮类药的销售金额和用量总体呈下降趋势,尤其是2009年卫生部下发的《卫生部办公厅关于抗菌药物临床应用管理有关问题的通知》要求严格控制氟喹诺酮类药的临床应用,本研究结果符合国家对喹诺酮类药的管理目标。个别品种因其不良反应等原因导致销售金额和用量明显下降,而主要品种的应用基本稳定,新品种的应用上升势头明显。为延缓细菌耐药性的产生,在应用中临床医师要根据喹诺酮类抗菌药的药效、药动学特性、药敏试验结果及患者机体状况等选择合适的喹诺酮类药;仍应加强其应用监测,防止盲目使用而导致滥用,以确保临床用药安全、有效和经济。
[1]李秀敏.氟喹诺酮类药的进展与临床应用评价[J].中国医院用药评价与分析,2003,3(2):83.
[2]姚丽,郝巧娥,徐敏.2008-2010年氟喹诺酮类抗菌药物应用分析[J].北方药学,2011,8(7):75.
[3]蔡卓倩,陆基宗.喹诺酮类抗生素的新进展和临床应用[J].药品评价,2006,3(3):220.
[4]闻群.2009年我院喹诺酮类药临床应用与不良反应分析[J].海峡药学,2011,23(5):230.
[5]黄广泰,谭少华.2006-2008年广州地区20家医院喹诺酮类药的利用分析[J].国际医药卫生导报,2009,15(22):118.
[6]张顺国,毛五妹,徐敏弘.长江流域6城市156家医院2000-2003年喹诺酮类药利用分析[J].中国药房,2005,16(2):118.
[7]倪文升,李安良.药物化学[M].北京:高等教育出版社,1999:545-553.
[8]杨帆,焦红梅,张婴元,等.左氧氟沙星治疗细菌性感染70例[J].中国新药与临床杂志,1998,17(6):69.
[9]陈敏玲.上海地区81家医院2006-2008年喹诺酮类抗菌药物利用分析[J].中国药房,2009,20(32):2492.
[10]徐平,宋卫东,皮佳俐,等.莫西沙星序贯治疗社区获得性肺炎住院患者疗效观察[J].中国感染与化疗杂志,2011,11(5):335.
[11]赵方允,宋沧桑,马驰.加替沙星不良反应的中文文献分析[J].中国医院用药评价与分析,2008,8(2):147.
[12]汪复.氟喹诺酮类药物临床用药进展[J].中华内科杂志,2002,38(1):65.
[13]黄艳飞.莫西沙星临床应用进展[J].中国医疗前沿,2011,6(22):69.
[14]谢燕萍.喹诺酮类药研究进展[J].临床合理用药,2012,5(1 A):143.
[15]梅友健.新型高效广谱抗菌药物:安妥沙星[J].安徽医药,2010,14(2):229.

