眼镜蛇毒对大鼠丘脑网状核c-jun表达的影响
黄 锐,刘 敏,熊克仁
(皖南医学院 解剖学教研室,安徽 芜湖 241002)
在我国分布着各类毒蛇,眼镜蛇就是其中的一种,对人生命造成一定的威胁。眼镜蛇毒是由眼镜蛇毒腺分泌的一种毒蛋白,化学成分复杂,具有多种毒理和药理效应。TRN是位于丘脑前外侧面的一个核团,与感觉、运动和边缘系统等活动密切相关[1]。c-fos基因属于即刻早期基因,参与细胞的生长、繁殖、分化、信息传导、学习以及记忆等功能[2]。我室曾报道眼镜蛇毒对TRN c-fos的表达有上调作用[3]。c-jun基因也属于即刻早期基因家族,与c-fos关系密切[4]。c-jun在眼镜蛇毒作用下表达如何,尚未见报道。本实验旨在探讨眼镜蛇毒对大鼠TRN c-jun表达的影响,为探讨眼镜蛇毒中毒机制提供相关的形态学依据。
1 材料与方法
1.1 蛇毒 眼镜蛇毒(干毒),由安徽黄山市屯溪毒蛇养殖研究所提供。
1.2 实验动物及分组 实验用SD大鼠18只,由皖南医学院动物中心提供,雌雄不拘,体质量230~270 g。随机分为正常组、生理盐水组和眼镜蛇毒组,每组6只。
1.3 实验方法 眼镜蛇毒组大鼠右后肢常规消毒后,将生理盐水与干粉状眼镜蛇毒按3∶1比例稀释,于大鼠右后肢下部按0.5 μl/kg肌肉注射;生理盐水组于同一部位注入等量生理盐水;正常对照组大鼠不作任何处理。观察30 min,待蛇毒组大鼠出现毛发竖立、焦躁、呛咳、呼吸急促伴哮鸣音或湿性啰音等明显中毒症状时,将3组大鼠同时处死,用100 ml生理盐水和300 ml 4%多聚甲醛经心脏灌注固定,取大鼠脑TRN节段在4%多聚甲醛固定液中于4℃冰箱固定24 h后取出,流水冲洗30 min,酒精梯度脱水,二甲苯透明及浸蜡,包埋制成蜡块。石蜡切片,片厚5 μm,切片入二甲苯脱蜡、梯度酒精复水,依次进入下列各步骤:3%H2O2室温(24~28℃)封闭7 min,在0.01 mol/L枸橼酸缓冲液中行微波修复,自然冷却,滴加正常山羊血清封闭液在恒温箱中孵育 1h,不洗,滴加 c-jun抗体(1∶1 200),4℃冰箱过夜。第2天取出,于恒温箱中复温1 h,滴加生物素化羊抗兔IgG于恒温箱中2 h,滴加链酶亲和素-生物素-过氧化物酶复合物(SABC)液于恒温箱中1 h,二氨基联苯胺(DAB)显色。恒温箱温度均设定在37℃。最后经酒精脱水和二甲苯透明后行中性树胶封片,晾干,光镜下观察。
1.4 细胞计数及图像处理 每组选取相同部位切片进行观察,以王平宇的大鼠脑切片图谱为参照,采用黑马病理图像分析系统进行细胞计数及平均灰度值测量。
1.5 统计分析 采用SPSS 13.0软件进行统计分析,数据结果以均数±标准差(±s)表示,多组间采用F检验,组间两两比较采用q检验,以α=0.05作为检验水准,P<0.05作为判定有统计学意义的依据。
2 结果
2.1 眼镜蛇毒对TRN c-jun阳性细胞数和平均灰度值的影响 正常组、生理盐水组和眼镜蛇毒组大鼠TRN均可见c-jun阳性细胞。c-jun阳性细胞呈棕黄色,主要为胞浆着色,着色较均匀。生理盐水组与正常组大鼠TRN c-jun阳性细胞数量及平均灰度值相比较无明显改变(P>0.05);眼镜蛇毒组大鼠TRN c-jun阳性细胞数量及表达强度与生理盐水组和正常组相比均显著增高(P<0.01),平均灰度值显著降低(P<0.01)。结果见表1、图1和图2。
表1 各组大鼠TRN c-jun阳性细胞数及平均灰度值(±s,n=6)Tab 1 The number of c-jun positive cells and the average gray value in TRN for each group of rats(±s,n=6)

表1 各组大鼠TRN c-jun阳性细胞数及平均灰度值(±s,n=6)Tab 1 The number of c-jun positive cells and the average gray value in TRN for each group of rats(±s,n=6)
注:两两比较采用q检验,两组间字母不同P<0.05,字母相同P >0.05
组别 细胞数(个/10×40倍视野)平均灰度值正常组 24.60 ±2.46a 127.27 ±5.51a 0.000 0.000生理盐水组 22.80 ±2.39a 132.30 ±2.18a眼镜蛇毒组 43.60 ±2.32b 103.90 ±8.72b F 值 139.43 37.19 P值
2.2 眼镜蛇毒对TRN不同形态c-jun阳性细胞的影响 三组大鼠TRN均可见圆形、椭圆形、梭形及三角形等多种形态的c-jun阳性细胞。生理盐水组细胞形态与正常组相比无明显改变(P>0.05);眼镜蛇毒组圆形、椭圆形、梭形细胞数量比生理盐水组及正常组明显增多(P<0.01),三角形细胞数量无明显改变(P>0.05)。结果见表2、图1和图2。
表2 各组大鼠TRN c-jun阳性细胞形态(±s,n=6)Tab 2Morphology of c-jun positive cells in TRN for each group of rats(±s,n=6)
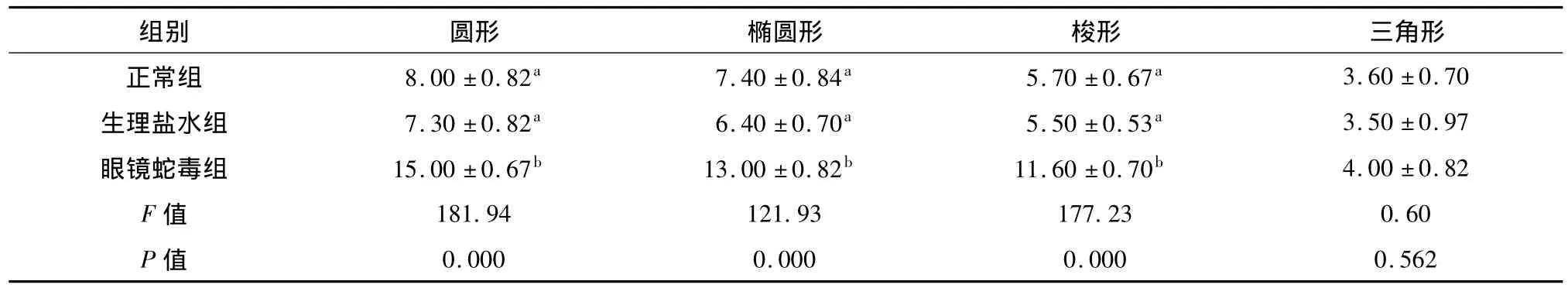
表2 各组大鼠TRN c-jun阳性细胞形态(±s,n=6)Tab 2Morphology of c-jun positive cells in TRN for each group of rats(±s,n=6)
注:两两比较采用q检验,两组间字母不同P<0.05,字母相同P>0.05
0.000 0.000 0.000 0.562 3.60 ±0.70生理盐水组 7.30 ±0.82a 6.40 ±0.70a 5.50 ±0.53a 3.50 ±0.97眼镜蛇毒组 15.00 ±0.67b 13.00 ±0.82b 11.60 ±0.70b 4.00 ±0.82 F 值 181.94 121.93 177.23 0.60 P值组别 圆形 椭圆形 梭形 三角形正常组 8.00 ±0.82a 7.40 ±0.84a 5.70 ±0.67a
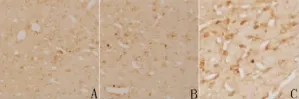
图1 大鼠TRN c-jun阳性细胞(免疫组织化学染色法,×200)A:正常组;B:生理盐水组;C:眼镜蛇毒组Fig 1 C-jun positive cells in TRN of rats(Immunohistochemistry technique,×200)A:control group;B:saline group;C:N.atra venom group

图2 大鼠TRN c-jun阳性细胞(免疫组织化学染色法,×400)A:正常组;B:生理盐水组;C:眼镜蛇毒组Fig 2 C-jun positive cells in TRN of rats(Immunohistochemistry technique,×400)A:control group;B:saline group;C:N.atra venom group
3 讨论
眼镜蛇毒中含有神经毒素和细胞毒素,可导致细胞溶解、神经细胞信息传导阻滞,从而影响神经细胞的正常功能。即刻早基因普遍存在于中枢神经细胞中,在生理情况下少表达;在病理情况下,如疼痛、脑缺血、癫痫、电刺激等伤害性刺激情况下可致cjun在脑相关区域中呈一过性、广泛、快速的表达[5]。c-jun参与c-fos对靶基因的调控过程,在神经细胞信息传导中起着重要作用。当神经细胞受到外界刺激后,兴奋性氨基酸或NMDA受体等第一信使被激活,导致CaM、Ca2+、IP3、cAMP等第二信使进入细胞核,进而快速诱导c-jun和c-fos转录,使其细胞浆中的mRNA数量快速增加,翻译出的Fos和Jun蛋白进入胞核内并形成异源二聚体Fos-Jun复合物,与基因中的AP-1调节位点紧密结合,从而进一步激活靶基因,使神经元的结构与功能在较长时间内出现改变[6-7]。当神经细胞受到伤害性刺激时,可导致cjun基因的表达改变。有研究表明在周围或中枢神经系统受到损伤后,神经细胞出现再生反应,并伴随c-jun基因表达增强,提示c-jun在抑制神经细胞凋亡、促进受损细胞修复以及改善神经细胞的存活方面发挥着极为重要的作用[8-9]。因此,本实验观察到眼镜蛇毒组TRN c-jun阳性细胞的增多,推测cjun可能有助于减少蛇毒对神经细胞造成的损伤,保护和修复部分受损的神经细胞,完善神经细胞的结构和功能。本实验同时在高倍视野下观察到TRN主要以圆形、椭圆形和梭形c-jun阳性细胞者居多,眼镜蛇毒组上述三种形态的c-jun阳性细胞数明显增加,提示眼镜蛇毒主要对大鼠TRN圆形、椭圆形和梭形的c-jun阳性细胞表达有影响,其机理尚待进一步研究。
TRN是位于内囊和外髓板两者之间的一薄层神经细胞,它接受来自板内核群和大脑皮质投射来的纤维,并发出纤维至丘脑各核团,继而再投射至大脑皮质,形成丘脑-皮质环路。有报道表明c-fos、c-jun基因在中枢神经系统内与痛觉传导密切相关[10]。本室曾报道眼镜蛇毒可使延髓中神经元型一氧化氮合酶阳性神经元表达增强[11]。注射眼镜蛇毒对大鼠是一种伤害性刺激,在伤害性刺激条件下,一氧化氮(NO)可诱导c-fos基因的快速表达[12],而c-jun和c-fos的表达是偶联的,c-fos基因产物Fos蛋白必须与c-jun转录mRNA编码的Jun蛋白结合,才能发挥其生物学作用[13]。本实验观察到在注射眼镜蛇毒后大鼠TRN c-jun阳性细胞数明显增多,提示可能通过NO作为第二信使,介导c-fos、c-jun基因的表达,从而在伤害性信息的传导过程中发挥重要作用,而TRN是否作为伤害性信息传向大脑皮质通路中的中继性核团,还有待深入研究。
[1]PINAULT D.The thalamic reticular nucleus:structure,function and concept[J].Brain Res Rev,2004,46(1):1 -31.
[2]黄劲柏,卓廉佳,刘龙浩,等.急救穴刺血对实验性脑缺血大鼠大脑皮层、海马区c-fos mRNA表达的影响[J].中国中医急症,2012,21(4):582 -584.
[3]王丽发,徐臣利,熊克仁.眼镜蛇毒对大鼠丘脑网状核c-fos表达的影响[J].蛇志,2010,22(1):9 -11.
[4]LAURA A,FRACZEK,CAROL B,et al.c-Jun and c-Fos regulate the complement factor H promoter in murine astrocytes[J].Molecular Immunology,2011,49:201 -210.
[5]HIROYUKI ICHIKAWA,MITSUHIRO KANO,YOSHINAKA SHI MIZU,et al.Increase of c-Fos and c-Jun Expression in Spinal and Cranial Motoneurons of the Degenerating Muscle Mouse(Scn8admu)[J].Cellular and Molecular Neurobiology,2010,30:737-742.
[6]MIYAMOTO E.Molecular mechanism of neuronal plasticity:induction and maintenance of long-term potentiation in the hippocampus[J].Pharmacol Sci,2006,100:433 - 442.
[7]KUBIK S,MIYASHITA T,GUZOWSKI JF.Using immediate-early genes to map hippocampal subregional functions[J].Learning and Memory,2007,14:758 -770.
[8]ZHOU LH,HAN S,XIE YY,et al.Differences in c-jun and nNOS expression levels in motoneurons following different kinds of axonal injury in adult rats[J].Brain Cell Biology,2008,36:213 -227.
[9]M.O.SAMOILOV,E.A.RYBNIKOVA,N.A.SITNIK,et al.Preconditioning modifies the activities of mitogen-activated protein kinases and c-Jun transcription factor in rat hippocampus after severe hypobaric hypoxia[J].Neurochemical Journal,2007,1:219 -226.
[10]刘斌,符艳松,王彩霞.头痛宁胶囊对偏头痛模型大鼠中脑和下丘脑c-fos,c-jun基因表达的影响[J].中国实验方剂学杂志,2011,17(11):195 -198.
[11]倪进忠,龚鑫,熊克仁.眼镜蛇毒对大鼠延髓nNOS表达的影响[J].蛇志,2008,20(3):169 -176.
[12]赵永烈,王玉来,高颖.芍芷地龙汤对偏头痛模型中脑导水管周围灰质c-fos和NOS蛋白共存表达的影响[J].环球中医药,2009,2(4):269 -272.
[13]王宝见,钟华,张国英,等.脑痛立停胶囊对偏头痛模型大鼠脑干及下丘脑c-fos、c-jun基因表达的影响[J].新中医,2009,41(2):104-106.

