高效硝化细菌的筛选及特性研究
王小菊 何春平 王 震 邢传宏 宋安东 陈红歌 * (.河南农业大学生命科学学院河南 郑州 45000;.郑州大学水环学院河南 郑州 45000)
硝化细菌是一类广泛存在于自然界,在生物脱氮过程中起到重要作用的微生物[1-2],通过硝化作用把氨氮转化为亚硝酸盐,再进一步把亚硝酸盐转化为硝酸盐.其硝化速率直接影响污水处理系统的硝化效果和脱氮效率.有研究表明,污水中硝化细菌的浓度与硝化速率成正比[3],因此,要用于处理污水,必须筛选出生长速率高、硝化作用强的硝化细菌.大多数硝化细菌生长缓慢,最适温度在25~30℃[4-5],高于亚硝化细菌的最适温度(20~25℃),因而由亚硝酸盐转化到硝酸盐的时间就较长,特别是在冬季气温低时,硝化反应成为整个反应的限速步骤.因此,筛选并驯化得到性能优良的硝化细菌种群并进一步提高它们在污水处理系统中的数量是提高生物脱氮效率的重要途径[6-8].
本试验拟从莲花味精厂SBR污水处理反应池中筛选出高效硝化细菌,并对其进行低温驯化,以获得耐低温的硝化细菌菌株,进一步研究其硝化特性以及在活性污泥絮体中的地位,从而为有效利用该菌株提高低温下SBR废水处理效率奠定基础.
1 材料与方法
1.1 含菌样品
采自河南莲花味精集团有限公司污水处理厂序批式反应池(SBR)中污水.
1.2 培养基
液 体 培 养 基 :NaNO21.0g,MgSO4·7H2O0.5g,Na2CO31.0 g,FeSO4·7H2O0.4g,加蒸馏水定容至lL.该培养液在灭菌前用 NaOH调pH值为 7.5~8.0,再加 0.5g K2HPO4(磷酸盐单独灭菌,并且在培养液冷却至室温后加入).
平板分离培养基: 成分同液体培养基,另加入1.0%的琼脂糖.
1.3 硝化细菌的筛选及硝化速率的测定
1.3.1 菌种筛选 取5mL从曝气池中取回的污水接种至含 100mL硝化细菌液体培养基的250mL三角瓶中,30℃、170r/min振荡富集培养10d,每隔2d在白瓷板上分别滴加2~3滴二苯胺试剂[9],检查培养物中NO2-的减少和NO3
-的形成.选取颜色变化深的培养液按稀释分离的方法将培养液稀释至 10-3、10-4、10-5三个稀释度,分别在硝化细菌固体培养基上涂布分离,30℃恒温培养箱中培养 10d左右,挑取典型单菌落分别移植于20mL液体培养基的100mL三角瓶中,30℃、170r/min振荡培养 10d,同样依前述方法检验硝化细菌富集培养液中培养物中 NO2-的减少和的形成.分离培养试验重复两次,将最后获得的纯培养物移斜面固体培养基上保藏.
1.3.2 硝化菌液的制备 将上述单菌株分别接种到含20mL液体培养基的100mL三角瓶中进行摇床培养,每个菌株接一个摇瓶,设不接菌的装有同样液体培养基的三角瓶作为 NO2-测定的对照.28℃、170r/min振荡培养15d后,将培养液于5000r/min离心15min,取上清液进行硝化速率测定.
1.3.3 硝化速率的测定 硝化速率以单位时间、单位体积培养液转化NO2-的量(即的减少量)表示,硝化速率的单位为mg/(L·d).采用比色法[10]和离子色谱法[11-12]测定NO2-的量.
比色法:光密度-亚硝酸盐浓度标准曲线为y=0.6612x-0.0013(R2=0.9997),根据标准曲线计算硝化菌液中亚硝酸盐的浓度,硝化速率按下式计算:
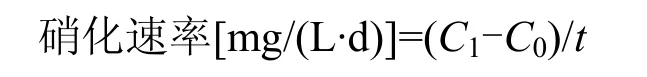
式中:C1为不接种样品中亚硝酸根浓度,mg/L;C0为接种样品中亚硝酸根浓度,mg/L;t为培养时间,d.
离子色谱法:采用 Dionex ICS3000型离子色谱仪,色谱分离柱为IonpacAS19阴离子交换柱,配 AG19保护柱,用 Dionex电导检测器 ,配Dionex ASRS300 4mm 抑制器.
将待测样品适当稀释后用0.22μm滤膜过滤,然后将滤液放进色谱进样器中,进样体积为25μL,流速为 1.0mL/min,流动相用 20nmol/LNaOH溶液,线性范围在 0~2.0μg/mL,检出限为 0.4μg/mL.
1.4 硝化细菌的鉴定
菌株的形态鉴定参照文献[13]进行.参照《微生物实验技术》[14]对分离出的菌株进行革兰氏染色试验和相应的生理生化试验,包括乙酰甲基甲醇试验,甲基红试验,吲哚试验,柠檬酸盐利用试验,16S rDNA菌种鉴定试验.
1.5 硝化细菌的耐低温驯化
用接种环挑取筛选到的硝化速率最高的单菌株接入 20mL硝化细菌液体培养基,15℃下静置培养,每隔 3d用比色法检测培养液中的含量并计算硝化速率.当培养液中的NO2-全部转化为NO3-时,取驯化的菌液2mL转接入新鲜配制的20mL硝化细菌液体培养基,进行第2次驯化,同样检测亚硝酸盐的转化情况,当培养液中的NO2-全部转化为NO3-时,再进行第3次、第4次驯化,直至硝化细菌在15℃下转化稳定.将最后1次转接的菌种保存在平板或试管斜面.
1.6 硝化条件的优化
1.6.1 最适转化温度 为了保证接种培养物的均一,将2种温度下(30,15℃)保存的菌先在30℃下培养5d,然后取培养菌液2mL分别接入20mL新鲜的硝化细菌液体培养基,在不同的温度下(10,15,20,25,30,35℃)培养,5d后比色法检测NO2-→NO3-的转化情况,并计算硝化速率[mg/(L·d)].
1.6.2 在最适转化温度下不同 pH 值 将在15℃下驯化保存的菌的扩大培养液 2mL分别转接入20mL不同初始pH值(pH5,6,7,8,9)的新鲜液体培养基,分别在最适转化温度下培养 5d检测菌液 NO2-→NO3-的转化情况,并计算硝化速率.
1.6.3 在最适转化温度下添加不同浓度葡萄糖 将在 15℃下驯化保存的菌的扩大培养液2mL分别转接入2mL含不同初始浓度(0,1,2,3,4g/L)的葡萄糖(在原有培养基的基础上添加)的新鲜液体培养基,分别在最适转化温度下培养5d检测菌液的NO2-→NO3-的转化情况,并计算硝化速率.
1.6.4 在最适转化温度下添加不同初始浓度NaNO2将在 15℃下驯化保存的菌的扩大培养液 2mL分别转接入 20mL含不同初始浓度(0.5,1,2,3,4g/L)的 NaNO2的液体培养基,分别在最适转化温度下培养5d检测菌液的的转化情况,并计算硝化速率.
1.7 硝化细菌单菌在活性污泥絮体中的地位
分别提取污泥絮体和硝化细菌单菌株的总DNA,用作 16S rDNA V3区扩增的模板,各对其V3区进行扩增.上游引物:F341-GC(5’-CGCCCGCCGCGCGCGGCGGGCGGGGCGGGGGCAC GGGGGGCCTACGGGAGGCAGCAG-3’),其 中GC发夹是为满足变性梯度凝胶电泳(DGGE)的温度而加.下游引物:R-518(5’-ATTACCGCGGCTGCTGG-3’).反应条件:94℃预变性 3min;94℃变性30S,56℃退火30S,72℃延伸45S,28个循环;最后 94℃变性 30S,56℃退火 30S,72℃延伸7min,4℃保存.扩增结束后,各取5μL扩增产物在1%的琼脂糖凝胶上进行电泳检测.电泳条件:电压120V,电泳45min.最后对16S rDNA的V3区扩增产物做DGGE分析.
2 结果与分析
2.1 高效硝化细菌的筛选
取SBR反应池中污水接种至硝化细菌液体培养基中,振荡富集培养,经二苯胺初筛后,取颜色变化深的培养液做平板分离,挑取生长快、菌落大的10株单菌接入液体培养基中,进行硝化速率的测定,结果如表1所示.可以看出,大多数经富集再分离所得的菌株都显示了硝化活力.将硝化速率最高的N4菌株的硝化液进行离子色谱法验证,结果如图 1.可知 N4菌株几乎将培养液里的全部氧化为 NO3-,说明 N4具有很强的硝化能力.从表1和图1可以看出,用比色法和离子色谱2种方法检测表现出一致的结果.对N4连续进行3次摇瓶硝化试验,证实其有稳定的硝化速率,硝化速率为(52.0±3.5)mg/(L·d).
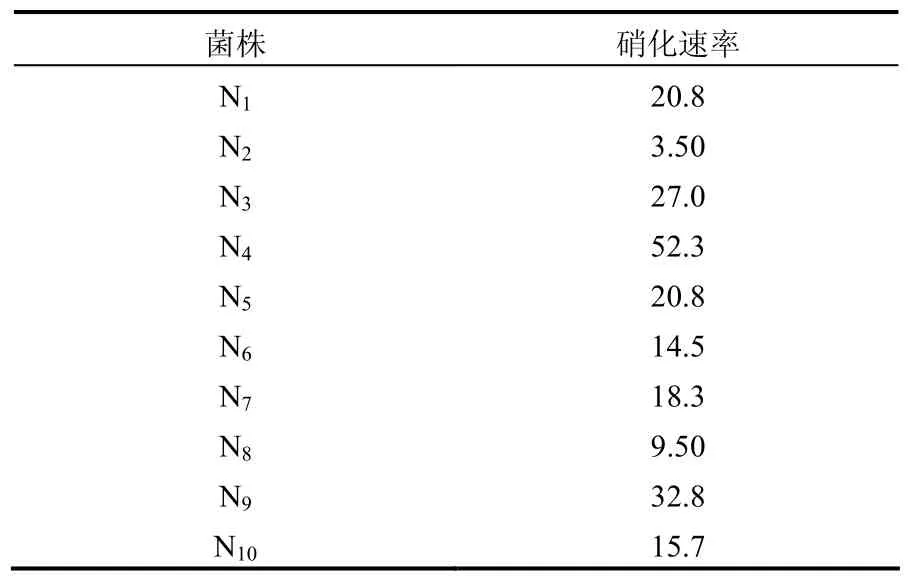
表1 不同菌株的硝化速率[mg/(L·d)]Table 1 Nitrification rate of different strains[mg/(L·d)]
2.2 N4菌株的鉴定
N4菌落特征:菌落中央为圆形,菌落乳白色,不透明,边缘整齐.
N4菌株有关生理生化鉴定试验结果见表2.
提取N4菌株的总DNA进行16S rDNA扩增(图2).测序显示,该序列长度为1449bp,相似性比对表明该菌株16S rDNA序列同已发表的索氏菌属(Thauera)和固氮弧菌属(Azoarcus)的 16S rDNA同源性最高,但均低于97%而大于96%.提取索氏菌属和固氮弧菌属的模式种[15],与 N4菌株进行系统发育分析,如图3所示.可知N4同固氮弧菌属的模式种聚在一起,初步认为N4菌株属于固氮弧菌属(Azoarcus).
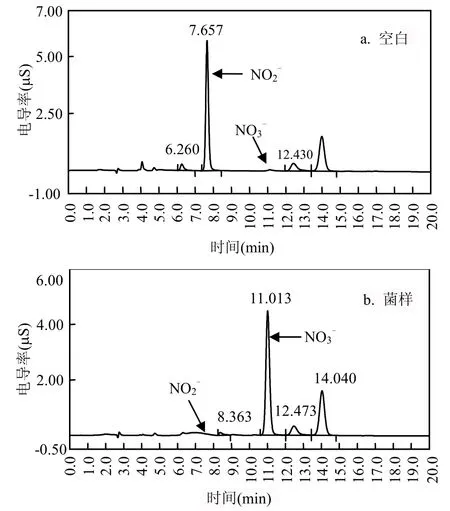
图1 离子色谱测定结果Fig.1 Analysis of NO2- and NO3- by ion chromatography

表2 N4菌株生理生化鉴定试验Table 2 Physiological and biochemical tests of N4
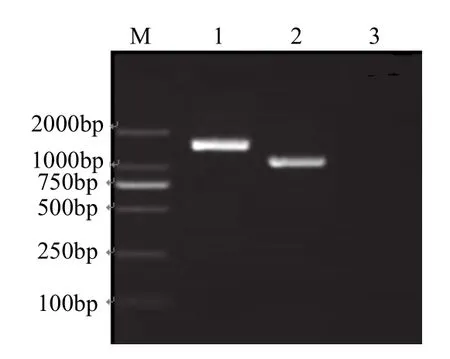
图2 16S rDNA的PCR扩增Fig.2 PCR amplification of 16S rDNA
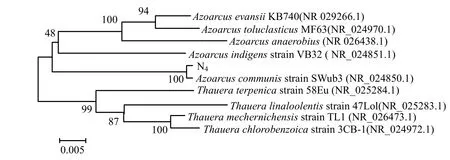
图3 依据16S rDNA序列构建的菌株N4和相关菌种系统发育树Fig.3 The phylogenetic tree of N4 and related bacterial species constructed according to 16S rDNA sequence
2.3 N4的耐低温驯化
将N4单菌落接入液体培养基中,15℃下进行第1次驯化.每隔3d用比色法检测培养液中NO2-的含量并计算硝化速率,培养至第 15d时培养液中的 NO2-全部转化为NO3-,取驯化的菌液2mL转接入同样的新鲜液体培养基,进行第2次驯化.同样方法检测至第8d时培养液中的NO2-全部转化为NO3-.第3次驯化至7d时培养液中的NO2-全部转化为NO3-.第4次驯化至8d时培养液中的NO2-全部转化为NO3-.4次驯化所得的硝化速率结果如表3所示.可以看出N4在15℃下经过4次驯化后,硝化速率非常稳定.将第4次驯化的菌液做斜面保存,保存的菌种命名为N4-L.
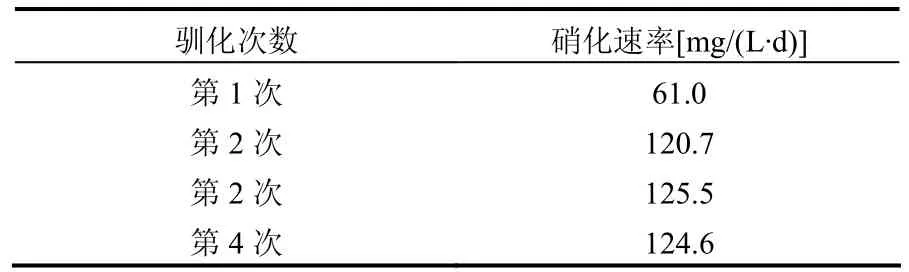
表3 N4的低温驯化Table 3 Low temperature acclimation of N4
2.4 N4-L的硝化特性
2.4.1 N4-L最适硝化温度 将低温驯化得到的菌株N4-L及出发菌株N4的种子培养物分别接入硝化细菌液体培养基中,在不同温度下培养,结果如图4所示.N4-L和N4在15℃以上温度培养时都保持相对较高的硝化速率,在15,20,25℃下N4-L表现出略高于N4的硝化速率,但N4-L的最适转化温度同N4一样,都在20~30℃之间.为研究N4-L在低温下的硝化特性,以下试验均在15℃下进行.
综上所述,软交换与IMS技术之间存在一定的联系,加强对软交换和IMS技术研究和应用能够为下一代交换组网建设提供相应的支持。因此电信运营工作中要加强对软交换和IMS技术的重视,并进行系统的探究,争取逐步形成全新的认识,有效促进下一代交换组网的建设和发展。
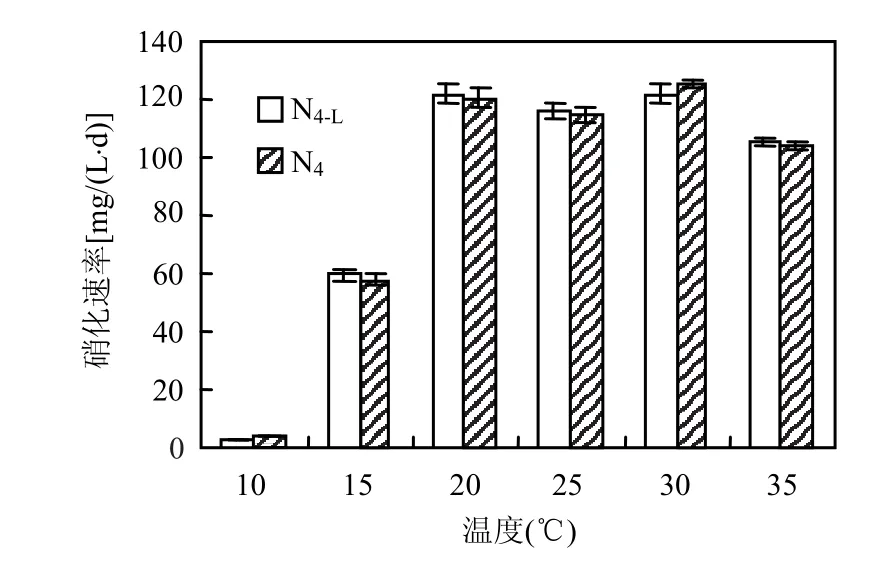
图4 温度对硝化速率的影响Fig.4 The effect of temperature on the nitrification rate
2.4.2 pH值对硝化速率的影响 将N4-L的种子培养物分别接入不同初始pH值的液体培养基中,在 15℃下培养,结果如图 5所示.初始 pH值在6.0~8.5范围内N4-L在 2种温度下均具有较高的硝化速率,且当pH值为8.0时硝化速率最高.
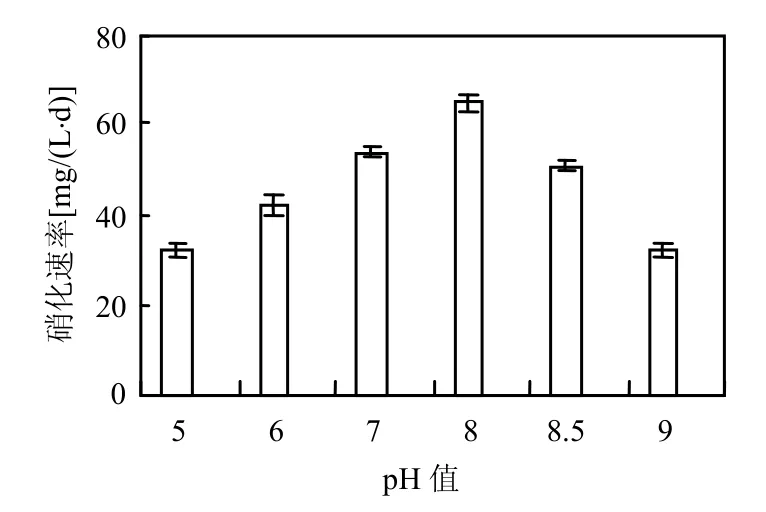
图5 pH值对硝化速率的影响Fig.5 The effect of pH on the nitrification rate
2.4.3 葡萄糖浓度对硝化速率的影响 将 N4-L的种子培养物分别接入不同初始葡萄糖浓度的液体培养基中,在 15℃下培养,结果如图 6所示.葡萄糖浓度在2g/L时, N4-L的硝化速率达到最高,当葡萄糖浓度继续增加硝化速率反而降低.说明有机质的存在不影响该菌的硝化能力,此时细菌以混合营养型生长,即同时利用有机质和亚硝酸盐的氧化获得能量而生长,但当有机质量过高时会影响到无机底物的氧化.
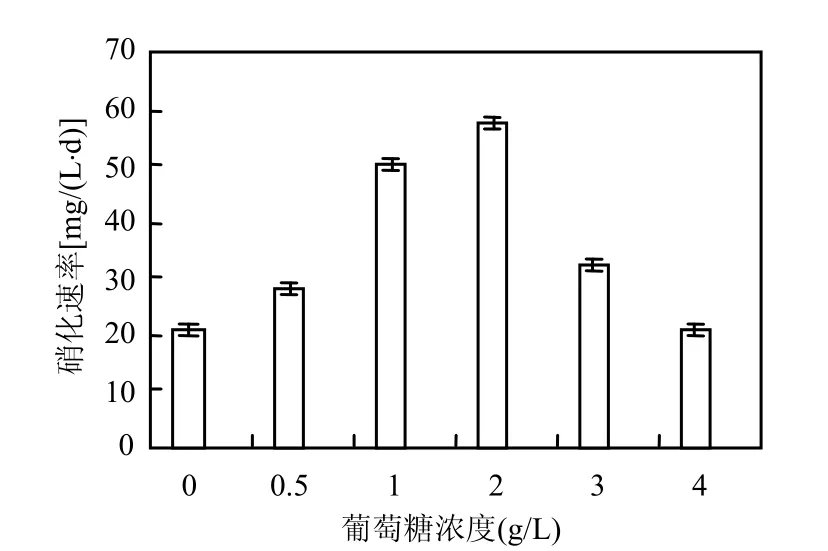
图6 葡萄糖浓度对硝化速率的影响Fig.6 The effect of glucose concentration on the nitrification rate
2.4.4 NaNO2浓度对硝化速率的影响 取 N4-L的种子培养物分别接入不同初始NaNO2浓度的液体培养基中,15℃培养,结果如图7所示.NaNO2浓度在1g/L时,N4-L的硝化速率最高,随着NaNO2浓度的增加,硝化速率相应降低.
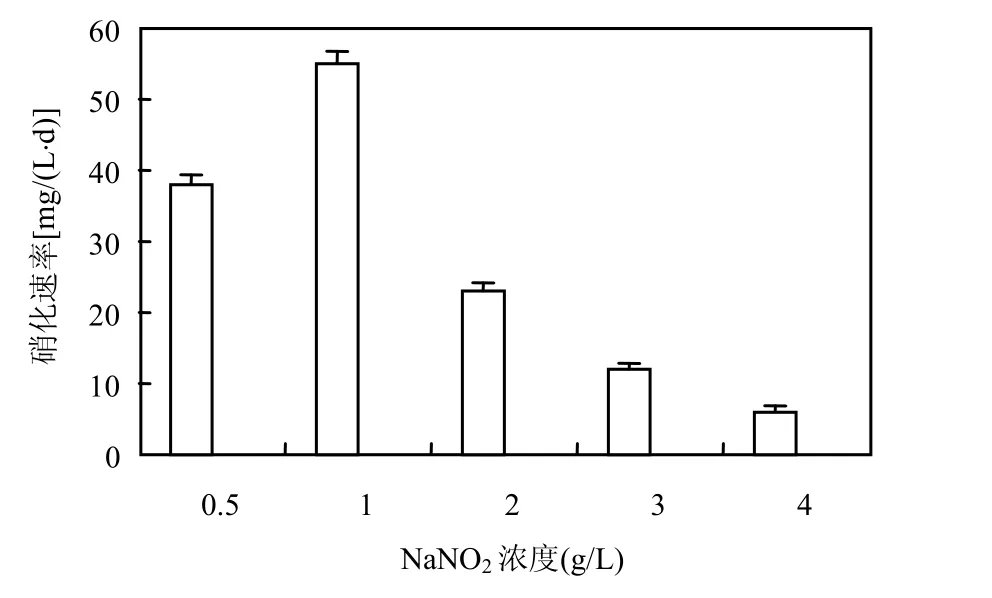
图7 亚硝酸钠浓度对硝化速率的影响Fig.7 The effect of sodium nitrite concentration on the nitrification rate
2.5 N4-L在活性污泥絮体中的地位
分别提取N4-L菌株和冬季SBR活性污泥絮体的总DNA(图8),以16S rDNA的V3区引物进行PCR扩增,得到约230bp的DNA片段(图9),对其进行DGGE分析,结果如图10所示.可以看出,N4-L的特征性条带在活性污泥絮体DGGE中的对应条带很弱,不是主条带,可以说明筛选出的低温N4-L菌株在莲花味精厂废水SBR污泥絮体中不占优势地位.
图8 总DNA的提取Fig.8 The extraction of total DNA
图9 16S rDNA的V3区扩增Fig.9 The amplification of V3 region of 16S rDNA
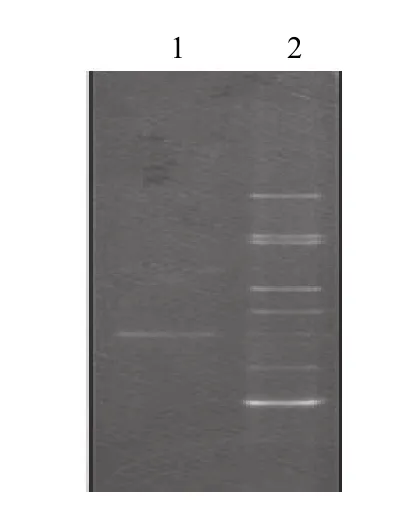
图10 16S rDNA V3区的DGGE检测Fig.10 The DGGE detection of V3 region of 16S rDNA
3 讨论
通过对N4菌株的16S rDNA序列分析,结合其形态及生理生化特征,表明该菌为固氮弧菌属,又因其与固氮弧菌属已知菌株同源性低于 97%,表明该菌株极有可能是固氮弧菌属中的一个潜在新种,具有兼性自养的硝化细菌的特征,能够在无机营养和混合营养条件下进行亚硝酸盐的氧化.此特征与Zare等[16]报道的一株新的硝化细菌Nitrobacteria hamadaniensis相类似,该菌株在混合营养下的生长和硝化高于无机营养下的情况.
对N4菌株进行低温驯化后其硝化能力明显提高,硝化速率最高达到120.7mg/(L·d)以上,高于目前已报道的硝化细菌的硝化能力[35.89~70mg/(L·d)][17-19],具有较好的实际应用价值.
4 结论
4.1 从SBR反应池中筛选得到一株硝化速率最高的菌株N4,对其进行耐低温驯化得到N4-L,硝化速率最高达到120.7mg/(L·d)以上.
4.2 N4-L菌株为兼性自养硝化细菌,对有机质具有较好的耐受性,在 pH 为 8.0、葡萄糖浓度为2g/L、NaNO2浓度为1g/L时该菌株具有最强的硝化能力.
4.3 N4-L不是污泥絮体中的优势菌,采取措施使N4-L菌株成为絮体优势菌可能是提高SBR脱氮运行效率的有效途径.
[1]徐 建,张德纯,周 广.微生物在城市污水处理系统中的应用与展望 [J]. 中国微生态学杂志, 2006,18(1):75-77.
[2]有马启,田村学造.生物净化环境技术 [M]. 郭丽华,等译.北京:化学工业出版社, 1990:180-181.
[3]Lin Y, Kong H N, He Y L, et a1. Simultaneous nitrification and denitrification in a membrane bioreactor and isolation of heterotrophic nitrifying bacteria [J]. Japanese Journal of Water Treatment Biology, 2004,40(3):105-114.
[4]王歆鹏,陈 坚,华兆哲,等.硝化菌群在不同条件下的增殖速率和硝化活性 [J]. 应用与环境生物学报, 1999,5:64-68.
[5]崔袁园.低温硝化细菌的筛选及应用研究 [D]. 哈尔滨:哈尔滨工业大学, 2006.
[6]章非娟.生物脱氮技术 [M]. 北京:中国环境科学出版社, 1992:55-67.
[7]金志刚,屈计宁,何群彪.硝化细菌富集技术分析及方法研究 [J].上海环境科学, 1998,17(8):16-19.
[8]Shan H, Obbaed J P. Ammonia removal from freshwater using nitrifying bacteria enriched from a seawater aquaculture pond [J].Biotechonlogy, 2003,25(17):1469-1471.
[9]胡朝松,李春强.海洋沉积物中反硝化细菌的分离鉴定及反硝化性能研究 [J]. 环境科学研究, 2009,22(1):114-118.
[10]国家环境保护总局水和废水监测分析方法 [M]. 4版.北京:中国环境科学出版社, 2002:230-351.
[11]王 莉.离子色谱的原理及应用 [J]. 天津科技, 2006,(3):48-49.
[12]刘耀华,倪刘健.离子色谱法测定绿茶与乌龙茶中的F-,Cl-,NO3-,[J]. 环境科技, 2009,22(1):32-33.
[13]东秀珠,蔡妙英.常见细菌系统鉴定手册 [M]. 北京:科学出版社, 2001.
[14]姚占芳,吴云汉.微生物学实验技术 [M]. 北京:气象出版社.1989.
[15]Song B, Palleroni N J, Kerkhof L J, et a1. Characterization of halobenzoate-degrading, denitrifying Azoarcus and Thauera isolates and description of Thauera chlorobenzoica sp. Nov [J].International Journal of Systematic and Evolutionary Microbiology, 2001,51:589–602.
[16]Zare M, Heidari M H, Pouresmaeili F, et al. Introducing a novel facultative nitrifying bacterium, "Nitrobacteria hamadaniensis".African Journal of Microbiology research, 2012,6(24):5126-5133.
[17]Magalhaes C M, Joye S B, Moreira R M, et a1. Effect of salinity and inorganic nitrogen concentrations on nitrification and denitrification rates in intertidal sediments and rocky biofilms of the Douro River estuary [J]. Portugal Water Research, 2005,39(9):1783-1794.
[18]余敦耀,邱雁临,朱 影.高效硝化细菌的分离与鉴定 [J]. 化学与生物工程, 2008,25(4):60-63.
[19]Loh K, Chung T, Ang W. Immobilized-cell membrane bioreactor for high-strength phenol wastewater [J]. Journal of Environmental Engineering, 2000,126(1):75-79.
致谢:本实验的现场采样工作由河南莲花味精集团有限公司污水处理厂的工作人员协助完成,在此表示感谢.

