川芎嗪与氨基胍联合治疗对新生链脲佐菌素糖尿病大鼠肝功能的影响*
宋春红, 李 莉, 张永欢, 王蔚琛, 窦橙云, 李瑞峰△
(1石家庄市第四医院病理科,河北石家庄050011;2山东大学医学院病理生理学研究所,山东济南250012;3青岛市城阳区人民医院病理科,山东青岛266100;4滨州医学院病理生理学教研室,山东烟台264003;5山东大学齐鲁医院肝病科,山东 济南250012)
肝脏是人体最大的能量代谢器官及胰岛素敏感组织。糖尿病是复杂的系统性疾病,以代谢紊乱为显著特征,可以引起肝脏组织学、分子生物学及功能改变。川芎嗪(tetramethylpyrazine,TMP)是中药川芎中的一种生物碱,具有降血糖、活血化瘀、扩张血管、抗凋亡、抗氧化、抗动脉粥样硬化等多种作用[1-2]。氨基胍(aminoguanidine,AG)为一种亲核类的肼类化合物,通过抑制晚期糖基化终末产物(advanced glycosylation end products,AGEs)的形成和诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)的活性而被公认为干预糖尿病有效的药物。本课题组前期研究显示,联合应用川芎嗪及氨基胍,无论在降低新生链脲佐菌素糖尿病大鼠(neonatal-0 streptozocininduced rats,n0-STZ大鼠)空腹血糖(fasting plasma glucose,FPG)、空腹胰岛素(fasting insulin,FINS)和胰岛素抵抗指数(insulin resistance index,IRI)方面,还是在降低血浆NO、糖化血红蛋白水平及外周血白细胞iNOS表达方面,均比单用川芎嗪或氨基胍治疗效果显著[3];且联合治疗可以通过抑制硝化应激而改善n0-STZ大鼠肾脏功能[4]。本研究拟进一步观察川芎嗪与氨基胍联合应用对n0-STZ大鼠肝脏损害的保护效果与机制。
材料和方法
1 材料
1.1 动物 出生当日的Wistar大鼠100只,体重约6 g,山东大学实验动物中心提供。动物先由母乳喂养,于4周龄后雌雄分笼喂养,自由摄水摄食。室内温度控制在(22±3)℃,维持12/12 h的白天/黑夜交替。
1.2 试剂 链脲佐菌素(streptozocin,STZ)购自Sigma;氨基胍盐酸盐购自上海达瑞精细化学品有限公司;盐酸川芎嗪购自天津药业集团新郑股份有限公司;盐酸二甲双胍(metformin,MET)购自北京京丰制药有限公司;兔抗大鼠caspase-3、Fas及 Bcl-2Ⅰ抗购自武汉博士德公司;兔抗大鼠iNOSⅠ抗由北京博奥森生物技术有限公司提供;小鼠抗大鼠β-actin抗体、辣根酶标记山羊抗兔IgGⅡ抗及山羊抗小鼠IgGⅡ抗购自北京中杉金桥生物技术有限公司;NO和iNOS测定试剂盒购自南京建成生物工程研究所;BCA蛋白测定试剂盒购自碧云天生物技术有限公司;ECL化学发光增强显色试剂盒购自Millipore。
2 方法
2.1 n0-STZ大鼠模型制备及分组 出生当日的Wistar大鼠100只,随机选取80只左下腹消毒,腹腔注射STZ 90 mg/kg,STZ临用前溶于0.1 mol/L柠檬酸缓冲液,经微孔滤膜过滤除菌。其余20只作为正常对照(normal control,NC)组,腹腔注射生理盐水。正常饲养至8周龄,空腹血糖≥7.0 mmol/L者选入本研究。将胰岛素抵抗大鼠随机分为模型(nodel,MD)组、MET治疗组和TMP+AG联合治疗组,每组20只。MET组每天经饮水摄入二甲双胍125 mg/kg;TMP+AG组每天经饮水摄入盐酸川芎嗪50 mg/kg与氨基胍盐酸盐25 mg/kg。喂养24周,观察大鼠一般情况。
2.2 血液生化检查 32周龄,全部大鼠摘取眼球采血处死,留取血清、血浆。检测FPG和FINS,IRI根据公式IRI=(FPG×FINS)/22.5计算。酶学法检测血清丙氨酸氨基转移酶(alanine aminotransferase,ALT)和天冬氨酸氨基转移酶(aspartateamino transferase,AST)水平。
2.3 iNOS活性和NO浓度检测 10%肝组织匀浆,依次加入试剂充分混匀,490 nm(NO)或530 nm(iNOS)波长测各管吸光度值。
2.4 HE染色 取肝脏组织,4%多聚甲醛固定24 h,石蜡包埋,制作5μm石蜡切片,进行HE染色,在显微镜下观察组织的病理形态学变化。
2.5 Western blotting检测肝脏组织中 iNOS、Fas、Bcl-2和caspase-3蛋白的表达 取组织50 mg,加入细胞裂解液,经机械和超声匀浆,4℃低温12 000 r/min(离心半径10 cm)离心10 min,二喹啉甲酸(bicinchoninic acid,BCA)法测总蛋白质浓度,将各组浓度调到同一水平,制备10%十二烷基硫酸钠-聚丙烯酰胺凝胶,电泳分离蛋白,将蛋白质转到硝酸纤维素滤膜上,5%脱脂奶粉TBST缓冲液室温封闭1 h,TBST洗膜3次,加入Ⅰ抗4℃过夜,TBST洗膜3次后加入辣根过氧化物酶标记的Ⅱ抗37℃孵育1 h,TBST洗膜3次。通过ECL化学发光增强显色试剂盒进行显色,MF-ChemiBIS仪器成像系统成像,蛋白峰面积灰度分析,以β-actin为内参照进行蛋白半定量分析。
3 统计学处理
用SPSS 17.0统计软件分析。数据用均数±标准差(mean±SD)表示,多组间比较采用单因素方差分析(ANOVA),组间两两比较采用最小显著性差异法(LSD法)。采用Kaplan-Meier法估计生存率,生存率假设检验采用log-rank检验。以P<0.05为差异有统计学意义。
结 果
1 n0-STZ大鼠成模情况
8周龄时,80只大鼠中有 66只 FPG≥7.0 mmol/L,成模率为82.5%,死亡率为0。该组大鼠尿量增多,体重增加,皮毛色黄、缺少光泽,活动量少。
2 各组大鼠生存率比较
32周龄时,NC组存活20只,存活率100%;MD组存活7只,存活率35%;MET组存活14只,存活率70%;TMP+AG组存活17只,存活率85%。MD组和MET组生存率明显低于NC组(P<0.05),MET组和TMP+AG组生存率明显高于MD组(P<0.05),MET组和TMP+AG组组间生存率无显著差异。
3 各组大鼠FPG、FINS和IRI检测结果
32周龄时MD组的FPG明显高于NC组(P<0.05),MET组和TMP+AG组较MD组显著下降(P<0.05),两干预组及NC组之间无显著差异;MD组FINS高于NC组(P<0.05),TMP+AG组低于MD组(P<0.05),也低于 MET组(P<0.05),但高于NC组(P<0.05),MET组与MD组之间无显著差异;对于IRI,MD组明显高于NC组(P<0.05),MET组和TMP+AG组低于MD组(P<0.05),TMP+AG组低于MET组(P<0.05),见表1。

表1 各组大鼠空腹血糖、空腹胰岛素和胰岛素抵抗指数的观察Table 1.The levels of FPG,FINSand IRI in the rats(Mean±SD)
4 各组大鼠肝功能检测结果
32周龄时,MD组的血清ALT和AST水平较NC组明显增加(P<0.01),与MET组相比,联合治疗在降低ALT(P<0.01)和AST(P<0.01)水平方面作用较强,见表2。

表2 各组大鼠血清ALT与AST水平的变化Table 2.The serum levels of ALT and AST in the rats(U/L.Mean±SD)

表3 各组大鼠肝的NO浓度及iNOS活性Table 3.NO concentrations and iNOSactivities of the rat livers(Mean±SD)
5 HE染色结果
NC组肝小叶结构完整,轮廓清晰,肝小叶肝细胞分界清晰,胞核圆,位于细胞中央,偶见双核,胞质丰富。MD组肝索排列紊乱,肝细胞出现脂肪变性,汇管区炎细胞浸润,肝细胞出现多灶小灶性坏死,表现为核固缩或破碎,与周围细胞连接松散。二甲双胍及联合治疗可以改善糖尿病引起的肝脏病理变化,见图1。
6 各组大鼠肝脏NO浓度和iNOS活性变化
32周龄时,MD组肝脏的NO浓度和iNOS活性较NC组明显增加(P<0.01),与MET组相比,联合治疗在降低NO浓度(P<0.01)和iNOS活性(P<0.05)方面作用较强,见表3。

Figure 1.HE staining of the rat livers(×100).A:normal control group;B:model group;C:metformin treatment group;D:tetramethylpyrazine+aminoguanidine treatment group.图1 各组肝脏组织HE染色
7 各组肝组织Western blotting结果
iNOS在NC组肝脏组织中表达较少,在MD组中表达明显增多(P<0.01),二甲双胍和联合治疗均可降低iNOS的表达,且以TMP+AG组降低更为显著(P <0.01),见图2。
Bcl-2在MD组表达较NC组明显下降(P<0.01),MET组和TMP+AG组Bcl-2表达增加(P<0.01),干预组之间无显著差异,见图2。
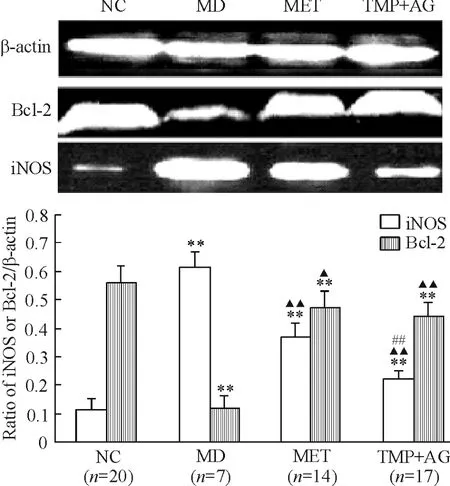
Figure 2.The expression of Bcl-2 and iNOSin the rat livers.βactin served as internal control.NC:normal control group;MD:model group;MET:metformin treatment group;TMP+AG:tetramethylpyrazine+aminoguanidine treatment group.Mean±SD.**P <0.01 vs normal control group;▲P<0.05,▲▲P<0.01 vs model group;##P<0.01 vs metformin treatment group.图2 各组肝组织Bcl-2和iNOS的表达结果
Caspase-3在NC组肝脏组织中表达较少,在MD组中表达明显增多(P<0.01),二甲双胍和联合治疗均可降低caspase-3的表达,且以TMP+AG组降低更为显著(P<0.01),见图3。
Fas在 MD组表达较 NC组明显升高(P<0.01),联合治疗可显著降低Fas表达(P<0.01),而二甲双胍治疗对Fas表达无明显作用,见图3。

Figure 3.The expression of activated caspase-3 and Fas in the rat livers.β-actin served as internal control.NC:normal control group;MD:model group;MET:metformin treatment group;TMP+AG:tetramethylpyrazine+aminoguanidine treatment group.Mean±SD. **P<0.01 vs normal control group;▲P< 0.05,▲▲P<0.01 vs model group;##P<0.01 vs metformin treatment group.图3 各组肝组织活化型caspase-3和Fas的表达结果
讨 论
本实验研究结果显示,n0-STZ糖尿病大鼠肝损伤的标志物ALT和AST升高,肝脏病理学发生改变。与此相对应,肝脏iNOS表达水平升高、活性增强且NO水平升高,凋亡相关蛋白Fas和caspase-3表达水平升高,抑制凋亡的蛋白Bcl-2表达下降。川芎嗪与氨基胍联合治疗可以降低血清ALT和AST水平,减轻糖尿病所致肝损伤,结合本实验结果及参考文献,主要机制可能涉及以下三方面:
(1)联合治疗可以降低血糖水平。高血糖通过促进活性氧簇和AGES生成,促进肝细胞损伤的发生。血糖升高的主要原因是胰岛素抵抗和/或胰岛β细胞功能受损。氨基胍通过特异性抑制iNOS活性、iNOS表达及AGEs形成而改善胰岛 β细胞功能[5-6]。川芎嗪本身具有降血糖作用[7],与氨基胍联合治疗可以发挥协同作用,通过增加胰岛β细胞免疫阳性染色的面积及细胞数量而发挥对胰岛β细胞的保护作用[8]。本实验研究结果亦表明,联合治疗可以降低胰岛素抵抗指数,从而增强外周组织的胰岛素敏感性而发挥降血糖作用。
(2)联合治疗可以特异性抑制肝脏iNOS活性,抑制iNOS蛋白表达,减少NO生成而发挥对肝细胞的保护作用。作为一种自由基,iNOS源性NO可以与活性氧类中间产物反应生成过氧亚硝酸盐阴离子等活性氮和(或)活性氧类物质。在机体抗氧化能力减弱的情况下,NO可直接或通过这些活性产物与蛋白、核酸等大分子起反应,调控细胞功能,造成组织、细胞损伤[9-10]。氨基胍属于精氨酸类似物,能选择性地抑制iNOS活性,另外,氨基胍可通过降低核因子-κB p65及iNOS表达,缓解硝酸盐应激而对糖尿病肝损伤发挥保护作用[11]。川芎嗪在小胶质细胞N9细胞中通过抑制p38丝裂原活化蛋白激酶、胞外信号调节激酶1/2、c-Jun氨基末端激酶及蛋白激酶B磷酸化,抑制核因子-κB从胞浆向胞核转位而抑制脂多糖诱导的iNOS表达和NO生成[12]。在肝细胞中是否以类似机制抑制iNOS表达和NO生成还有待深入研究。
(3)联合治疗可以增加肝脏抗凋亡蛋白的表达、降低促凋亡蛋白表达,从而缓解肝细胞凋亡发挥对肝组织的保护作用。介导细胞凋亡的途径主要有死亡受体通路、线粒体通路及内质网通路等。Caspase是诸多调控通路的关键,而caspase-3又处于caspase级联反应的中心地位,caspase-3的激活是细胞凋亡的早期事件和特异性分子标记之一。Fas蛋白属于肿瘤坏死因子受体家族成员,通过Fas配体-Fas-Fas死亡结构域相关蛋白-caspase-8-caspase-3效应分子的信号转导级联反应而发挥促细胞凋亡作用。线粒体通路主要由Bcl-2家族成员介导。Bcl-2可抑制线粒体膜通透性转变孔的开放,减少细胞色素C及凋亡因子的释放,促使氢离子从线粒体中泵出,并提高线粒体的钙缓冲能力而发挥抗细胞凋亡的功能。联合治疗可以通过降低 Fas、活化型caspase-3表达、促进Bcl-2表达而减少糖尿病所致肝细胞凋亡。
二甲双胍是临床上应用广泛的治疗糖尿病的药物。与二甲双胍相比,联合治疗在降低糖尿病大鼠FINS、增强胰岛素敏感指数、抑制iNOS活性、iNOS蛋白表达、降低Fas及活化型caspase-3表达等方面优于二甲双胍,为糖尿病发病机制的研究及寻找新的治疗方案提供了新的选择。

