高血压内皮微粒产生的机制和病理生理学作用*
胡帅帅, 仉红刚
(北京协和医学院,中国医学科学院微循环研究所,卫生部微循环重点实验室,北京100005)
高血压是以血压升高为主要临床表现伴或不伴有多种心血管危险因素的综合征,并且是目前多种心、脑、血管疾病的重要病因和独立的危险因素[1]。大量文献已证实内皮细胞功能障碍参与高血压发生发展的病理生理过程[2-3]。因此临床急需找到一种新型的生物标记物,这种标志物不但可以帮助理解高血压的发生发展机制而且具有对疾病诊断和预后的价值。近年来发现的内皮微粒(endothelial microparticles,EMPs),就是一种在促内皮细胞激活或凋亡状态下释放出的一种膜样结构微粒,这种微粒携带有大量的内皮细胞表面蛋白和生物信息,是非侵袭性监测内皮细胞功能状态的潜在标志,而且文献表明外周血中EMPs水平与许多严重心血管疾病诊断和预后有关[4-5]。本文就EMPs概念、特征、形成机制及其在高血压疾病中的潜在作用等方面的研究进展进行综述。
1 EMPs的发现与命名
几乎所有类型的细胞,在被激活或凋亡时,都可以产生一种直径为1μm左右微小膜结构的囊泡并释放到外周血液循环中,临床上称之为微粒,它包含了前体细胞特有的细胞膜、细胞质和细胞核结构成份。来源于内皮细胞的 EMPs是 Combes等[6]在1999年首先报道的,其大小通常在0.1~1μm,体外实验时使用肿瘤坏死因子α(tumor necrosis factorα,TNF-α)刺激人脐静脉内皮细胞时可以产生这种微粒,因其来源于内皮细胞,故命名为内皮微粒,即EMPs。之后陆续研究发现其它炎症因子(如白细胞介素1)以及细菌脂多糖、活性氧簇、凝血酶、C-反应蛋白、尿素等均可诱导内皮细胞产生EMPs[7-8],但迄今,EMPs产生的精确机制尚待进一步研究。
2 EMPs的特征
研究已证实EMPs携带有大量的内皮细胞蛋白质分子,如血管内皮钙黏蛋白、血小板内皮细胞黏附分子、细胞间黏附分子、内皮因子、E-选择素及整合素αV等,而且在不同的疾病状态下产生的EMPs会表达不同的特异性表面标记,这些特征可采用流式细胞分析技术检测出来,目前只有E-选择素和血管内皮钙黏蛋白被证明是内皮细胞独有的特异表型标记外,其它的标记均还可在其它细胞中检测到,如内皮因子可在单核细胞激活状态下表达,血小板细胞黏附分子可在血小板表达,细胞间黏附分子同样在白细胞有所表达。因此鉴定EMPs时需要通过结合多种标记物排除其它细胞来源的微粒。
细胞的活化和凋亡都能使膜磷脂的不对称分布消失,磷脂酰丝氨酸外化并暴露在细胞膜外面,这个过程同样体现在内皮细胞发生凋亡或活化产生EMPs时,故EMPs在疾病的发生发展中具有重要意义。EMPs各种抗原的表达与疾病的种类、疾病的过程及机体的状态密切相关。一般促凋亡诱导产生的EMPs倾向于表达 CD144、CD51/61、CD31、CD105 等表型,其价值在于疾病的诊断,而促激活诱导产生的EMPs更倾向于表达 CD54、CD62E、CD106等表型,其价值在于对疾病的预后评估。尽管EMPs占血浆中的各种细胞来源的微粒的比例最小(约5%~15%),但由于其可能成为内皮细胞功能状态的有效标记物而倍受广泛关注[9-11]。
3 EMPs形成机制
EMPs来源于被激活和凋亡后损伤的内皮细胞,可通过旁分泌或自分泌作用导致血管功能的紊乱。EMPs通过其表面受体或配体与其它细胞接触,或通过表达微囊泡内的蛋白质分子而引起靶细胞生物学行为和表观遗传学改变。EMPs的形成受到一定条件的诱导,其包含的内容物也依赖于诱导和刺激物质[4,12-13]。内皮细胞囊泡化和微粒释放机制虽然还不很清楚,但普遍认为内皮细胞在各种激活或凋亡因素的刺激下,通过钙蛋白酶的作用,可使得细胞内质网钙离子释放导致细胞内钙离子浓度突然上升改变了细胞膜的稳定性,并使得磷酯酰丝氨酸外翻,致胞膜的不对称性消失及细胞骨架蛋白重组,形成EMPs释放进入血循环[14]。
内皮细胞在激活和凋亡不同诱导下形成EMPs的机制不尽相同。目前研究证明TNF-α、凝血酶,C-反应蛋白等物质均可通过激活内皮细胞途径产生EMPs[6-8]。其机制为:激活内皮细胞使得细胞外大量钙离子进入细胞质,使得调控细胞膜磷脂类分布的翻转酶活性降低,导致细胞膜内分布的磷脂酰丝氨酸暴露于细胞膜外、膜的不对称性消失及骨架蛋白重组,最终引起 EMP的形成并释放[10],其中 TNF-α和凝血酶在激活途径中参与了不同的信号通路:TNF-α刺激产生的EMPs参与p38 MAPK途径,而凝血酶刺激产生EMPs参与 ROCK-TRAIL途径。从p38 MAPK这条途径探讨EMPs的产生机制,主要源于研究发现p38 MAPK在炎症反应中产生促炎症因子,这些促炎症因子在EMPs的过程中占主导作用,在这个过程中,通过TNF-α刺激内皮细胞产生释放EMPs并引起白细胞介素8和细胞间黏附分子的升高,从而增强炎症反应,但阻断这条途径后不能完全阻断EMPs的产生,从而表明还有其它的信号通路参与了EMPs的形成并发挥病理生理效应,故其精确机制还需更多的实验研究[15-16]。ROCK-TRAIL途径:一些研究从基因的角度出发认为当内皮细胞受到凝血酶刺激后,凝血酶与内皮细胞上的G蛋白偶联蛋白激酶受体相结合,再通过凝血酶及肿瘤坏死因子超家族成员TRAIL细胞因子介导,并有核转录因子NF-κB参与及半胱氨酸天冬氨酸蛋白酶2(caspase-2)进一步激活ROCK-II,使得内皮细胞内大量转录基因表达,同时白细胞介素1及白细胞介素1α通过募集装配蛋白TRAFL和IRAQ1进一步扩大效应,最终引起EMPs的形成和释放[17-19]。但是目前尚不完全清楚对不同刺激因子上述这2种途径是独立起作用还是协同起作用,或只是在不同的刺激因子引起转导的信号通路所发挥作用的程度不同。另外,还发现ROCK-1和ROCK-II蛋白也参与内皮细胞凋亡时EMPs的释放,EMPs来源于内皮凋亡时的主要机制是与胞膜起泡有关,胞膜起泡使得细胞内容物重新动态分布,而且ROCK大量激活导致囊泡的形成通过调节细胞骨架的肌动蛋白和肌球蛋白,并引起各种炎症介质的表达,最终引起EMPs的释放[20]。
4 EMPs在高血压中的作用
4.1 EMPs在高血压中的表型和数量 迄今研究发现,高血压患者EMPs的表型主要类型有:CD31+/CD42-、CD31+/annexin V+、CD144+、CD31+/CD42-/annexin V+、CD62E+和 CD144+/CD62E+,其个体表达情况与患者的收缩压、舒张压、脉波传导速度以及糖尿病合并情况密切相关,见表1。
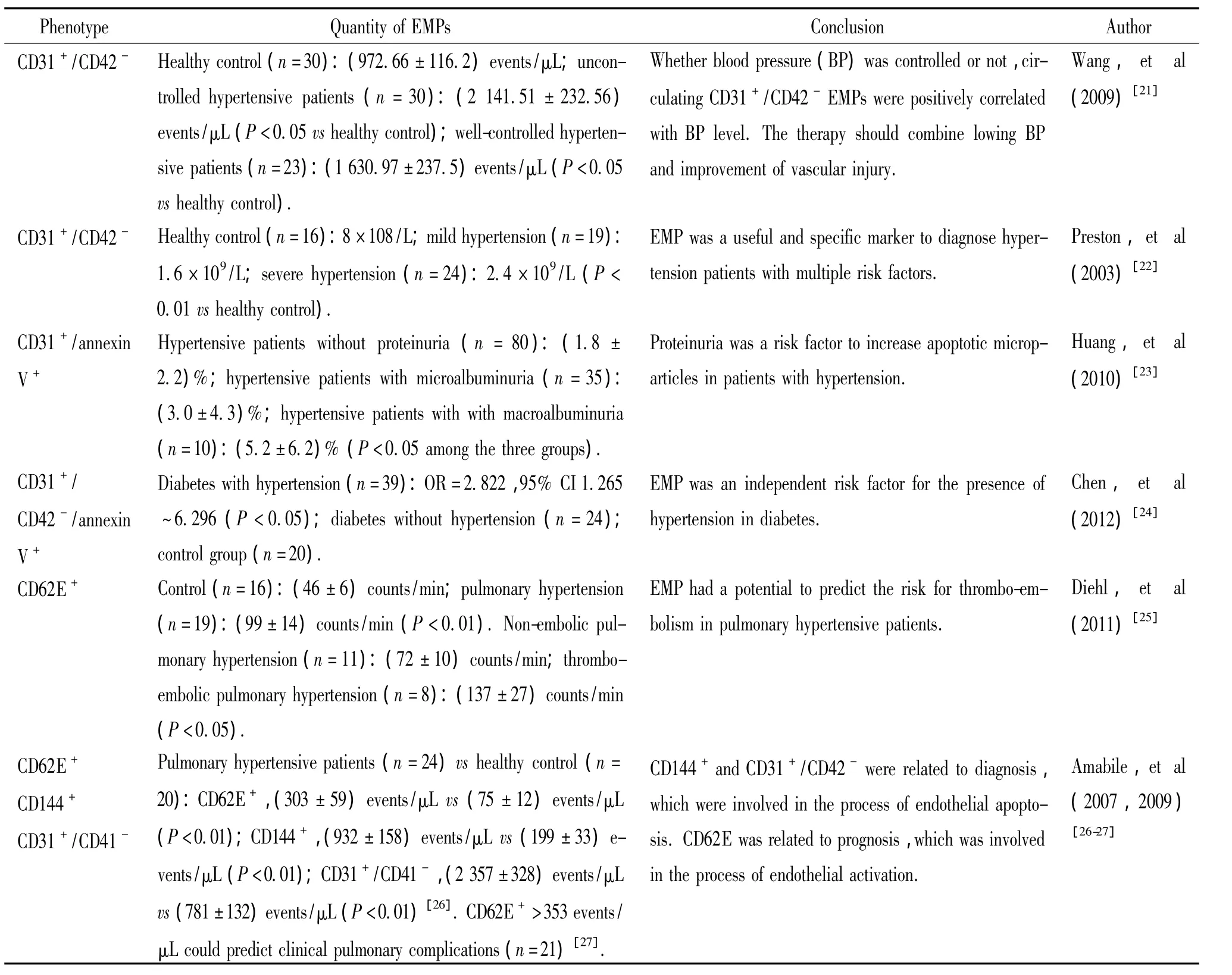
表1 临床高血压患者EMPs表型和数量特征Table 1.Phenotypes and quantity of EMPs in patients with hypertension
4.2 EMPs在原发性高血压中的作用 原发性高血压是指原因不明确的以动脉血压升高为主要表现的一种独立的全身性疾病,它能引起动脉、脑、心和肾脏等器官功能性及器质性损害。虽然迄今对原发性高血压确切的发病机制尚未完全阐明,但是大量的研究证据证明内皮功能障碍与原发性高血压的发生发展有着密切的关系,内皮功能障碍更是心血管疾病发生发展的早期标志[28]。内皮微粒是由激活或凋亡的血管内皮细胞产生,因此血浆中内皮微粒的水平与许多心血管疾病有着密切的联系。近年研究表明在原发性高血压患者中,血浆中EMP的数量水平明显高于健康人的基础水平。在2003年,Preston等[22]发现血浆中EMPs在患有严重高血压的患者中显著升高,并在高血压引起的靶器官损伤中扮演了重要的角色。更有文献报道相对于其它的内皮细胞相关标志物,血浆EMPs是内皮细胞损伤的最直接的产物,而且表型为CD42-/CD31+/CD62E+的 EMPs与平均动脉压有极大相关性,检测出表型为CD42-/CD31+/CD62E+的EMPs提示患者存在进行性的内皮细胞损害[29]。另一研究报道了血浆中EMPs水平在高血压和糖尿病患者中都明显高于正常人水平,并且可加剧糖尿病患者动脉硬化的发生[24]。亦有文献报道,与高血压相比,由糖尿病引起EMPs升高的数量级较高血压更高[30],从而更加说明EMPs与全身性血管损伤密切相关。研究者们还发现大量的EMPs释放会导致血管持续的损伤,表明EMPs的释放及其作用是一个动态过程[31]。
4.3 EMPs在肺动脉高压中的作用 肺动脉高压是由于肺动脉广泛梗阻或闭塞导致肺血管阻力的进一步升高,进而引起右心负荷增大,最终导致右心衰竭的一种疾病。该疾病致死率高,不给予治疗的话诊断后患者生存率不足3年,即使给予治疗生存率也不到4年。肺动脉高压患者早期一般没有症状,一经明确诊断往往到了晚期,因此早期诊断是患者得到及时治疗的关键。目前,临床上诊断肺动脉高压的方法主要包括心电图、彩色多普勒、右心导管检查等,这些方法对于早期诊断肺动脉高压并不特异,而且右心导管检查是有创性检查,不是常规的诊断方法,因此亟待一种能够无创性、早期发现诊断肺动脉高压的外周血标记物。
大量研究表明,不论何种病因引起的肺动脉高压,内皮细胞损伤[32]和功能障碍都参与了它的发生发展,内皮细胞通过增加细胞因子和黏附分子的分泌来破坏收缩及舒张血管因子的稳态,促使肺动脉高压的发生和发展。在肺动脉高压的发生发展过程中始终伴随着内皮细胞病理性的凋亡和激活[33],EMPs就是这种异常的激活和凋亡后损伤的内皮细胞的直接产物。已有研究证明EMPs在肺动脉高压患者血浆中含量显著升高[25],因此EMPs具有诊断肺动脉高压的潜在价值。
目前为止已经证实与肺动脉高压有关的EMPs的表型为 CD105+、CD62E+、CD144+和 CD31+/CD42-,其作用机制主要是通过影响肺血管的血流动力学及增加氧化应激使内皮细胞产生一氧化氮减少而导致内皮功能障碍,促进肺动脉高压的发展。内皮细胞微粒不仅仅具有诊断价值,Amabile等[26-27]发现,表达CD62E+的EMPs还对肺动脉高压的预后具有评估价值。EMP在肺动脉高压发展过程中的进一步病理生理作用尚需进一步研究。
5 展望
综上所述,EMPs对于高血压不仅具有诊断和预后价值而且还具有生物学效应和病理生理学作用。因此EMPs是高血压诊治中一个值得探索的新标志物。探讨EMPs的数量水平和表型特征在不同高血压及其不同阶段的诊断及预后价值和信号转导通路,将为更好的预防和治疗高血压及其并发症提供一个新指标。

