小型猪肝硬化模型肝脏病理及生化指标的变化
廖锦元,黄仲奎,黎宁钦,李佳梅
(广西医科大学第一附属医院1放射科;2肝移植科,南宁 530021)
本实验参考山西肝病研究所的方法[1],选择了改良后的四氯化碳(CCL4)、苯巴比妥、无水乙醇 +高脂、低蛋白、低胆碱食物复合因素造模法喂养小型猪制备肝硬化实验模型,分析肝纤维化-肝硬化变化过程中病理学及肝脏生化指标的变化。
1 材料和方法
1.1 实验动物
同种系巴马小型猪50头(随机分为实验组40头,对照组10头),雌雄不限,4月龄,体重15~20 kg,由广西医科大学动物实验中心提供(许可证号SCXK桂2010-003),实验前抽取耳背静脉血测量肝功能正常。
1.2 动物模型的建立
实验组的喂养:将65%的玉米面加35%的胆固醇混合组成饲料,先将 CCL4(0.2~0.3 mL/kg/d)、苯巴比妥钠(2 mg/kg/d)混入少量饲料中快速吃完,然后给予不含 CCL4和苯巴比妥钠的饲料,并给稀释成10%的无水乙醇作为唯一饮料,每日喂养1次,喂养24周直至形成肝硬化为止。对照组的喂养:给予65%的玉米面加35%的米糠作为饲料,清水作为唯一饮料,与实验组同期喂养。
1.3 病理组织学检查和肝脏生化指标检查
实验动物予以编号,每一例实验动物于造模的0、4、8、12、16、20、24 周末进行数据采集。
1.3.1 麻醉:动物术前12 h禁食、水,术前每头猪给予氯氨酮10~15 mg/kg+安定1~1.5 mg/kg+阿托品0.02 mg/kg耳后肌内注射基础麻醉。
1.3.2 抽血:开通耳背静脉,用肝素保留静脉通道,防止血液凝固,每头猪分别抽取血液5~10 mL,采出的血液放入干燥采血管。
1.3.3 病理学分析:18 G活检针经皮肝穿取肝左、右叶肝脏两份组织,大小约1 cm×0.2 cm,在10%甲醛溶液中固定24~48 h后取材,经石蜡包埋、常规切片后行苏木素-伊红染色(HE染色)和胶原纤维染色(Masson染色),显微镜下取40放大倍数观察。术后予80万单位青霉素预防感染,继续喂养。肝纤维化分级参照西安传染病会议所订标准[3],根据纤维组织增生情况,将肝纤维化分为 S0、S1、S2、S3、S4五期,以及肝硬化。
1.3.4 生化指标的检测:采集的血液标本30 min内放入普通常温高速离心机离心,转速为3 000 r/min,时间为10 min。离心后用移液器取上清液1 mL放入1.5 mL的 Ep管,贴上标签;放入-80℃冰箱中,待实验全部结束后一次性解冻,分别检测总胆红素(T.BIL),白蛋白(Alb),球蛋白(Glb),A/G比值,天冬氨酸转氨酶(AST),丙氨酸转氨酶(ALT),血清肌酐(Cr),凝血酶原时间(PT)。
1.4 实验数据分组
设正常对照组(S0期),轻度肝纤维化组(S1+S2期),重度肝纤维化/早期肝硬化组(S3+S4期),以及肝硬化组。
1.5 统计学分析方法
采用SPSS15.0软件进行统计学分析。分别对实验组和对照组以及实验组各组间数值进行统计学分析。所得结果用均数±标准差表示。两组均数的比较采用两独立样本的t检验,多组均数的比较采用单析因方差分析(One-Way ANOVA),方差不齐时应用非参数秩和检验(Kruskal-Wallis检验)P<0.05有统计学差异。
2 结果
2.1 造模一般情况
对照组10头无1例死亡。实验组40头猪24周末共死亡16头,24头存活;其中4周末因术中麻醉意外死亡1头;8周末因腹泻感染死亡3头;12周末因术中误伤胆管,衰竭死亡2头;16周末因术中麻醉意外死亡1头,衰竭死亡2头;20周末衰竭死亡3头;24周末衰竭死亡4头。24周末对照组造模存活率为100%(10/10),实验组造模存活率为60%(24/40)。
2.2 病理结果
2.2.1 一般情况:对照组0~24周肝脏组织病理表现正常。实验组0~24周末肝脏的组织病理学变化及小型猪造模死亡数如表1。
24周末,正常对照组获得数据 S0期70例次;实验组获得数据S0期47例次,轻度肝纤维化(S1+S2期)82例次,重度肝纤维化(S3+S4期)62例次,肝硬化共39例次。
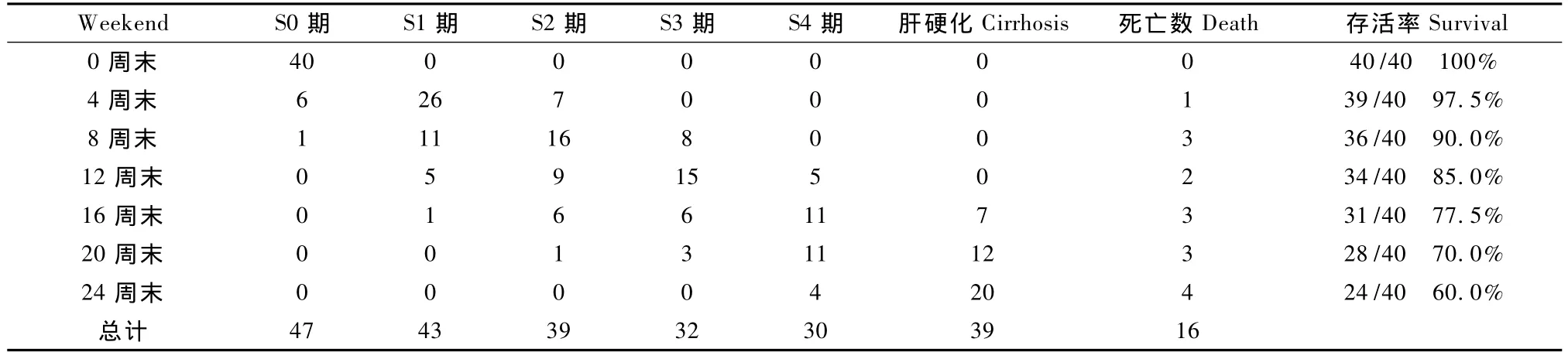
表1 实验组0~24周末病理变化及存活率(单位:例)。Tab.1 Pathological changes and survival of the mini-pigs at 0 ~24thweekend(cases).
表2肝硬化形成各个阶段生化指标的变化)。Tab.2Changes of biochemical indexes at different stages of liver fibrosis).
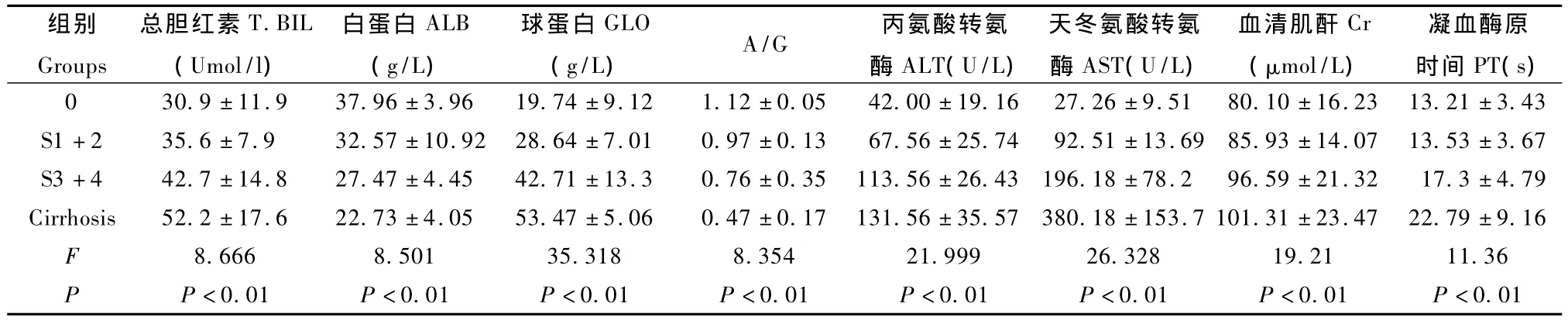
表2肝硬化形成各个阶段生化指标的变化)。Tab.2Changes of biochemical indexes at different stages of liver fibrosis).
注:One-way ANOVA 分析 LSD 法比较,T.BIL、ALB、GLO、A/G、Cr、PT各组间均有统计学差异,P <0.01。AST S0与 S1期没有差异,P >0.05,与S2~S4期均有差异,P<0.01。ALT各组间均有统计学差异,P<0.01。Note:One-way ANOVA analyses LSD method showed statistically significant difference of T.BIL,ALB,GLO,A/G,Cr,PT in the groups,P <0.01,failed to show significant difference of AST in stage S0 and S1,P >0.05,however,there was a significant difference in stages S2 to S4,P <0.01.There was a significant difference of ALT between different stages,P <0.01.
组别Groups总胆红素 T.BIL(Umol/l)白蛋白ALB(g/L)球蛋白GLO(g/L)A/G 丙氨酸转氨酶ALT(U/L)天冬氨酸转氨酶AST(U/L)血清肌酐Cr(μmol/L)凝血酶原时间PT(s)0 30.9 ±11.9 37.96 ±3.96 19.74 ±9.12 1.12 ±0.05 42.00 ±19.16 27.26 ±9.51 80.10 ±16.23 13.21 ±3<0.01.43 S1+2 35.6 ±7.9 32.57 ±10.92 28.64 ±7.01 0.97 ±0.13 67.56 ±25.74 92.51 ±13.69 85.93 ±14.07 13.53 ±3.67 S3+4 42.7 ±14.8 27.47 ±4.45 42.71 ±13.3 0.76 ±0.35 113.56 ±26.43 196.18 ±78.2 96.59 ±21.32 17.3 ±4.79 Cirrhosis 52.2 ±17.6 22.73 ±4.05 53.47 ±5.06 0.47 ±0.17 131.56 ±35.57 380.18 ±153.7 101.31 ±23.47 22.79 ±9.16 F 8.666 8.501 35.318 8.354 21.999 26.328 19.21 11.36 P P<0.01 P<0.01 P<0.01 P<0.01 P<0.01 P<0.01 P<0.01 P
2.2.2 不同级别肝组织的病理分级:S0级 肝小叶结构呈六面形,汇管区清楚,肝窦呈辐轮状分布,肝细胞呈多面形,核呈卵圆形,核膜清楚(图1、2);S1级肝小叶中央血管扩张充血,周围的肝细胞脂肪变性,肝细胞有点状坏死,汇管区轻度纤维结蒂组织增生伴少量淋巴、单核细胞浸润(图3、4);S2级肝细胞脂肪变性,肝小叶近中央静脉处肝细胞中-重度水变性,气球样变,灶状坏死,汇管区纤维组织增生,小叶结构存在(图5、6);S3级 肝细胞融合坏死,汇管区见较多的纤维间隔,小叶结构紊乱,无假小叶形成(图7、8);S4级肝细胞桥接坏死,肝细胞团呈不同程度的再生,大小不一的假小叶形成,小叶周边纤维间隔宽大疏松。有少量淋巴、单核细胞浸润(图9、10);肝硬化假小叶形成,纤维间隔包绕在假小叶周围,间隔内胶原纤维环绕假小叶周围呈平行排列(图11、12)(图1~12见文后彩插3~4)。
2.3 正常组和实验组生化指标的变化
从正常组到肝硬化组丙氨酸转氨酶、天冬氨酸转氨酶、总胆红素、血清肌酐及球蛋白呈逐渐升高的趋势,而白蛋白,A/G比值呈逐渐下降的趋势,凝血酶原时间则逐渐延长。详见表2。
3 讨论
肝纤维化、肝硬化动物模型的建立已有相关的文献报道,所采用的动物多为大鼠、兔等[2-4,5],而与人类更为接近的大型动物的肝硬化模型文献报道较少。本实验采用巴马小型猪进行研究有许多优点:(1)猪的心血管系统的解剖结构、消化系统、营养需要、骨骼发育以及矿物质代谢与人类十分相似,猪的脏器重量也近似于人。(2)巴马小型猪生长缓慢,性情温顺,且4个月龄左右猪的生理特点最接近人[6,7]。(3)猪的体重、体积明显大于大鼠、兔子,有利于手术操作。(4)猪的体积大小和驯服习性允许进行反复采样、进行各种外科手术,易于管理。故为临床上经常采用的实验动物[7-9]。本研究采用巴马小型猪建立起肝硬化模型,动态观察实验过程中肝组织的病理变化,以期深入的研究肝硬化的病理学、生化指标的变化。
3.1 小型猪肝硬化模型的制备
CCL4中毒性肝硬化化动物模型是一种经典的肝硬化造模方法[2,10,11],其机理主要是 CCL4能溶解肝细胞膜上的脂质成分,同时也影响肝细胞的细胞色素P450依赖型混合功能氧化酶的代谢,生成三氯甲基自由基和氯甲基自由基,启动脂质的过氧化作用,致肝细胞损伤、变性、坏死,长期反复刺激可造成肝纤维化、肝硬化的形成。苯巴比妥和无水乙醇均能诱导P450的活性从而增加CCL4的肝毒性,加速肝细胞的变性和坏死,而高脂、低蛋白、低胆碱物质则加重肝细胞的负荷,从而使得肝硬化形成的时间更短[2,4]。多种药物联合应用的复合因素造模法较单因素造模法优良,一方面药物的联合作用可以使得造模时间缩短,另一方面也减少各种药物的使用剂量以降低药物的不良反应和动物的不耐受性。
大鼠、家兔等小型动物的制模方法通常有腹腔注射、皮下或肌肉注射给药,猪的个体较大,依从性差,本组实验采用改良的混合饲料喂养法,实验组在16~24周末成功制备出肝硬化模型。
3.2 巴马小型猪肝硬化模型病理及生化指标的变化
本研究采用改良的CCL4复合因素造模法制备小型猪肝硬化模型,在投药后的第4周末,实验组已有部分病例的肝脏发生明显的病理变化,肝功能也开始出现异常。随着实验时间的延长,到24周末,实验组的肝脏病理从正常的肝纤维化S0期逐渐进展至肝硬化。肝功能的指标ALT、AST及TBIL也发生了变化,表现为S1~S4期、实验组与正常组对比呈逐渐逐渐升高的趋势,为肝细胞中毒的表现;肝脏是制造ALB的唯一场所,动物染毒后经历肝细胞坏死、增生、进而发生肝纤维化、肝硬化,肝功能持续受损,ALB表现为进行性降低,引起 A/G倒置。随着肝纤维化-肝硬化病程的进展,肝硬化性肾性损害以及肝脏的合成、储备、获得性凝血因子缺乏,肾小球的滤过率减低,血肌酐升高及PT延长。上述病理生化指标的变化,各组间有统计学差异 P<0.01,在不同的时间段表现出明显的阶段性特点。
有学者对国内几种常用的实验用小型猪的正常生化指标进行了对比研究,认为实验用巴马小型猪的正常生化指标与人类的近似[12,13]。本研究组中的正常对照组 T.BIL 为 30.9 ±11.9 μmol/L,ALB为37.96±3.96 g/L,ALT为 42.00±19.16 U/L,AST为27.26±9.51 U/L,PT为 13.21±3.43 s,与王爱德等[13]报道的巴马小型猪生化指标正常值近似。说明本研究组生化指标具有较好的可比性。
3.3 小型猪的制模时间与造模存活率
文献报道[2-4,5]动物的肝纤维化-肝硬化模型成模的时间长短不一,这与不同的方法所采用的实验动物以及制模方法不同有关。本组实验12周末5例出现早期肝硬化,16周末7例出现肝硬化,这与庞荣清等[14]采用猕猴进行肝纤维化造模出现的时间近似,大型动物耐受性较强,造模所需的时间较小型动物也较长。本组实验造模至24周末,早期肝纤维化进一步发展形成了不可逆转的肝硬化,此时纤维胶原包绕假小叶更为紧密,汇管区炎症几乎停止,这与临床病理反应过程表现一致。
随制模时间的延长,实验组小型猪死亡数也逐渐增加,这其中有手术意外致死3头,感染腹泻死亡3头,其余10头均为衰竭死亡。这一方面与造模晚期肝功能衰竭,抵抗力下降有关,另一方面也与多次手术操作,重复打击有关。本研究实验组24周末造模存活率 60%(24/40),与文献报道相近[15,16]。
[1] 韩德五,马学慧,赵元昌.肝硬化动物模型的研究[J].山西医药杂志,1979,4:1-6.
[2] 马学慧.肝纤维化动物模型的造作方法[J].中华肝脏病杂志,1996,4(1):58.
[3] 中华医学会传染病与寄生虫病学分会、肝病学分会.病毒性肝炎防治方案[J].中华传染病杂志,2001,19(1):56-62.
[4] 王丽春,赵连三.肝纤维化的实验动物模型[J].中国实验动物学报,2004,12(4):246-250.
[5] Sherlock S.Progress report:hepatic reaction to drugs[J].Gut 1999,20(4):634-642.
[6] 刘昌,吕毅,史源,等.巴马猪肝脏及其附属管道解剖学研究与异种移植设想[J].动物医学进展,2004,25(1):70-71.
[7] 詹纯列,徐本法,白朝晖.小型猪在医学实验中的应用[J].中国实验动物学杂志,2000,10(2):118-120.
[8] 李尧清,杨小玲,田英,等.外科动物实验中猪的麻醉问题[J].四川动物,2000,19(4):258-259.
[9] Gran D,Wall W,Mimeault R,et al.Successful intestinal transplantation in pigs treated with cyclosporine[J].Transplantation,1988,45(3):279.
[10] Jiang Z,You DY,Chen XC,et al.Monitoring of serum markers offibrosis during CCl4-induced liver damage—effects of antifibrotic agents[J].J Hepatol,1992,16(3):282 - 284.
[11] 郭秋,任克.四氯化碳复合法诱导家兔肝纤维化模型的建立[J].中国比较医学杂志,2011,21(3):36-38.
[12] 刘江伟,张永久,李泽信,等.长白猪仔血常规及生化指标正常值探讨[J].中国比较医学杂志,2007,17(7):393-396.
[13] 王爱德,郭亚芬,立柏,等.巴马小型猪血液生理指标[J].上海实验动物科学,2001,21(2):75-78.
[14] 庞荣清,刘建昆,何占龙,等.猕猴肝纤维化模型的建立与评价[J].世界华人消化杂志,2005,13(16):1956-1958.
[15] 周忠信,王捷,罗葆明.小型猪肝硬化模型建立过程中肝脏功能及组织病理学的改变[J].上海实验动物科学,2002,22(6):102-105.
[16] Mclean E,Mclean AEM,Sutton PM.Instant cirrhosis,an improved method for producing cirrhosis in rats by simultaneous administration of carbon tetrachloride and phenobarbitone[J].Br J Exp Pathol,1996,50(3):502 -510.

